Aluminium
Aluminium ist ein chemisches Element mit dem Elementsymbol Al und der Ordnungszahl 13.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Aluminium, Al, 13 | ||||||||||||||||||||||||||||||||||||
| Elementkategorie | Metalle | ||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 13, 3, p | ||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig | ||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-072-3 | ||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.248 | ||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 7,57 %[1] | ||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||
| Atommasse | 26,9815384(3)[3] u | ||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 125 (118) pm | ||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 121 pm | ||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 184[4] pm | ||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ne] 3s2 3p1 | ||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5,985769(3) eV[5] ≈577,54 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 18,82855(5) eV[5] ≈1816,68 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 28,447642(25) eV[5] ≈2744,78 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 119,9924(19) eV[5] ≈11577,5 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 153,8252(25) eV[5] ≈14841,9 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||
| Physikalisch [7] | |||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||
| Dichte | 2,6989 g/cm3 (20 °C)[8] | ||||||||||||||||||||||||||||||||||||
| Mohshärte | 2,75 | ||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 2,1 · 10−5)[9] | ||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 933,35 K (660,2[10] °C) | ||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2743 K[11] (2470 °C) | ||||||||||||||||||||||||||||||||||||
| Molares Volumen | 10,00 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 284 kJ/mol[11] | ||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 10,7[12] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 6250–6500 (Longitudinalwelle) m/s; 3100 (Scherwelle)[13][14] m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 897[1] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,06–4,26 eV[15] | ||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 37,7 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 235 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Mechanisch [16] | |||||||||||||||||||||||||||||||||||||
| E-Modul | 60 bis 78 kN/mm²[17] | ||||||||||||||||||||||||||||||||||||
| Poissonzahl | 0,34[18] | ||||||||||||||||||||||||||||||||||||
| Chemisch [19] | |||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 1, 2, 3 | ||||||||||||||||||||||||||||||||||||
| Normalpotential | −1,676 V (Al3+ + 3 e− → Al) | ||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,61 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||
Im Periodensystem gehört Aluminium zur dritten Hauptgruppe und zur 13. IUPAC-Gruppe, der Borgruppe, die früher als Gruppe der Erdmetalle bezeichnet wurde. Es gibt zahlreiche Aluminiumverbindungen.
Aluminium ist ein silbrig-weißes Leichtmetall. In der Erdhülle ist es, nach Sauerstoff und Silicium, das dritthäufigste Element und in der Erdkruste das häufigste Metall.
In der Werkstofftechnik werden mit „Aluminium“ alle Werkstoffe auf Basis des Elementes Aluminium verstanden. Dazu zählt Reinaluminium (mindestens 99,0 % Al), Reinstaluminium (min 99,7 % Al) und insbesondere die Aluminiumlegierungen, die bis zu mit Stahl vergleichbare Festigkeiten besitzen – bei nur einem Drittel seiner Dichte.
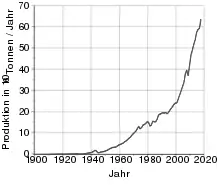
Entdeckt wurde Aluminium, das in der Natur fast ausschließlich in Form von chemischen Verbindungen vorkommt, im frühen 19. Jahrhundert. Im frühen 20. Jahrhundert setzte die industrielle Massenproduktion ein.
Die Gewinnung erfolgt in Aluminiumhütten ausgehend von dem Mineral Bauxit zunächst im Bayer-Verfahren, mit dem Aluminiumoxid gewonnen wird, und anschließend im Hall-Héroult-Prozess einer Schmelzflusselektrolyse, bei der Aluminium gewonnen wird. 2016 wurden weltweit 115 Mio. Tonnen Aluminiumoxid (Al2O3) produziert.[24] Daraus hat man 54,6 Mio. Tonnen Primäraluminium gewonnen.[25]
Das Metall ist sehr unedel und reagiert an frisch angeschnittenen Stellen bei Raumtemperatur mit Luft und Wasser zu Aluminiumoxid. Dies bildet aber sofort eine dünne, für Luft und Wasser undurchlässige Schicht (Passivierung) und schützt so das Aluminium vor Korrosion. Reines Aluminium weist eine geringe Festigkeit auf; bei Legierungen ist sie deutlich höher. Die elektrische und thermische Leitfähigkeit ist hoch, weshalb Aluminium für leichte Kabel und Wärmetauscher verwendet wird.
Eines der bekanntesten Produkte ist Alufolie. Weitere sind Bauteile in Fahrzeugen und Maschinen, elektrische Leitungen, Rohre, Dosen und Haushaltsgegenstände. Das Aluminiumrecycling erreicht weltweit Raten von etwa 40 %.
Geschichte
1782 vermutete Lavoisier als erster, dass es sich bei der 1754 von Marggraf aus einer Alaunlösung gewonnenen Alaunerde (alumina, abgeleitet von lateinisch alumen ‚Alaun‘) um das Oxid eines bislang unbekannten Elements handle. Dessen Darstellung glückte schließlich 1825 dem Dänen Hans Christian Ørsted durch Reaktion von Aluminiumchlorid (AlCl3) mit Kaliumamalgam, wobei Kalium als Reduktionsmittel diente:[26]
Davy, der sich lange Zeit ebenfalls an der Darstellung des neuen Elements versucht hatte, führte ab 1807 die Namensvarianten alumium, aluminum und aluminium ein, von welchen die letzten beiden im Englischen nebeneinander fortbestehen.[27][28]
1827 gelang es Friedrich Wöhler mit der gleichen Methode wie Ørsted, jedoch unter Verwendung metallischen Kaliums als Reduktionsmittel, reineres Aluminium zu gewinnen. Henri Étienne Sainte-Claire Deville verfeinerte den Wöhler-Prozess im Jahr 1846 und publizierte ihn 1859 in einem Buch. Durch diesen verbesserten Prozess stieg die Ausbeute bei der Aluminiumgewinnung, und in der Folge fiel der Preis des Aluminiums, der zuvor höher als jener von Gold gewesen war, innerhalb von zehn Jahren auf ein Zehntel.
1886 wurde unabhängig voneinander durch Charles Martin Hall und Paul Héroult das nach ihnen benannte Elektrolyseverfahren zur Herstellung von Aluminium entwickelt: der Hall-Héroult-Prozess. 1889 entwickelte Carl Josef Bayer das nach ihm benannte Bayer-Verfahren zur Isolierung von reinem Aluminiumoxid aus Bauxiten. Aluminium wird noch heute nach diesem Prinzip großtechnisch hergestellt.
Am Ende des 19. Jahrhunderts stand das Metall in solchem Ansehen, dass man daraus gefertigte Metallschiffe auf den Namen Aluminia taufte.
Vorkommen
Aluminium ist mit einem Anteil von 7,57 Gewichtsprozent nach Sauerstoff und Silicium das dritthäufigste Element der Erdkruste und damit das häufigste Metall. Allerdings kommt es aufgrund seines unedlen Charakters praktisch ausschließlich in gebundener Form vor. Die größte Menge befindet sich chemisch gebunden in Form von Alumosilicaten, in denen es in der Kristallstruktur die Position von Silicium in Sauerstoff-Tetraedern einnimmt. Diese Silicate sind zum Beispiel Bestandteil von Ton, Gneis und Granit.
Seltener wird Aluminiumoxid in Form des Minerals Korund und seiner Varietäten Rubin (rot) und Saphir (farblos, verschiedenfarbig) gefunden. Die Farben dieser Kristalle beruhen auf Beimengungen anderer Metalloxide. Korund hat mit fast 53 Prozent den höchsten Aluminiumanteil einer Verbindung. Einen ähnlich hohen Aluminiumanteil haben die noch selteneren Minerale Akdalait (etwa 51 Prozent) und Diaoyudaoit (etwa 50 Prozent). Insgesamt sind bisher (Stand: 2017) 1156 aluminiumhaltige Minerale bekannt.[29]
Das einzige wirtschaftlich wichtige Ausgangsmaterial für die Aluminiumproduktion ist Bauxit. Vorkommen befinden sich in Südfrankreich (Les Baux), Guinea, Bosnien und Herzegowina, Ungarn, Russland, Indien, Jamaika, Australien, Brasilien und den Vereinigten Staaten. Bauxit enthält ungefähr 60 Prozent Aluminiumhydroxid (Al(OH)3 und AlO(OH)), etwa 30 Prozent Eisenoxid (Fe2O3) und Siliciumdioxid (SiO2).
Bei der Herstellung unterscheidet man Primäraluminium, auch Hüttenaluminium genannt, das aus Bauxit gewonnen wird, und Sekundäraluminium aus Aluminiumschrott. Die Wiederverwertung benötigt nur etwa 5 Prozent der Energie der Primärgewinnung.
Aluminium als Mineral
Infolge der Passivierung kommt Aluminium in der Natur sehr selten auch elementar (gediegen) vor. Erstmals entdeckt wurde Aluminium 1978 durch B. V. Oleinikov, A. V. Okrugin, N. V. Leskova in Mineralproben aus der Billeekh Intrusion und dem Dyke OB-255 in der Republik Sacha (Jakutien) im russischen Föderationskreis Ferner Osten.[30][31] Insgesamt sind weltweit bisher rund 20 Fundorte (Stand 2019) für gediegen Aluminium bekannt, so unter anderem in Aserbaidschan, Bulgarien, der Volksrepublik China (Guangdong, Guizhou, Jiangsu und Tibet) und in Venezuela. Zudem konnte gediegen Aluminium in Gesteinsproben vom Mond, das die Sonde der Luna-20-Mission vom Krater Apollonius mitbrachte, nachgewiesen werden.[32]
Aufgrund der extremen Seltenheit hat gediegen Aluminium zwar keine Bedeutung als Rohstoffquelle, als gediegen vorkommendes Element ist Aluminium dennoch von der International Mineralogical Association (IMA) als eigenständiges Mineral anerkannt (Interne Eingangs-Nr. der IMA: 1980-085a).[33] Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Aluminium unter der System-Nummer 1.AA.05 (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe)[34] eingeordnet. In der veralteten 8. Auflage der Strunz’schen Mineralsystematik ist Aluminium dagegen noch nicht aufgeführt. Nur im zuletzt 2018 aktualisierten „Lapis-Mineralienverzeichnis“, das sich aus Rücksicht auf private Sammler und institutionelle Sammlungen noch an dieser Form der System-Nummerierung orientiert, erhielt das Mineral die System- und Mineral-Nr. I/A.3-05.[35] Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.01.01.05.[36]
In der Natur kommt gediegen Aluminium meist in Form körniger Mineral-Aggregate und Mikronuggets vor, kann in seltenen Fällen aber auch tafelige Kristalle bis etwa einen Millimeter Größe entwickeln. Frische Mineralproben sind von metallisch glänzender, silberweißer Farbe. An der Luft dunkeln die Oberflächen durch Oxidierung nach und wirken grau. Auf der Strichtafel hinterlässt Aluminium einen dunkelgrauen Strich.[35]
Je nach Fundort enthält Aluminium oft Fremdbeimengungen von anderen Metallen (Cu, Zn, Sn, Pb, Cd, Fe, Sb) oder tritt eingewachsen in beziehungsweise mikrokristallin verwachsen mit Hämatit, Ilmenit, Magnetit, Moissanit und Pyrit beziehungsweise Jarosit auf.[37]
Typmaterial, das heißt Mineralproben aus der Typlokalität des Minerals, wird im Geologischen Museum der Akademie der Wissenschaften in Jakutsk in der russischen Teilrepublik Sacha (Jakutien) aufbewahrt.[37]
Gewinnung
Primäraluminium (Herstellung aus Mineralien)
Ca. 2/3 des europäischen Aluminiumbedarfs wird durch Primäraluminium gedeckt. Primäraluminium wird elektrolytisch aus einer Aluminiumoxidschmelze hergestellt. Da diese aus den auf der Erde allgegenwärtigen Alumosilicaten nur schwer isoliert werden kann, erfolgt die großtechnische Gewinnung aus dem relativ seltenen, silikatärmeren Bauxit. Zur Gewinnung von reinem Aluminiumoxid aus Silikaten gibt es seit langem[38] Vorschläge, deren Anwendung allerdings nicht wirtschaftlich möglich ist.
Das im Erz enthaltene Aluminiumoxid/-hydroxid-Gemisch wird zunächst mit Natronlauge aufgeschlossen (Bayer-Verfahren, Rohrreaktor- oder Autoklaven-Aufschluss), um es von Fremdbestandteilen wie Eisen- und Siliciumoxid zu befreien, und wird dann überwiegend in Wirbelschichtanlagen (aber auch in Drehrohröfen) zu Aluminiumoxid (Al2O3) gebrannt.
Der trockene Aufschluss (Deville-Verfahren) hat dagegen keine Bedeutung mehr. Dabei wurde feinstgemahlenes, ungereinigtes Bauxit zusammen mit Soda und Koks in Drehrohröfen bei rund 1200 °C kalziniert und das entstehende Natriumaluminat anschließend mit Natronlauge gelöst.
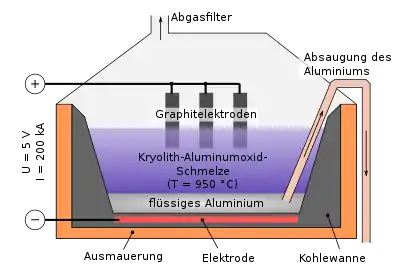
Die Herstellung des Metalls erfolgt in Aluminiumhütten durch Schmelzflusselektrolyse von Aluminiumoxid nach dem Kryolith-Tonerde-Verfahren (Hall-Héroult-Prozess). Zur Herabsetzung des Schmelzpunktes wird das Aluminiumoxid zusammen mit Kryolith geschmolzen (Eutektikum bei 963 °C).[39] Bei der Elektrolyse entsteht an der den Boden des Gefäßes bildenden Kathode Aluminium und an der Anode Sauerstoff, der mit dem Graphit (Kohlenstoff) der Anode zu Kohlenstoffdioxid und Kohlenstoffmonoxid reagiert. Die Graphitblöcke, welche die Anode bilden, brennen so langsam ab und werden von Zeit zu Zeit ersetzt. Die Graphitkathode (Gefäßboden) ist gegenüber Aluminium inert. Das sich am Boden sammelnde flüssige Aluminium wird mit einem Saugrohr abgesaugt.


Aufgrund der hohen Bindungsenergie durch die Dreiwertigkeit des Aluminiums und der geringen Atommasse ist der Prozess recht energieaufwendig. Pro produziertem Kilogramm Rohaluminium müssen 12,9 bis 17,7 Kilowattstunden an elektrischer Energie eingesetzt werden.[40][41] Eine Reduzierung des Strombedarfs ist nur noch in geringem Ausmaß möglich, weil die Potentiale für energetische Optimierungen weitgehend erschlossen sind.[42] Aluminiumherstellung ist daher nur wirtschaftlich, wenn billige Elektroenergie zur Verfügung steht.
| Rang | Land | Produktion | Reserven |
|---|---|---|---|
| 1 | 105.000 | 5.100.000 | |
| 2 | 70.000 | 1.000.000 | |
| 3 | 67.000 | 7.400.000 | |
| 4 | 34.000 | 2.700.000 | |
| 5 | 23.000 | 660.000 | |
| 6 | 9.020 | 2.000.000 | |
| 7 | 17.000 | 1.200.000 | |
| 8 | 5.570 | 500.000 | |
| 9 | 4.050 | 190.000 | |
| 10 | 4.000 | 3.700.000 | |
Die nachfolgende Tabelle zeigt die Aluminiumproduktion 2019 und die maximal mögliche Produktionsleistung der Hüttenwerke nach Ländern.
| Rang | Land | Produktion | Kapazität |
|---|---|---|---|
| 1 | 35.000 | 41.300 | |
| 2 | 3.640 | 4.060 | |
| 3 | 3.640 | 43.020 | |
| 4 | 2.850 | 3.270 | |
| 5 | 2.600 | 2.700 | |
| 6 | 1.570 | 1.720 | |
| 7 | 1.400 | 1.430 | |
| 8 | 1.370 | 1.540 | |
| 9 | 1.093 | 1.790 | |
| 10 | 845 | 890 | |
Sekundäraluminium (Herstellung durch Aluminium-Recycling)
Um Aluminium zu recyceln, werden Aluminiumschrotte und „Krätzen“ in Trommelöfen eingeschmolzen. „Krätze“ ist ein Abfallprodukt bei der Verarbeitung von Aluminium und bei der Herstellung von Sekundäraluminium. Krätze ist ein Gemisch aus Aluminiummetall und feinkörnigen Oxidpartikeln und wird beim Schmelzen von Aluminium bei 800 °C aus dem Aluminiumoxid der normalen Aluminiumkorrosion und als Oxidationsprodukt (Oxidhaut) beim Kontakt von flüssigem Aluminium mit Luftsauerstoff gebildet. Damit beim Aluminiumgießen keine Aluminiumoxidpartikel in das Gussteil gelangen, wird die Krätze durch Kratzvorrichtungen von der Oberfläche des Metallbads abgezogen.
Um die Bildung von Krätze zu verhindern, wird die Oberfläche der Schmelze mit Halogenidsalzen (rund zwei Drittel NaCl, ein Drittel KCl und geringe Mengen Calciumfluorid CaF2) abgedeckt (siehe dazu Aluminiumrecycling). Dabei entsteht als Nebenprodukt Salzschlacke, die noch ca. 10 Prozent Aluminium enthält, die, entsprechend aufbereitet, als Rohstoff für mineralische Glasfasern dient.[45]
Allerdings wird an der Herstellung von Sekundäraluminium kritisiert, dass beim Recycling pro Tonne jeweils 300 bis 500 Kilogramm Salzschlacke, verunreinigt mit Dioxinen und Metallen, entstehen; deren mögliche Wiederverwertung ist aber Stand der Technik.[46][47]
Eigenschaften
Physikalische Eigenschaften


Mikrostruktur
Aluminium erstarrt ausschließlich in einem kubisch flächenzentrierten Raumgitter in der Raumgruppe Fm3m (Raumgruppen-Nr. 225). Der Gitterparameter beträgt bei Reinaluminium 0,4049 nm[48] (entspricht 4,05 Å) bei 4 Formeleinheiten pro Elementarzelle.[49]
Leerstellen kommen mit einer Dichte von 1,3 × 10−4 bei 500 °C vor, bei Raumtemperatur sind es nur noch 10−12. Durch Abschrecken können größere Leerstellendichten bei Raumtemperatur vorkommen, was für einige Eigenschaften von Aluminiumwerkstoffen von Bedeutung ist, da die Leerstellen die Diffusion begünstigen. Durch Umformen bei Raumtemperatur kann die Leerstellendichte auf 10−4 erhöht werden. Die Versetzungsdichte liegt bei 10−7, einem für Metalle typischen Bereich, und führt zur guten Umformbarkeit von Aluminium. Stapelfehler konnten bei Aluminium nicht nachgewiesen werden, was mit der hohen Stapelfehlerenergie von 103 bis 200 (10−7 J/cm²) erklärt wird. Dies führt dazu, dass die Festigkeitssteigerung beim Kaltwalzen und -schmieden nur gering ausfällt und manche Aluminiumwerkstoffe sogar anschließend zur Entfestigung neigen.[50]
Dichte
Mit einer Dichte von 2,6989 g/cm³[51] (etwa ein Drittel von Stahl) ist Aluminium ein typisches Leichtmetall, was es als Werkstoff für den Leichtbau interessant macht. Die Dichte der Legierungen weicht meist nur um etwa +3 % bis −2 % ab. Spezielle Legierungen mit Lithium haben eine 15 % geringere Dichte. Aluminium zählt somit zu den leichtesten Werkstoffen, übertroffen nur noch von Magnesium.[52]
Mechanische Eigenschaften
Aluminium ist ein relativ weiches und zähes Metall. Die Zugfestigkeit von absolut reinem Aluminium liegt bei 45 N/mm², die Streckgrenze bei 17 N/mm² und die Bruchdehnung bei 60 %, während bei handelsüblich reinem Aluminium die Zugfestigkeit bei 90 N/mm² liegt, die Streckgrenze bei 34 N/mm² und die Bruchdehnung bei 45 %.[53] Die Zugfestigkeit seiner Legierungen liegt dagegen bei bis zu 710 N/mm² (Legierung 7068). Sein Elastizitätsmodul liegt bei etwa 70 GPa,[53] einem häufig angegebenen Wert. Für Reinaluminium wird ein Wert von 66,6 GPa angegeben,[51][54] die Werte schwanken jedoch von 60 bis 78 GPa.[55] Der G-Modul liegt bei 25,0 kN/mm²,[56] die Querkontraktionszahl (Poissonzahl) bei 0,35.[51]
Thermische Eigenschaften
Die Schmelztemperatur liegt bei 660,2 °C und die Siedetemperatur bei 2470 °C. Die Schmelztemperatur ist deutlich niedriger als die von Kupfer (1084,6 °C), Gusseisen (1147 °C) und Eisen (1538 °C), was Aluminium zu einem guten Gusswerkstoff macht.
Bei einer Sprungtemperatur von 1,2 K wird reines Aluminium supraleitend.[57]
Die Wärmeleitfähigkeit liegt mit 235 W/(K m) relativ hoch. Die Wärmeleitfähigkeit von Kupfer liegt zwar etwa doppelt so hoch, dafür ist die Dichte etwa viermal größer, weshalb Aluminium für Wärmetauscher in Fahrzeugen genutzt wird.[58] Der Wärmeausdehnungskoeffizient ist durch den recht niedrigen Schmelzpunkt mit 23,1 µm·m−1·K−1 recht hoch.
Die Schwindung, also die Volumenabnahme beim Erstarren liegt bei 7,1 %.[51]
Elektrische Eigenschaften
Da thermische und elektrische Leitfähigkeit bei Metallen von denselben Mechanismen dominiert werden, ist Aluminium mit auch ein sehr guter elektrischer Leiter. In der Rangfolge der Elemente mit der größten spezifischen Leitfähigkeit steht Aluminium wie auch bei der Wärmeleitfähigkeit hinter Silber, Kupfer und Gold an vierter Stelle. Durch die Kombination von hohem spezifischem Leitwert, geringer Dichte, hoher Verfügbarkeit und (im Vergleich zu anderen Materialien) geringen Kosten ist Aluminium in der Elektrotechnik – speziell in der Energietechnik, wo große Leiterquerschnitte benötigt werden – neben Kupfer zum wichtigsten Leitermaterial geworden.[59]
Magnetische Eigenschaften
Aluminium ist paramagnetisch, wird also von Magneten angezogen, der Effekt ist jedoch sehr schwach ausgeprägt. Die Magnetische Suszeptibilität liegt bei Raumtemperatur bei 0,62 × 10−9 m³/kg, womit Aluminium praktisch gesehen unmagnetisch ist.[60]
Chemische Eigenschaften
Das reine Leichtmetall Aluminium hat aufgrund einer sich sehr schnell an der Luft bildenden dünnen Oxidschicht ein stumpfes, silbergraues Aussehen. Diese passivierende Oxidschicht macht reines Aluminium bei pH-Werten von 4 bis 9 sehr korrosionsbeständig. Die Oxidschicht ist etwa 0,05 µm dick.[61] Sie schützt vor weiterer Oxidation, ist aber bei der elektrischen Kontaktierung und beim Löten hinderlich. Durch elektrische Oxidation (Eloxieren) oder auf chemischem Weg kann eine 5 bis 25 µm dicke Schicht erzeugt werden.
Die Oxidschicht kann mittels Komplexbildungsreaktionen aufgelöst werden.
Aluminium geht in neutraler chloridischer Lösung einen sehr stabilen und wasserlöslichen Neutralkomplex ein. Die folgende Reaktionsgleichung veranschaulicht dies:
Dies geschieht vorzugsweise an Stellen, wo die Oxidschicht des Aluminiums bereits geschädigt ist. Es kommt dort zu Lochfraßkorrosion: Löchern entstehen. Kann die chloridische Lösung dann an die freie Metalloberfläche treten, so laufen andere Reaktionen ab. Aluminium-Atome können unter Komplexierung oxidiert werden:
Liegt in der Lösung Ionen eines edleren Metalls (→elektrochemische Spannungsreihe) vor, so werden sie reduziert und am Aluminium abgeschieden. Auf diesem Prinzip basiert die Reduktion von Silberionen, die auf der Oberfläche von angelaufenem Silber als Silbersulfid vorliegen, hin zu Silber.
Aluminium reagiert heftig mit wässriger Natriumhydroxidlösung (NaOH) (und etwas weniger heftig mit wässriger Natriumcarbonatlösung) unter Bildung von Wasserstoff. Diese Reaktion wird in chemischen Rohrreinigungsmitteln genutzt. Die Reaktion von Aluminium mit NaOH läuft in zwei Schritten ab: der Reaktion mit Wasser und die Komplexierung des Hydroxids zu Natriumaluminat.
Bei der Reaktion mit Wasser
entsteht zunächst Aluminiumhydroxid.
In der Regel wird anschließend die Oberfläche getrocknet; dabei wird das Hydroxid in das Oxid umgewandelt:
Dies passiert aber nicht bei der Reaktion von Aluminium in wässriger Natronlauge.
Nun folgt der 2. Schritt, die Komplexierung des Hydroxids zu Natriumaluminat:
Durch die Komplexierung wird das gallertartige Hydroxid wasserlöslich und kann von der Metalloberfläche abtransportiert werden. Dadurch ist die Aluminiumoberfläche nicht mehr vor dem weiteren Angriff des Wassers geschützt und Schritt 1 läuft wieder ab.
Mit dieser Methode lassen sich – ebenso wie bei der Reaktion von Aluminium mit Säuren – pro zwei Mol Aluminium drei Mol Wasserstoffgas herstellen.
Aluminium reagiert bei Zimmertemperatur mit Brom; hierbei entstehen Flammen. Das entstehende Aluminiumbromid reagiert mit Wasser unter Bildung von Aluminiumhydroxid und Bromwasserstoffsäure.
Quecksilber und Aluminium bilden Aluminiumamalgam. Wenn Quecksilber direkt mit Aluminium zusammenkommt, d. h., wenn die Aluminiumoxidschicht an dieser Stelle mechanisch zerstört wird, frisst Quecksilber Löcher in das Aluminium; unter Wasser wächst dann darüber Aluminiumoxid in Gestalt eines kleinen Blumenkohls. Quecksilber wird in der Luftfahrt deshalb als Gefahrgut und „ätzende Flüssigkeit“ gegenüber Aluminiumwerkstoffen eingestuft.[62]
Mit Salzsäure reagiert Aluminium sehr heftig unter Wasserstoffentwicklung. Von Schwefelsäure wird es langsam aufgelöst. In Salpetersäure wird es passiviert.
In Pulverform (Partikelgröße kleiner 500 µm) ist Aluminium vor allem dann, wenn es nicht phlegmatisiert ist, wegen seiner großen Oberfläche sehr reaktiv. Aluminium reagiert dann mit Wasser unter Abgabe von Wasserstoff zu Aluminiumhydroxid. Feinstes, nicht phlegmatisiertes Aluminiumpulver wird auch als Pyroschliff bezeichnet. Nicht phlegmatisierter Aluminiumstaub ist sehr gefährlich und entzündet sich bei Luftkontakt explosionsartig von selbst.
Isotope
In der Natur kommt ausschließlich das Isotop 27Al vor; Aluminium gehört damit zu den Reinelementen. Dieses Isotop, das stabil ist und im Kern 14 Neutronen und 13 Protonen enthält, absorbiert keine Neutronen, weshalb Aluminium in Kernreaktoren genutzt wird. Alle anderen Isotope werden künstlich erzeugt und sind radioaktiv. Das stabilste dieser Isotope ist 26Al mit einer Halbwertszeit von einer Million Jahren. Durch Elektroneneinfang oder Beta-Zerfall entsteht daraus 26Mg, durch Einfangen eines Neutrons und anschließenden Gamma-Zerfall 27Al. Die Isotope 24Al bis 29Al (Außer 26Al und 27Al) haben Halbwertszeiten zwischen wenigen Sekunden und einigen hundert Sekunden. 23Al zerfällt mit einer Halbwertszeit von nur 0,13 Sekunden.[63]
Aluminiumlegierungen
Aluminiumlegierungen sind Legierungen, die überwiegend aus Aluminium bestehen. Für andere Legierungen, die Aluminium enthalten, siehe Abschnitt #Weitere Anwendungen.
Aluminium kann mit zahlreichen Metallen legiert werden, um bestimmte Eigenschaften zu fördern oder andere, ungewünschte Eigenschaften zu unterdrücken. Bei einigen Legierungen ist die Bildung der schützenden Oxidschicht (Passivierung) stark gestört, wodurch die daraus gefertigten Bauteile teils korrosionsgefährdet sind. Nahezu alle hochfesten Aluminiumlegierungen sind von dem Problem betroffen.
Es gibt Aluminiumknetlegierungen, die zur Weiterverarbeitung durch Walzen, Schmieden und Strangpressen gedacht sind und Gusswerkstoffe. Diese werden in Gießereien verwendet.[51][64]
Im Allgemeinen werden Aluminiumlegierungen in die zwei große Gruppen der Knet- und Gusslegierungen eingeteilt:[51][65]
- Aluminiumgusslegierungen. Typische Aluminiumgusslegierungen enthalten Silicium als Hauptlegierungselement (AlSi), es gibt aber auch Sorten mit Kupfer oder Magnesium als Gusslegierungen.[51][66]
- Aluminiumknetlegierungen, sie haben einen Anteil von etwa 75 % und werden weiter unterteilt nach dem Hauptlegierungselement(en) in
- Reinaluminium mit Aluminiumgehalten von 99,0 % bis 99,9 %. Sie sind sehr leicht zu bearbeiten, haben geringe Festigkeit und gute Korrosionsbeständigkeit.[51][67]
- Aluminium-Kupfer-Legierungen (AlCu): Sie haben mittlere bis hohe Festigkeit, sind aushärtbar, aber korrosionsanfällig und schlecht schweißbar. Sie können Zusätze von Magnesium oder Mangan enthalten.[51][68]
- Aluminium-Mangan-Legierungen (AlMn): Sie haben geringe bis mittlere Festigkeit, sind korrosionsbeständig und gut zu verarbeiten.[51][69]
- Aluminium-Magnesium-Legierungen (AlMg, ohne AlMgSi): Sie haben mittlere Festigkeiten, sind nicht aushärtbar, korrosionsbeständig, gut umformbar und schweißbar. Die meisten Sorten enthalten zusätzlich noch Mangan (AlMg(Mn)).[51][70]
- Aluminium-Magnesium-Silicium-Legierungen (AlMgSi): Sie haben mittlere bis hohe Festigkeiten, sind gut zu bearbeiten durch Schweißen und Strangpressen, aushärtbar und korrosionsbeständig.[51][71]
- Aluminium-Zink-Magnesium-Legierungen (AlZnMg): Kupferfreie Sorten haben mittlere bis hohe Festigkeiten und sind gut schweißbar. Kupferhaltige Sorten (AlZnMg(Cu)) haben hohe Festigkeiten – im Falle 7075 über 500 MPa – sind nicht durch Schmelzschweißen, jedoch gut durch Zerspanen (Fräsen, Bohren) zu bearbeiten.[51][72]
- Sonderlegierungen, beispielsweise Aluminium-Lithium-Legierungen mit besonders geringer Dichte, oder Automatenlegierungen die besonders gut zerspanbar sind.[73]
Außerdem wird unterschieden zwischen naturharten Legierungen – welche sich durch eine Wärmebehandlung nicht härten lassen – und aushärtbaren:
- Typische naturharte Aluminiumknetlegierungen sind: AlMg, AlMn, AlMgMn, AlSi
- Aushärtbare Knetlegierungen – Festigkeitssteigerung durch Ausscheidungshärtung von Legierungselementen bei einer zusätzlichen Alterungsglühung bei 150 bis 190 °C. Typische aushärtbare Aluminiumknetlegierungen sind: AlMgSi, AlCuMg, AlZnMg. Die erste hochfeste, aushärtbare Aluminiumlegierung AlCuMg bekam 1907 die Handelsbezeichnung Duraluminium, kurz „Dural“ genannt.
Wirtschaftliche Bedeutung
Aluminium ist nach Stahl der zweitwichtigste metallische Werkstoff. 2016 wurden weltweit 115 Mio. Tonnen produziert.[74]
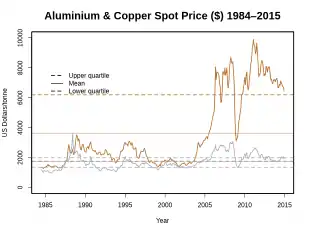
Der Aluminiumpreis bewegte sich am Weltmarkt seit 1980 um den Wert von 2000 Dollar pro Tonne (Reinheit von 99,7 %). Er ist jedoch relativ volatil, 2016 fiel er auf um die 1500 Dollar pro Tonne, während er 2017 wieder bei annähernd 2000 Dollar lag.[75]
Im August 2020 verhängte die USA (Regierung Trump) 10 % Einfuhrzoll auf Aluminium aus Kanada, um die inländische Produktion zu schützen.[76]
Verwendung
Konstruktionswerkstoff allgemein

Aluminium weist eine hohe spezifische Festigkeit auf. Verglichen mit Stahl sind Bauteile aus Aluminium bei gleicher Festigkeit etwa halb so schwer, weisen jedoch ein größeres Volumen auf.[77] Deshalb wird es gern im Leichtbau verwendet, also dort, wo es auf geringe Masse ankommt, die zum Beispiel bei Transportmitteln zum geringeren Treibstoffverbrauch beiträgt, vor allem in der Luft- und Raumfahrt. Im Kraftfahrzeugbau gewann es aus diesem Grund an Bedeutung; hier standen früher der hohe Materialpreis, die schlechtere Schweißbarkeit sowie die problematische Dauerbruchfestigkeit und die Verformungseigenschaften bei Unfällen (geringes Energieaufnahmevermögen in der sogenannten Knautschzone) im Wege. Die Haube des Washington-Denkmals, ein 3 kg schweres Gussstück, galt bis 1884 als eines der größten Aluminiumwerkstücke.[78] Beim Bau von kleinen und mittleren Schiffen und Booten wird die Korrosionsbeständigkeit von Aluminium gegenüber Salzwasser geschätzt.[79] Der Fahrzeugbau (inklusive Schiffen, Flugzeugen und Schienenfahrzeugen) machte 2010 mit ca. 35 Prozent den größten Anteil an der weltweiten Verwendung von Aluminium aus.[80]
In Aluminiumlegierungen werden Festigkeiten erreicht, die denen von Stahl nur wenig nachstehen. Daher ist die Verwendung von Aluminium zur Gewichtsreduzierung überall dort angebracht, wo Materialkosten eine untergeordnete Rolle spielen. Insbesondere im Flugzeugbau und in der Weltraumtechnik sind Aluminium und Duraluminium weit verbreitet. Der größte Teil der Struktur heutiger Verkehrsflugzeuge wird aus Aluminiumblechen verschiedener Stärken und Legierungen genietet.
Fahrzeugbau
Bei Fahrzeugen spielt deren Masse eine Rolle: Je leichter ein Fahrzeug ist desto geringer ist der Treibstoffverbrauch. In Deutschland werden knapp 50 % des Aluminiums im Fahrzeugbau verwendet (Stand: 2015).[81]
- Autos
Bei Autos werden Aluminiumwerkstoffe verwendet für verschiedene Motorkomponenten – darunter der Motorblock, die Zylinderkolben für die spezielle Kolbenlegierungen existieren, die Zylinderköpfe – wo vor allem die geringe Wärmeausdehnung und Korrosionsanfäligkeit sowie die hohe Warmfestigkeit ausschlaggebend sind; zusammen mit der guten Gießbarkeit, da diese Komponenten üblicherweise gegossen werden. Weitere Anwendungen bei Fahrzeugen sind für Gehäuse von Getrieben, als Wärmeabschirmung und als Wärmetauscher – bei den letzten beiden in Form von Reinaluminium. Im Fahrwerk wird Aluminium genutzt als Schmiedeteile für Hinterachsen, Achsträger, Querlenker und Räder. In der Karosserie wird Aluminium verwendet für Türen, Motorhauben, Stoßfänger und Kotflügel, sowie in der Rohwagenstruktur.[82]
- Nutzfahrzeuge
Bei Nutzfahrzeugen wird Aluminium angewandt für Bordwände, Ladebordwände, Aufbauten, zur Ladungssicherung, Druckluftbehälter, Treibstofftanks und als Unterbauschutz. Der Leichtbau mit Aluminium wird bei Nutzfahrzeugen stark durch die gesetzliche Maximallast pro Achse beeinflusst: Bei geringerem Fahrzeuggewicht ist eine höhere Nutzlast möglich.[82]
- Schienenfahrzeuge
Auch bei Schienenfahrzeugen wird reichlich Aluminium verwendet. Voraussetzung waren dafür zwei wichtige andere Entwicklungen: Bestimmte Schweißverfahren die für Aluminiumwerkstoffe geeignet sind (WIG-Schweißen / MIG-Schweißen) in den 1950ern und das Strangpressen von Großprofilen. Die Verwendung von Aluminium hat die gesamte Bauweise von Schienenfahrzeugen verändert. Bis etwa 1970 waren Konstruktionen aus Stahlrohren üblich, danach vermehrt verschweißte Profile aus Aluminium.[83]
- Flugzeuge
Bereits in der Anfangsphase der Luftfahrt wurden Aluminiumwerkstoffe genutzt, 1903 beispielsweise Magnalium für die Beschläge eines Flugzeuges, das noch größtenteils aus Holz, Draht und Tuch bestand. Das erste flugfähige Ganzmetallflugzeug stammt aus dem Jahre 1915, bestand allerdings aus Stahlblechen in Schalenbauweise. Die entscheidende Entwicklung zur Verwendung von Aluminium im Flugzeugbau stammt von 1906 von Alfred Wilm, der mit dem Duraluminium eine aushärtbare Aluminium-Kupfer-Legierung fand, die sehr hohe Festigkeiten aufweist und sich daher ausgezeichnet für den Leichtbau eignet. Genutzt werden für Flugzeuge AlCu und AlZnMg. Die Gesamtmasse von Flugzeugen geht zu 60 % auf Aluminium zurück. Die Verbindung der aus Blechen gestanzten, geschnittenen oder getriebenen, aus dem Vollen gefrästen oder aus Profilen bestehenden Werkstücke erfolgt meist durch Nieten, da die meistverwendeten Werkstoffe schlecht schweißbar sind.[84]
- Fahrräder
Bei Sport- und Alltagsrädern, hat Aluminium bei vielen Bauteilen Stahl abgelöst. Bei Felgen gab es im Rennsport auch Holzfelgen, bevor sich Alufelgen durchsetzten – diese sind griffiger für Bremsbacken, verschleißen jedoch dabei. Alurahmenrohre wurden zuerst – um 1970 – mit Epoxidkleber gefügt, später geschweißt. Bei Gepäcksträgern und Seitenständern kommt Alu als Draht, Guss und Rohr vor. Lenker, Vorbau, Bremsgriffe, Kurbeln und Ketten-Schaltwerk sind seit langem typisch aus Alu. Kotschützer sind häufig aus kunststoffumhülltem Alu.
Elektrische Leitungen

Aluminium ist ein guter elektrischer Leiter. Es weist nach Silber, Kupfer und Gold die vierthöchste elektrische Leitfähigkeit aller Metalle auf. Ein Leiter aus Aluminium hat bei gegebenem elektrischen Widerstand eine kleinere Masse, aber ein größeres Volumen als ein Leiter aus Kupfer. Daher wird meistens dann Kupfer als elektrischer Leiter verwendet, wenn das Volumen eine dominante Rolle spielt, wie bei den Wicklungen in Transformatoren. Aluminium hat dann als elektrischer Leiter Vorteile, wenn das Gewicht eine wesentliche Rolle spielt, beispielsweise bei den Leiterseilen von Freileitungen.[85] Aus dem Grund der Gewichtsreduktion werden in Flugzeugen wie dem Airbus A380 Aluminiumkabel verwendet.
Aluminium wird unter anderem zu Stromschienen in Umspannwerken und zu stromführenden Gussteilen verarbeitet. Für Elektroinstallationen gibt es kupferkaschierte Aluminiumkabel, der Kupferüberzug ist zur Verbesserung der Kontaktgabe. In diesen Anwendungsbereichen sind primär Rohstoffpreise entscheidend, da Aluminium preisgünstiger als Kupfer ist. Für Oberleitungen bei elektrischen Bahnen ist es dagegen aufgrund seiner schlechten Kontakt- und Gleiteigenschaften ungeeignet, in diesem Bereich wird trotz des höheren Gewichts primär Kupfer eingesetzt.
Beim Kontaktieren unter Druck ist Aluminium problematisch, da es zum Kriechen neigt. Außerdem überzieht es sich an Luft mit einer Oxidschicht. Nach längerer Lagerung oder Kontakt mit Wasser ist diese isolierende Schicht so dick, dass sie vor der Kontaktierung beseitigt werden muss. Vor allem im Kontakt mit Kupfer kommt es zu Bimetallkorrosion. Bei ungeeigneten Kontaktierungen in Klemmen kann es bei Aluminiumleitern in Folge zu Ausfällen und Kabelbränden aufgrund sich lösender Kontakte kommen. Crimpverbindungen mit passenden Hülsen und Werkzeugen sind jedoch sicher. Als Zwischenlage zwischen Kupfer und Aluminium können Verbindungsstücke aus Cupal die Kontaktprobleme vermeiden.
Hervorzuheben ist das geringe Absinken der spezifischen elektrischen Leitfähigkeit von Aluminium bei Zusatz von Legierungsbestandteilen, wohingegen Kupfer bei Verunreinigungen eine deutliche Verringerung der Leitfähigkeit zeigt.
Elektronik

Die Elektronikindustrie setzt Aluminium aufgrund der guten Verarbeitbarkeit und der guten elektrischen und Wärme-Leitfähigkeit ein.
In integrierten Schaltkreisen wurde bis in die 2000er Jahre ausschließlich Aluminium als Leiterbahnmaterial eingesetzt. Bis in die 1980er Jahre wurde es als Material für die Steuerelektrode (Gate) von Feldeffekttransistoren mit Metall-Isolator-Halbleiter-Struktur (MOSFET beziehungsweise MOS-FET) verwendet.[86] Neben dem geringen spezifischen Widerstand sind für die Verwendung die gute Haftung auf und geringe Diffusion in Siliciumoxiden (Isolationsmaterial zwischen den Leiterbahnen) sowie die einfache Strukturierbarkeit mithilfe von Trockenätzen ausschlaggebend. Seit Anfang der 2000er Jahre wird Aluminium jedoch zunehmend durch Kupfer als Leiterbahnmaterial ersetzt, auch wenn dafür aufwendigere Strukturierungsverfahren (vgl. Damascene- und Dual-Damascene-Prozess) und Diffusionsbarrieren notwendig sind.[87] Der höheren Fertigungsaufwand wird durch den geringeren spezifischen Widerstand, der im Fall von kleinen Strukturen bei Aluminium viel früher signifikant ansteigt[88] und anderen Eigenschaften (z. B. Elektromigrationverhalten) überwogen und die Aluminium-Prozesse konnte die gestiegenen Anforderungen (Taktfrequenz, Verlustleistung) in mit hohen Frequenzen arbeitenden Schaltkreisen nicht mehr genügen.
Aluminium wird jedoch weiterhin in mikroelektronischen Produkten verwendet, so wird es wegen seiner guten Kontaktierbarkeit durch andere Metalle in den letzten Leiterbahnebenen eingesetzt, um den elektrischen Kontakt zu den bei der Flip-Chip-Montage eingesetzten Lotkügelchen herzustellen. Ähnlich verhält es sich bei Leistungshalbleitern, bei denen in der Regel alle Leiterbahnebenen aus Aluminium bestehen. Allgemein und insbesondere bei Leistungshalbleitern wird das Material für Bonddrähte (Verbindungsdrähte zwischen Chip und Gehäuseanschluss) verwendet.
Mit der Einführung der High-k+Metal-Gate-Technik hat Aluminium nach gut 25 Jahren Abstinenz auch im Bereich des Gates an Bedeutung gewonnen und wird neben anderen als Material zur Einstellung der Austrittsarbeit eingesetzt.
Verpackung und Behälter

In der Verpackungsindustrie wird Aluminium zu Getränke- und Konservendosen sowie zu Aluminiumfolie verarbeitet. Dabei macht man sich die Eigenschaft der absoluten Barrierewirkung gegenüber Sauerstoff, Licht und anderen Umwelteinflüssen zunutze. Ausschlaggebend für die Verwendung von Aluminium als Verpackung ist nicht die geringe Dichte, sondern die gute Verarbeitbarkeit durch Walzen und die Ungiftigkeit.[89] Dünne Folien werden in Stärken von sechs Mikrometern hergestellt und dann zumeist in Verbundsystemen eingesetzt, beispielsweise in Tetra Paks. Kunststofffolien können durch Bedampfen mit Aluminium mit einer dünnen Schicht versehen werden, welche dann eine hohe (aber nicht vollständige) Barrierefunktion aufweist. Grund dieser Barrierewirkung ist nicht das reine Aluminium, sondern die Passivschicht aus Böhmit. Wird diese verletzt, so kann Gas ungehindert durch den Werkstoff Aluminium strömen.[90][91] Genutzt werden meist Reinaluminium, AlMn (Legierungen mit Mangan) und AlMg (Legierungen mit Magnesium).[92]
Aus Aluminium werden Kochtöpfe und andere Küchengeräte, wie die klassische italienische Espressokanne, sowie Reise- und Militär-Geschirr hergestellt.
Aluminium wird für eine Vielzahl von Behältern und Gehäusen verarbeitet, da es sich gut durch Umformen bearbeiten lässt. Gegenstände aus Aluminium werden häufig durch eine Eloxalschicht vor Oxidation und Abrieb geschützt.
Druckgasflaschen aus Aluminium sind eher selten, denn Taucher brauchen Ballast und im Bereich Feuerwehr wurden Leichtstahlflaschen durch solche aus Faserverbund ersetzt, zunehmend ohne Alu-Liner.
2017 entfielen 17 % der europäischen Aluminiumverwendung auf Verpackungen.[93]
 Getränkedose
Getränkedose
Optik und Lichttechnik
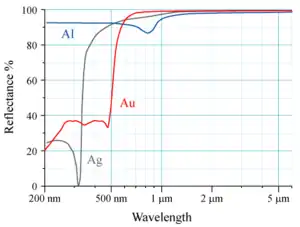
Aluminium wird aufgrund seines hohen Reflexionsgrades als Spiegelbeschichtung von Oberflächenspiegeln, unter anderem in Scannern, Kraftfahrzeug-Scheinwerfern und Spiegelreflexkameras aber auch in der Infrarotmesstechnik eingesetzt. Es reflektiert im Gegensatz zu Silber Ultraviolettstrahlung. Aluminium-Spiegelschichten werden meist durch eine Schutzschicht vor Korrosion und Kratzern geschützt.
Betonherstellung
Aluminiumpulver und Aluminiumpasten werden zur Herstellung von Porenbeton eingesetzt.[94] Man verwendet Verbindungen wie Aluminiumhydroxysulfat, Aluminiumdihydroxyformiat oder amorphes Aluminiumhydroxid als alkalifreie Spritzbetonbeschleuniger.[95]
Konstruktions- und Funktionswerkstoffe
Aluminium wird als Konstruktionswerkstoff für tragende Teile von Bauwerken und als Funktionswerkstoff als dekorative, korrosionsbeständige Teile verwendet. Neben der Witterungsbeständigkeit ist vor allem die gute Verarbeitbarkeit ausschlaggebend, insbesondere bei handwerklicher Fertigung. Das Baugewerbe ist der Hauptabnehmer für Aluminiumprofile. Genutzt wird Aluminium hauptsächlich für Fensterrahmen, Türen und Elemente von Fassaden. Besonders bekannt ist die Fassade des Imperial War Museums in Manchester. Genutzt werden vor allem die Aluminium-Mangan-Legierungen die geringe Festigkeit und gute Korrosionsbeständigkeit haben. Teilweise wird Aluminium für den Brückenbau angewandt, wo sonst der Stahlbau vorherrscht. Nicht selten erfolgt der Einsatz als Aluminiumheizkörper zur Gebäudebeheizung, da Aluminium ein geringes Gewicht hat und in Feucht-Räumen nicht rostet. Ein Nachteil ist, dass Heizungswasser laut VDI 2035[96] bereits einen pH-Wert von mindestens 8,2 haben soll. Der Einsatz von Aluminiumheizkörpern ist bei einer zusätzlichen Eigen-Alkalisierung[97] nicht unkritisch, pH-Werte über 8,5[98] führen zur Korrosion von Aluminium. Für den konstruktiven Ingenieurbau werden Legierungen mit höherer Festigkeit genutzt, darunter AlMg und AlSi.[99] Bleche und Verbundplatten aus Aluminiumlegierungen erreichen Brandschutzklassen von 'nicht brennbar' bis 'normal entflammbar'.[100] Ein Wohnungsbrand entwickelt im Vollbrand 1000 °C Hitze was ungeachtet der Brandschutzklasse Löcher in die Aluminiumlegierung brennt, die zwischen 600 °C und 660 °C nach unten fließt oder tropft.[10][101]
 Das Imperial War Museum von Außen
Das Imperial War Museum von Außen Dachkonstruktion aus Aluminium beim Imperial War Museum
Dachkonstruktion aus Aluminium beim Imperial War Museum Aluminiumblech, punktuell über 600 °C erhitzt.
Aluminiumblech, punktuell über 600 °C erhitzt.
Weitere Anwendungen
In der Raketentechnik besteht der Treibstoff von Feststoffraketen zu maximal 30 Prozent aus Aluminiumpulver, das bei seiner Verbrennung viel Energie freisetzt.[102] Aluminium wird in Feuerwerken (s. a. Pyrotechnik) verwendet, wo es je nach Körnung und Mischung für farbige Effekte sorgt. Auch in Knallsätzen findet es oft Verwendung.[103]
Bei der Aluminothermie wird Aluminium zur Gewinnung anderer Metalle und Halbmetalle verwendet, indem das Aluminium zur Reduktion der Oxide genutzt wird. Ein wichtiges Verfahren der Aluminothermie ist die Thermitreaktion, bei der Aluminium mit Eisen(III)-oxid umgesetzt wird. Bei dieser stark exothermen Reaktion entstehen Temperaturen bis zu 2500 °C und flüssiges Eisen, das zum aluminothermischen Schweißen genutzt wird, z. B. zum Fügen von Bahngleisen. Weitere Anwendungen der Reduktionswirkung von Aluminium werden für Laborzwecke ermöglicht, indem Aluminiumamalgam verwendet wird.
Aluminium dient als Pigment für Farben (Silber- oder Goldbronze). Farbig eloxiert ist es Bestandteil vieler Dekorationsmaterialien wie Flitter, Geschenkbänder und Lametta. Zur Beschichtung von Oberflächen wird es beim Aluminieren verwendet.
Mit Aluminium werden Heizelemente von Bügeleisen und Kaffeemaschinen umpresst.
Bevor es gelang, Zinkblech durch Titanzusatz als so genanntes Titanzink verarbeitbar zu machen, wurde Aluminiumblech für Fassaden- und Dachelemente (siehe Leichtdach) sowie Dachrinnen eingesetzt.
Wegen seiner hohen Wärmeleitfähigkeit wird Aluminium als Werkstoff für stranggepresste Kühlkörper und wärmeableitende Grundplatten verwendet. Aluminium-Elektrolytkondensatoren verbauen Aluminium als Elektrodenmaterial und Gehäusewerkstoff, weiters wird es zur Herstellung von Antennen und Hohlleitern verwendet.
Aluminium kommt in einigen Legierungen vor. Neben den Aluminiumlegierungen die überwiegend aus Aluminium bestehen, kommt es noch vor in den Kupferlegierungen Aluminiumbronze, Aluminiummessing, Isabellin, zu etwa gleichen Teilen Al und Kupfer in der Devardaschen Legierung, als Hauptlegierungselement für Magnesiumlegierungen sowie in Alnico und Sendust, zwei Eisenlegierungen mit besonderen magnetischen Eigenschaften. In vielen Titanlegierungen kommt ebenfalls Aluminium vor, insbesondere in Ti-6Al-4V, der Sorte die etwa 50 % aller Titanlegierungen ausmacht.[104] Dort ist Aluminium mit sechs Massenprozent enthalten.
Verarbeitung
Bei der Verarbeitung wird unterschieden, ob es sich um Gusslegierungen handelt oder um Knetlegierungen:
- Gusslegierungen werden in Gießereien verarbeitet und in Formen gegossen, die schon vollständig oder weitgehend der Form der Endprodukte entsprechen. Danach erfolgt eine Endbearbeitung durch Schleifen. Gusslegierungen werden häufig aus Schrott erschmolzen.
- Knetlegierungen werden in den Hüttenwerken zu Barren vergossen und anschließend dort gewalzt, um Platten, Bleche, Stangen und Folien herzustellen. Aus dicken Platten und anderen massiven Rohteilen werden durch Zerspanen (Fräsen, Bohren und Drehen) Einzelteile hergestellt. Andere massive Rohteile können durch Schmieden zu Einzelstücken verarbeitet werden oder durch Strangpressen zu Profilen. Letzteres kommt bei Aluminium besonders häufig vor. Bleche werden durch Stanzen, Biegen und Tiefziehen verarbeitet.
Danach werden die Einzelteile durch Schweißen, Nieten, Löten und ähnliche Verfahren verbunden.
Gießen


Das Gießen von Aluminium wird als Aluminiumguss bezeichnet. Es gehört aufgrund seines vergleichsweise geringen Schmelzpunktes von 660 °C (Gusseisen etwa 1150 °C, Stahl 1400 °C bis 1500 °C) und seiner guten Gießbarkeit zu den häufig in der Gießerei verwendeten Werkstoffen. AlSi, spezielle Gusslegierungen mit Silicium, haben sogar Schmelzpunkte um 577 °C.[105] Der Massenanteil von Aluminium aller in Gießereien erzeugten Produkte beträgt etwa 11 % (Gusseisen 76 %, Stahlguss 9 %) und ist damit in der Gießerei das mit Abstand wichtigste Nichteisenmetall (NE-Metalle) noch vor Kupfer mit 1,5 %.[106] Der Anteil am NE-Metallguss von Aluminium beträgt etwa 87 %. In Deutschland wurden 2011 etwa 840.000 Tonnen Aluminium in Gießereien verarbeitet; Etwa 76 % des Nichteisenmetall-Gusses wird von der Automobilbranche abgenommen.[107]
Aus dem niedrigen Schmelzpunkt folgt ein geringer Energieeinsatz beim Schmelzvorgang sowie eine geringere Temperaturbelastung der Formen.[108] Aluminium eignet sich grundsätzlich für alle Gussverfahren, insbesondere für Druckguss beziehungsweise Aluminiumdruckguss, mit denen kompliziert geformte Teile gefertigt werden können. In der Gießerei werden besondere Aluminiumgusslegierungen verarbeitet, größtenteils die Aluminium-Silicium-Legierungen. In den Hüttenwerken werden dagegen meist Knetlegierungen erzeugt, die zur Weiterbearbeitung durch Walzen, Schmieden und Fließpressen gedacht sind. Diese werden in den Hüttenwerken vergossen zu Barren (Blockguss) oder zu Rundbarren, die theoretisch endlos sein können (Strangguss). Seit den 1930er Jahren kommt der Strangguss vermehrt zum Einsatz. Dafür gibt es spezielle Anlagen die bis zu 96 Rundbarren gleichzeitig herstellen können mit Gießlängen zwischen 3 und 7 Metern teils bis zu 10 Metern. Die Durchmesser liegen bei 75 bis 700 mm. Bleche werden manchmal hergestellt durch Gießen direkt auf eine Walze, die die Schmelze kühlt. Das Rohblech wird danach direkt kaltgewalzt ohne Warmwalzen, was Kosten von bis zu 60 % spart.[109]
Umformende Verfahren
Etwa 74 Prozent des Aluminiums wird durch Umformen bearbeitet.[110] Hierzu zählt unter anderem das Walzen, Schmieden, Strangpressen und Biegen.
Rein- und Reinstaluminium lässt sich wegen der niedrigen Festigkeit gut umformen und verfestigt sich bei Kaltumformung, wobei große Formänderungen möglich sind. Die Verfestigung lässt sich durch Rekristallisationsglühen beseitigen. Knetlegierungen mit AlMg und AlMn erreichen ihre höhere Festigkeit durch die Legierungselemente und durch Kaltverformung. Die aushärtbaren Legierungen AlMgSi, AlZnMg, AlCuMg und AlZnMgCu scheiden bei Umformung festigkeitssteigernde Phasen aus; sie lassen sich relativ schwierig umformen.[111]
- Walzen
Gegossene Barren werden häufig durch Walzen weiterverarbeitet, entweder zu dicken Platten die anschließend durch Fräsen zu Endprodukten werden, zu Blechen die durch Stanzen und Biegen weiterverarbeitet werden oder zu Folien. Beim Walzen ändert sich die Mikrostruktur der Werkstoffe: Kleine kugelförmige Bestandteile die häufig nach dem Gießen vorliegen, werden plattgedrückt und in die Länge gezogen. Das Gefüge wird dadurch einerseits feiner und gleichmäßiger, andererseits aber auch Richtungsabhängig. Die Kapazität einer Aluminium-Warmwalzanlage liegt bei etwa 800.000 Tonnen pro Jahr. Verarbeitet werden Barren mit bis zu 30 Tonnen Masse. Sie haben Abmessungen von bis zu 8,7 Metern Länge, 2,2 Metern Breite und 60 cm Dicke. Noch größere Barren können technisch verarbeitet werden, die Gefügequalität nimmt dann aber ab. Nach dem Warmwalzen liegt der Werkstoff meist mit Dicken von etwa 20 bis 30 mm vor. Anschließend folgt das Kaltwalzen auf Enddicke. Kaltwalzwerke haben Kapazitäten von 300.000 bis 400.000 Jahrestonnen. Verbundwerkstoffe können durch Walzplattieren hergestellt werden. Dabei wird ein- oder zweiseitig eine Schicht aus einem anderen Werkstoff aufgebracht. Häufig wird auf korrosionsanfälliges Kernmaterial eine Schicht aus korrosionsbeständigem Reinaluminium aufgebracht.[112]
- Strangpressen

Aluminium lässt sich durch Strangpressen in komplizierte Konstruktionsprofile formen; hierin liegt ein großer Vorteil bei der Fertigung von Hohlprofilen (z. B. für Fensterrahmen, Stäbe, Balken), Kühlkörperprofilen oder in der Antennentechnik. Die Herstellung von Halbzeug oder Bauteilen geschieht aus Vormaterial wie Walzbarren, Blech oder Zylindern. Aluminiumlegierungen lassen sich deutlich besser strangpressen als andere Werkstoffe, weshalb ein großer Teil des Aluminiums mit diesem Verfahren verarbeitet wird. Dabei wird das Ausgangsmaterial durch ein hohles Werkzeug gepresst. Es entsteht Endlosmaterial das in der gewünschten Länge abgesägt wird. Es können auch komplizierte Querschnitte hergestellt werden, beispielsweise Hohlprofile oder welche mit Hinterschneidungen. Der Querschnitt ist allerdings über die Länge konstant. Mit hochfesten Legierungen sind große Mindestwanddicken erforderlich und das Pressen dauert lange, weshalb eher die mittelfesten, aushärtbaren Legierungen bevorzugt werden. Die Aushärtung wird meist direkt im Anschluss durchgeführt. Beim Strangpressen wird der Werkstoff auf Temperaturen von etwa 450 bis 500 °C erwärmt um die Umformbarkeit zu erhöhen, was gleichzeitig zum Lösungsglühen genutzt wird. Direkt nach dem Strangpressen wird das Werkstück durch Luft oder Wasser stark abgekühlt und so abgeschreckt, was zu höheren Festigkeiten führt.[113]
- Sonstige
Ein Mischverfahren aus Gießen und Schmieden ist Cobapress, welches speziell für Aluminium ausgelegt ist und häufig in der Automobilbranche genutzt wird. Moderne Walzwerke sind sehr teuer, aber auch produktiv.
Spanende Verfahren

Zum Zerspanen zählt das Drehen, Bohren und Fräsen. Aluminiumwerkstoffe sind gut spanbar.[114] Ihre genauen Eigenschaften hängen jedoch von der Legierung und Gefügezustand ab. Zu beachten ist, dass die bei der Bearbeitung auftretenden Temperaturen schnell im Bereich des Schmelzpunktes liegen können. Bei gleichen Schnittparametern wie bei Stahl resultiert bei Aluminium allerdings eine geringere mechanische und thermische Belastung. Als Schneidstoff wird oft Hartmetall für untereutektische oder Diamant für die stark verschleißenden übereutektischen Legierungen verwendet.[115] Insbesondere die Bearbeitung von eloxierten Werkstücken erfordert harte Werkzeuge, um Verschleiß durch die harte Eloxalschicht zu vermeiden. Die beim Schleifen von Aluminium entstehenden Schleifstäube können zu einem erhöhten Explosionsrisiko führen.[116]
Schweißen und Löten
Grundsätzlich sind alle Aluminium-Werkstoffe zum Schweißen geeignet, wobei jedoch reines Aluminium zu Poren in der Schweißnaht neigt.[117] Außerdem neigt die Aluminiumschmelze zu Reaktionen mit der Atmosphäre, weshalb fast immer unter Schutzgas geschweißt wird. Gut geeignet sind das MIG- und Plasmaschweißen sowie das WIG-Schweißen. Bei Letzterem wird bei Nutzung von Wechselstrom das Edelgas Argon als Schutzgas verwendet, und bei Gleichstrom Helium.
Für das Laserschweißen eignen sich sowohl Kohlendioxid- als auch Festkörperlaser, allerdings nicht für alle Legierungen. Wegen der hohen Wärmeleitfähigkeit erstarrt die Schmelze sehr schnell, sodass die Schweißnaht zu Poren und Rissen neigt. Das Widerstandspunktschweißen erfordert, verglichen mit Stahl, höhere elektrische Ströme und kürzere Schweißzeiten sowie teilweise spezielle Geräte, da die handelsüblichen Schweißgeräte für Stahl nicht dafür geeignet sind. Für das Elektronenstrahlschweißen eignen sich alle Legierungen, jedoch neigen Magnesium und Zinn zum Verdampfen während des Schweißvorgangs.[118] Lichtbogenhandschweißen wird nur noch selten verwendet, meist zur Gussnachbesserung. Löten gestaltet sich wegen der sich bildenden Oxidschicht an Luft schwierig. Genutzt werden sowohl Hart- als auch Weichlöten mit speziellen Flussmitteln. Alternativ kann Aluminium ohne Flussmittel mit Ultraschall gelötet werden, dabei wird die Oxidschicht mechanisch während des Lötvorganges aufgebrochen.
Aluminium in Natur und Organismen
Aluminium im menschlichen Körper
Aluminium ist kein essentielles Spurenelement und gilt für die menschliche Ernährung als entbehrlich.[119] Im menschlichen Körper befinden sich durchschnittlich etwa 50 bis 150 Milligramm Aluminium.[120] Diese verteilen sich zu ungefähr 50 Prozent auf das Lungengewebe, zu 25 Prozent auf die Weichteile und zu weiteren 25 Prozent auf die Knochen. Aluminium ist damit ein natürlicher Bestandteil des menschlichen Körpers.
99 bis 99,9 Prozent der üblicherweise in Lebensmitteln aufgenommenen Menge von Aluminium (10 bis 40 mg pro Tag) werden unresorbiert über den Kot wieder ausgeschieden. Chelatbildner (Komplexbildner) wie Citronensäure können die Resorption auf 2 bis 3 Prozent steigern. Die Aufnahme von Aluminiumsalzen über den Magen-Darm-Trakt ist gering; sie variiert aber in Abhängigkeit von der chemischen Verbindung und ihrer Löslichkeit, dem pH-Wert und der Anwesenheit von Komplexbildnern. Man schätzt, dass 1 ‰ beziehungsweise 3 ‰ des in der Nahrung beziehungsweise im Trinkwasser erhaltenen Aluminiums im Magen-Darm-Trakt absorbiert werden.[121]
Von dort gelangt es in zahlreiche Gewebe und ins Blut. Im Blut ist Al3+ überwiegend (zu etwa 80 %) an Transferrin gebunden. 16 Prozent liegen als [Al(PO4)(OH)]−, 1,9 Prozent als Citrat-Komplex, 0,8 Prozent als Al(OH)3 und 0,6 Prozent als [Al(OH)4]− vor.[122] Das Blut Neugeborener enthält bereits Aluminiumionen, die aus dem maternalen Kreislauf stammen.[123] Die Serumkonzentrationen von etwa 6–10 μg/l entspricht in etwa der von Erwachsenen. Durch das Blut gelangen wasserlösliche Aluminiumsalze auch in das Gehirn: Die Passage an der Blut-Hirn-Schranke geschieht durch Endozytose mittels Transferrin-Rezeptor und durch aktiven, ATP-abhängigen Transport des Citrates.[124] Dies wurde tierexperimentell mittels radioaktiv markierten Aluminiums des Isotops 26Al, das in der Natur nicht vorkommt, nachgewiesen.
Die Eliminierung von in den Organismus gelangten wasserlöslichen Aluminiumsalzen erfolgt innerhalb weniger Tage vorwiegend durch die Nieren über den Urin, weniger über den Kot. Die Halbwertszeit im Blut beträgt hierbei 8 Stunden.[124] Bei Dialysepatienten mit einer eingeschränkten Nierenfunktion besteht daher ein erhöhtes Risiko einer Akkumulation im Körper (Gehirn, Knochen)[124] mit toxischen Effekten, etwa Knochenerweichungen und Schäden des Zentralnervensystems; zusätzlich sind Dialysepatienten aufgrund für sie notwendiger pharmazeutischer Produkte (Phosphatbinder) einer höheren Aluminiumzufuhr ausgesetzt.[120] Aluminium, das nicht über die Nieren ausgeschieden wird, gelangt in die Knochen.[121] Dort wird es vergleichsweise sehr langsam eliminiert (Halbwertszeit mehrere Jahre)[124], so dass man durch Modellschätzungen annimmt, dass etwa 1–2 % der resorbierten Dosis sich im Körper anhäufen.[123] In einem Leben häufen sich etwa 35 bis 50 mg Aluminium im Körper an.[123][124]
Pflanzen
Aluminium in Form verschiedener Salze (Phosphate, Silikate) ist Bestandteil vieler Pflanzen und Früchte, denn gelöste Al-Verbindungen werden durch Regen aus den Böden von den Pflanzen aufgenommen, bei Säurebelastung der Böden infolge sauren Regens[125] ist dies vermehrt der Fall (siehe dazu Waldschäden).
Ein großer Teil des Bodens auf der Welt ist chemisch sauer. Liegt der pH-Wert unter 5,0, werden Al3+-Ionen von den Wurzeln der Pflanzen aufgenommen. Dies ist bei der Hälfte des bebaubaren Lands auf der Welt der Fall. Die Ionen schädigen insbesondere das Wurzelwachstum der Feinwurzeln. Wenn die Pflanze nicht Aluminium-tolerant ist, steht sie dann unter Stress. Zahlreiche Enzyme und signalübertragende Proteine sind betroffen; die Folgen der Vergiftung sind noch nicht vollständig bekannt. In sauren metallhaltigen Böden ist Al3+ das Ion mit dem größten Potenzial zur Schädigung. Von der Modellpflanze Arabidopsis sind Transgene bekannt, die deren Aluminium-Toleranz heraufsetzen und auch bei Kulturpflanzen sind tolerante Sorten bekannt.[126][127][128][129]
Der saure Regen hat beispielsweise in Schweden in den 1960er Jahren die Seen übersäuert, wodurch mehr Al3+-Ionen in Lösung gingen und empfindliche Fische verendeten.[122] In Norwegen wurde dieser Zusammenhang bei einem Forschungsprojekt in den 1970er Jahren festgestellt.[130]
Bei pH-Werten über 5,0 ist Aluminium als polymeres Hydroxykation an der Oberfläche von Silicaten gebunden. Bei pH-Werten von 4,2 bis 5 steigt Anteil von mobilen Kationen.
Bei Erhöhung der Schwefelsäurekonzentration durch sauren Regen bildet sich Aluminiumhydroxysulfat:[122]
In Lebensmitteln
| Lebensmittel | Gehalt[131][132] in mg/kg |
|---|---|
| Tee (Trockenerzeugnisse) | 385 |
| Thymianblätter | 212 |
| Kakao und Schokolade | 100 |
| Salatarten | 28,5 |
| Hülsenfrüchte | 22,5 |
| Getreide | 13,7 |
| Pilzkonserven | 9,3 |
| Kohlarten | 9,0 |
| Wurstwaren | 7,8 |
| Gemüsekonserven | 7,6 |
| Obstkonserven | 3,6 |
| Fische und Fischerzeugnisse | 3,3 |
| Obst | 3,1 |
| Kindernahrung | 3,0 |
| Käse | 2,9 |
| Frischpilze | 2,7 |
| Paprika, Gurken, Tomaten, Melonen | 2,2 |
| Kartoffeln | 2,1 |
| Fleisch | 1,2 |
Die meisten Lebensmittel enthalten Aluminium in Spurenmengen. Unverarbeitete pflanzliche Lebensmittel enthalten durchschnittlich weniger als 5 mg/kg in der Frischmasse. Dabei streuen die Werte aufgrund unterschiedlicher Sorten, Anbaubedingungen und Herkunft in erheblichem Maße.[133] So weisen beispielsweise Salat und Kakao deutlich höhere Durchschnittswerte auf. Zwischen 5 und 10 mg/kg finden sich in Brot, Kuchen, Backwaren, einer Vielzahl von mehlhaltigen Speisen, einigen Gemüsearten oder Würsten.[132] Schwarzer Tee kann Gehalte von bis zu 1042 mg/kg in der Trockenmasse aufweisen.[134] Jedoch ist dort das Aluminium an schlecht absorbierbaren Polyphenolen gebunden, so dass eine Aufnahme im Magen-Darm-Trakt erschwert wird.[132] Einen hohen Aluminiumgehalt weisen Kräuter und Gewürze auf, beispielsweise Thymianblätter. Im europäischen Vergleich zeigen sich Schwankungen, was vermutlich auf eine unterschiedlich hohe Aluminiumgrundbelastung und Verwendung von aluminiumhaltigen Zusatzstoffen zurückzuführen ist.[132]
Beim Kochen oder Aufbewahren in Aluminiumgeschirr oder in Alufolie kann es (außer bei sauren Lebensmitteln) nach einer Schätzung zu einer maximalen zusätzlichen Aufnahme von 3,5 mg/Tag/Person kommen. Bei sauren Lebensmitteln wie Sauerkraut oder Tomaten können aufgrund der Säurelöslichkeit wesentlich höhere Werte erreicht werden.[135] Das Bundesinstitut für Risikobewertung (BfR) rät von der Zubereitung und Lagerung von insbesondere sauren und salzigen Lebensmitteln in unbeschichteten Aluminiumgefäßen oder Alufolie ab.[136] Hohe Belastungen fallen beispielsweise dann an, wenn Fisch oder Fleischgerichten mit Zitrone oder anderen sauren Zutaten in Aluminiumschalen oder -folien angerichtet und über längere Zeit hoch erhitzt werden.[137]
Trink- und Mineralwässer weisen mit durchschnittlich 0,2–0,4 mg/l im Gegensatz zur Nahrung geringe Gehalte auf und leisten somit einen kleinen Beitrag zur täglichen Aluminium-Aufnahme.[133][135] Ein Liter Trinkwasser darf in Deutschland[138], Österreich und der Schweiz nicht mehr als 0,2 mg Aluminium enthalten.
Nach einer Schätzung nimmt der erwachsene Europäer im Durchschnitt zwischen 1,6 und 13 mg Aluminium pro Tag über die Nahrung auf.[121] Dies entspricht einer wöchentlichen Aufnahme von 0,2 bis 1,5 mg Aluminium pro kg Körpergewicht bei einem 60 kg schweren Erwachsenen.[132] Die großen Unsicherheiten beruhen auf den unterschiedlichen Ernährungsgewohnheiten und der variablen Gehalte an Aluminium in den Lebensmitteln,[133] auch innerhalb eines Landes aufgrund verschiedener Erhebungen.[121] Falls Säuglinge mit Fertignahrung ernährt werden, kann die Aluminiumkonzentration im Blut bei 15 μg/l liegen.[123] Eine mögliche gesundheitliche Schädigung ist nicht bekannt.
Die Europäische Behörde für Lebensmittelsicherheit (Efsa) nennt eine tolerierbare wöchentliche Aufnahme (TWI) von 1 mg Aluminium pro kg Körpergewicht[133][132]. Vor 2008 nannte sie eine TWI von 7 mg Al je kg KW. Wegen der möglichen Akkumulation im Körper zieht die Efsa als Maß den TWI der tolerierbaren täglichen Aufnahme (TDI) vor.
Aluminium ist als Lebensmittelzusatzstoff unter der Bezeichnung E 173[139] ausschließlich als Farbmittel für Überzüge von Zuckerwaren und als Dekoration von Kuchen und Keksen erlaubt. Weiterhin ist Aluminium zum Färben von Arzneimitteln und Kosmetika zugelassen.[140] Bei der Untersuchung von Laugengebäck (Brezeln, Stangen, Brötchen) aus Bäckereien wurde Aluminium nachgewiesen, das in das Lebensmittel gelangt, wenn bei der Herstellung von Laugengebäck Aluminiumbleche verwendet werden.[141]
Während Bier in Aluminiumfässern transportiert wird, hat sich für den Weintransport der Werkstoff Aluminium nicht durchgesetzt. Ein kurzfristiger Kontakt schadet nicht, doch können nach längerem Kontakt Weinfehler in Geruch und Geschmack oder als Trübung auftreten, vor allem beim offenen Stehen an der Luft.[142]
Toxizität
Aluminium gehört nicht zu den essentiellen Spurenelementen, bei der Toxizität kommt es im Wesentlichen auf die Menge an: 10 µg/l Aluminium im Blut gilt als Normalwert, Werte über 60 µg/l sprechen für übermäßige Belastung und Werte über 200 µg/l im Blut gelten als toxisch.[143] Tierexperimentelle Studien mittels 26Al zeigen, dass sich die Serumkonzentration von Aluminium durch eine adjuvierte Impfung nur um wenige Promille erhöht (von etwa 5,00 µg/l auf 5,04 µg/l).[144]
Bei eingeschränkter Nierenfunktion und bei Dialyse-Patienten führt die Aufnahme von Aluminium zu progressiver Enzephalopathie (Gedächtnis- und Sprachstörungen, Antriebslosigkeit und Aggressivität) durch Untergang von Hirnzellen und zu fortschreitender Demenz, zu Osteoporose (Arthritis) mit Knochenbrüchen und zu Anämie[145] (weil Aluminium dieselben Speichereiweiße wie Eisen besetzt). Dies wurde in den 1970er Jahren bei langjährigen Hämodialysepatienten durch starke Aluminiumzufuhr beobachtet („Dialysis Encephalopathy Syndrome“).[123]
Speziell im Hinblick auf die Verwendung in Deodorants bzw. Antitranspirantien und Lebensmittel-Zusatzstoffen werden die gesundheitlichen Auswirkungen von Aluminium untersucht.
Alzheimer-Krankheit
Aluminium wurde kontrovers als Faktor im Zusammenhang mit der Alzheimer-Krankheit in Verbindung gebracht.[146][147] So wurde in der PAQUID-Kohortenstudie in Frankreich mit einer Gesundheitsdatenauswertung von zuletzt 834 Personen im Alter ab 65 Jahren seit 1988 bis 2004 eine Aluminium-Exposition durch das Trinkwasser als Risikofaktor für die Alzheimer-Krankheit identifiziert.[148] Demnach wurden viele senile Plaques mit erhöhten Aluminium-Werten in Gehirnen von Alzheimer-Patienten gefunden. Es ist jedoch unklar, ob die Aluminium-Akkumulation eine Folge der Alzheimer-Krankheit ist, oder ob Aluminium in ursächlichem Zusammenhang mit der Alzheimer-Krankheit zu sehen ist.[149] So wäre es auch möglich, dass sich Aluminium erst nach der Entstehung von Alzheimer in den erkrankten Gehirnregionen ansammelt.[150]
Dagegen vertritt die britische Alzheimer-Gesellschaft mit Sitz in London den Standpunkt, dass die bis 2008 erstellten Studien einen kausalen Zusammenhang zwischen Aluminium und der Alzheimer-Krankheit nicht überzeugend nachgewiesen haben.[151] Die Deutsche Alzheimer Gesellschaft sieht ebenfalls keinen überzeugenden Zusammenhang zwischen Aluminium-Aufnahme und Alzheimer-Krankheit (Stand 2013). Sie stellt fest, dass es keine Klärung der Frage existiert, ob Aluminium als ein Auslöser der Alzheimer-Krankheit zu sehen ist. Abschließend wird geraten, dass sich Dialysepatienten vergewissern sollten, dass nur aluminiumfreie Flüssigkeiten zur Blutreinigung eingesetzt werden und dass aluminiumhaltige, magensäurebindende Arzneimittel nur nach ärztlicher Anordnung eingenommen werden sollten.[152]
Laut einer Studie des Bundesinstituts für Risikobewertung (BfR) vom Juli 2007 wurde im allgemeinen Fall zum Zeitpunkt der Erstellung der Studie aufgrund der vergleichsweise geringen Menge kein Alzheimer-Risiko durch Aluminium aus Bedarfsgegenständen erkannt; jedoch sollten vorsorglich keine sauren Speisen in Kontakt mit Aluminiumtöpfen oder -folie aufbewahrt werden.[135] Das BfR hat im Jahr 2020 seine Einschätzung aktualisiert und sieht weiterhin keine kausale Verbindung zwischen Aluminium und der Alzheimer-Demenz.[150] Bei der Risikobewertung von Aluminium ist es jedoch grundsätzlich wichtig, die Gesamtaufnahme über die verschiedenen Eintragspfade wie Lebensmittel oder aluminiumhaltige Produkte für den Lebensmittelkontakt zu betrachten.[153][154]
Mittlerweile sieht man bei Aluminium keine oder nur eine zu vernachlässigende Rolle bei der Entstehung der Alzheimer-Krankheit.[150]
Brustkrebs
Ebenfalls kontrovers wurde die Rolle Aluminum-haltiger Deodorants bzw. Antitranspirantien auf Basis von Aluminiumchlorohydrat bei der Entstehung von Brustkrebs diskutiert.[155][150], dieser Verdacht wurde aber nicht bestätigt.[156][157][158][159][147] Wie viel Aluminiumsalz tatsächlich in den Körper gelangen kann, hängt von mehreren Faktoren wie den Aluminiumsalzgehalt in Deos (Menge variiert von 0,2 bis 5,8 Prozent) oder die Häufigkeit der Verwendung ab.[150] Der Wissenschaftliche Ausschuss Verbrauchersicherheit der Europäischen Kommission schloss 2020 aufgrund neuer Daten, dass die Verwendung von nicht-sprüh-Deodorants und nicht-sprüh Transpirantien bis zu 6,25 % Aluminiumanteil sowie sprüh-Deodorants und sprüh Transpirentien bis zu 10,60 % sicher sind.[160] Das BfR teilte diese Einschätzung, basierend auf drei Studien aus 2016 und 2019: Gesundheitliche Beeinträchtigungen durch den regelmäßigen Gebrauch von Aluminiumchlorohydrat-haltigen Antitranspirantien sind nach gegenwärtigem wissenschaftlichen Kenntnisstand unwahrscheinlich.[153]
Aspekte der Ökobilanz

Abbau
Durch den Abbau des Erzes Bauxit werden große Flächen in Anspruch genommen, die erst nach einer Rekultivierung wieder nutzbar werden. Um eine Tonne Aluminium herzustellen, werden vier Tonnen Bauxit benötigt. Dies erzeugt zehn Tonnen Abraum.[161] Zudem entstehen bei der Herstellung des Aluminiumoxids nach dem Bayer-Verfahren ca. drei Tonnen von eisenreichem alkalischen Rotschlamm,[162] der kaum wiederverwertet wird und dessen Deponierung oder sonstige „Entsorgung“ große Umweltprobleme aufwirft (siehe entsprechende Abschnitte unter Rotschlamm und Bauxitbergbau in Australien).
Herstellung
Die Herstellung von Aluminium ist sehr energieaufwendig. Allein für die Schmelzflusselektrolyse zur Gewinnung eines Kilogramms Aluminium werden je nach Errichtungsdatum und Modernität der Anlage zwischen 12,9 und 17,7 kWh elektrische Energie benötigt.[41] Es ist daher ein Bestreben der Hersteller, möglichst preiswert an elektrische Energie zu kommen.
Mit der zunehmenden Kritik an der Atomenergie wurde auch Kritik am damit erzeugten Aluminium lauter. So z. B. in Frankreich, wo der Strom aus dem nationalen Energiepool und damit überwiegend aus Atomkraftwerken stammt. Ähnliches gilt für das Betreiben mit fossiler Energie, z. B. besonders in Australien, wo 90 % des Stroms aus Kohle und Gas gewonnen werden. Das hat zur Folge, dass die Verwendung von "Kohle- oder Atomstrom" zu Gunsten von ökologisch wertvollerer Elektrizität aus Wasserkraft teilweise zurückgedrängt wird.
Bei der Stromerzeugung für die Produktion von einem Kilogramm Aluminium werden im deutschen Kraftwerkspark 8,4 kg CO2 freigesetzt, im weltweiten Durchschnitt etwa 10 kg.
Wenn auf CO2-emissionsarme Wasserkraft zurückgegriffen werden kann, ist die Bilanz wesentlich günstiger. Hierzu zählen Länder wie Brasilien, Kanada, Venezuela oder Island.[163] Auf Island besteht zudem die Möglichkeit, neben der Wasserkraft auch auf Erdwärme als Energiequelle zuzugreifen. Allerdings ist auch bei Verwendung von Elektrizität aus vollständig regenerativen Energien die Produktion von Aluminium nicht CO2-frei, da der bei der Schmelzflusselektrolyse entstehende Sauerstoff mit dem Kohlenstoff der Elektroden zu CO2 reagiert. Die Verbrauchswerte für Roh-Aluminium erhöhen sich durch Transport- und Verarbeitungsanteile für das Wiederaufschmelzen, Gießen, Schleifen, Bohren sowie Polieren auf 16,5 kg CO2 pro kg Aluminium-Konsumgut.[164]
Recycling
Die europaweite Recyclingrate von Aluminium liegt bei 67 Prozent. In Österreich gelangen (laut einer Studie aus dem Jahr 2000)[165] 16.000 Tonnen Aluminium pro Jahr über Verpackungen in den Konsum, ebenso gelangen 16.000 Tonnen Aluminium ohne Wiederverwertung in den Hausmüll (dabei sind auch die Aluminiumhaushaltsfolien eingerechnet, die nicht als „Verpackung“ gelten). 66 Prozent der Verpackungen im Restmüll sind Aluminium[getränke]dosen. Diese liegen nach der Müllverbrennung in der Asche noch metallisch vor und machen in Europa durchschnittlich 2,3 Prozent der Asche aus.[166] In der EU werden durchschnittlich 70 Prozent des in der Bodenasche enthaltenen Aluminiums zurückgewonnen.[167]
Positiv ist hingegen die gute Wiederverwendbarkeit von Aluminium hervorzuheben, wobei die Reststoffe streng getrennt erfasst und gereinigt werden müssen (Aluminiumrecycling, Recycling-Code-41 (ALU)). Aluminium ist dabei besser rezyklierbar als Kunststoffe, wegen Downcycling bei nicht sortenreiner Erfassung jedoch etwas schlechter wiederverwertbar als Stahl. Beim Aluminiumrecycling wird nur 5 Prozent der Energiemenge der Primärproduktion benötigt.[168]
Energieeinsparung gegenüber anderen Werkstoffen
Durch Leichtbau mit Aluminiumwerkstoffen (beispielsweise Aluminiumschaum, Strangpressprofile) wird Masse von beweglichen Teilen und Fahrzeugen gespart, was zur Einsparung von Treibstoff führen kann.
Aluminium ist durch seine Selbstpassivierung korrosionsbeständiger als Eisen und erfordert daher weniger Korrosionsschutzmaßnahmen.
Nachweis
Aluminiumsalze weist man durch Glühen mit verdünnter Kobaltnitratlösung (Co(NO3)2) auf der Magnesia-Rinne nach. Dabei entsteht das Pigment Thénards Blau, ein Cobaltaluminiumspinell mit der Formel CoAl2O4. Es wird auch Kobaltblau oder Cobaltblau, Dumonts Blau, Coelestinblau, Cobaltaluminat oder – nach dem Entdecker des Pigments, Josef Leithner – Leithners Blau genannt.
Nachweis mittels Kryolithprobe
Die Probelösung wird alkalisch gemacht, um Aluminium als Aluminiumhydroxid Al(OH)3 zu fällen. Der Niederschlag wird abfiltriert und mit einigen Tropfen Phenolphthalein versetzt, dann gewaschen, bis keine Rotfärbung durch Phenolphthalein mehr vorhanden ist. Wenn anschließend festes Natriumfluorid (NaF) auf den Niederschlag gestreut wird, verursachen Hydroxidionen, die bei der Bildung von Kryolith Na3[AlF6] freigesetzt werden, eine erneute Rotfärbung des Phenolphthaleins.
Nachweis als fluoreszierender Morinfarblack
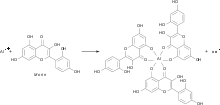
Die Probe wird mit Salzsäure (HCl) versetzt und eventuell vorhandenes Aluminium somit gelöst. Anschließend wird die Probelösung mit Kaliumhydroxid (KOH) stark alkalisch gemacht. Gibt man nun einige Tropfen der Probelösung zusammen mit der gleichen Menge Morin-Lösung auf eine Tüpfelplatte und säuert anschließend mit konzentrierter Essigsäure (Eisessig, CH3COOH) an, so ist unter UV-Strahlung (λ = 366 nm) eine grüne Fluoreszenz beobachtbar. Der Nachweis ist dann sicher, wenn diese Fluoreszenz bei Zugabe von Salzsäure wieder verschwindet.[169]
Grund hierfür ist, dass Al(III) in neutralen sowie essigsauren Lösungen in Verbindung mit Morin eine fluoreszierende kolloidale Suspension bildet.
Verbindungen


- Aluminiumoxid Al2O3 (englisch alumina), auch als Tonerde oder Korund bekannt, liegt als weißes Pulver oder in Form sehr harter Kristalle vor. Es ist das Endprodukt des Bayer-Verfahrens und dient in erster Linie als Ausgangsmaterial für die Aluminiumgewinnung (Schmelzflusselektrolyse). Es wird darüber hinaus als Schleif- oder Poliermittel und für Uhrensteine, Ziehsteine und Düsen verwendet. In keramischer Form dient es als Isolierstoff, Konstruktionskeramik, als Substratmaterial für Dickschichtschaltkreise, als Grundplatte von Leistungshalbleitern und in transparenter Form als Entladungsgefäß von Natriumdampf-Hochdrucklampen.
- Aluminiumhydroxid Al(OH)3 wird ebenfalls nach dem Bayer-Verfahren gewonnen und ist das wichtigste Ausgangsmaterial zur Erzeugung anderer Al-Verbindungen, vor allem für Aluminate. Als reines Produkt wird es als Füllstoff und zum Brandschutz in Kunststoffen und Beschichtungen eingesetzt.
- Aluminiumchlorid, Polyaluminiumchlorid und Aluminiumsulfat werden vor allem als Flockungsmittel in der Wasseraufbereitung, Abwasserreinigung und der Papierindustrie eingesetzt.
- Natriumaluminat NaAl(OH)4 wird ebenfalls als Flockungsmittel verwendet und ist weiterhin Rohstoff für die Zeolith-Produktion, Titandioxid-Beschichtung und Calciumaluminatsulfat-Herstellung.
- Zeolithe (Alumosilikate) als Ionenaustauscher, in Lebensmitteln und in Waschmitteln zur Wasserenthärtung.
- Alaune (Kaliumaluminiumsulfat, KAl(SO4)2·12H2O). Wegen seiner adstringierenden Wirkung als Rasierstift eingesetzt zum Stillen von kleinen Blutungen.
- Aluminiumdiacetat, bekannt als essigsaure Tonerde für entzündungshemmende Umschläge.
- Aluminiumorganische Verbindungen wie Triethylaluminium werden im großtechnischen Maßstab als Katalysatoren in der Polyethylen-Herstellung eingesetzt. Ein weiteres Anwendungsgebiet ist die Halbleitertechnik. Hier werden flüchtige Aluminiumalkyle (Trimethylaluminium, Triethylaluminium) als Vorstufen zur CVD (chemical vapor deposition) von Aluminiumoxid verwendet, das man als Isolator und Ersatz für das nicht ausreichend isolierende Siliciumdioxid einsetzt.
- Aluminiumoxynitrid ist ein transparenter keramischer Werkstoff.
- Aluminiumnitrid ist ein Konstruktions- und Isolationswerkstoff und zeichnet sich durch sehr hohe Wärmeleitfähigkeit bei Raumtemperatur aus. Außerdem könnte die hohe Bandlücke die Anwendung als Wide-Bandgap-Halbleiter ermöglichen.
- Lithiumaluminiumhydrid (LiAlH4) ist ein starkes Reduktionsmittel, welches weitverbreitet bei der Synthese organischer Verbindungen ist.
- Phosphate: Aluminiumphosphate sind Aluminiumsalze der Phosphorsäure. Aufgrund der Eigenschaft der Phosphorsäure beziehungsweise des Phosphat-Anions (PO43−), unter bestimmten Bedingungen Wasser abzuspalten und infolgedessen zu polymerisieren, sind verschiedene Aluminiumphosphate bekannt:
- Aluminiumorthophosphat (AlPO4)
- Aluminiummetaphosphat (Al(PO3)3)
- Monoaluminiumphosphat (Al(H2PO4)3)
- Aluminiumpolyphosphat
- In der Natur treten Aluminiumphosphate meist in Form von Doppelsalzen auf. Beispiele hierfür sind etwa der Wavellit (Al3(PO4)2(F, OH)3 · 5H2O) oder der Türkis, ein Mischphosphat aus Kupfer und Aluminium/Eisen: Cu(Al,Fe)6(PO4)4(OH)8 · 4 H2O. Unter besonderen Bedingungen tritt Aluminium einwertig auf. Diese Verbindungen werden zur Gewinnung von hochreinem Aluminium genutzt (Subhalogeniddestillation).
Siehe auch
Literatur
Zur Geschichte
- Hans Joliet (Hrsg.): Aluminium – Die ersten hundert Jahre. VDI Verlag, 1988, ISBN 3-18-400802-9.
Deutsche Fachliteratur
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, ISBN 978-3-662-43806-0.
- Aluminium-Taschenbuch. Aluminium-Verlag, Düsseldorf:
- Band 1: Grundlagen und Werkstoffe, 16. Auflage, 2002.
- Band 2: Umformen von Aluminium-Werkstoffen, Gießen von Aluminium-Teilen, Oberflächenbehandlung von Aluminium, Recycling und Ökologie, 15. Auflage 1999, 672 S.
- Band 3: Weiterverarbeitung und Anwendung, 16. Auflage, 2003, 863 S.
- Luitgard Marschall: Aluminium. Metall der Moderne. Oekom, München 2008, ISBN 978-3-86581-090-8.
Englische Fachliteratur
- George E. Totten, D. Scott MacKenzie: Handbook of Aluminum. Marcel Dekker, Yew York, Basel:
- Band 1: Physical Metallurgy and Processes. 2003, 1296 Seiten
- Band 2: Alloy Production and Materials Manufacturing. 2003, 724 Seiten
- Joseph R. Davis (Hrsg.): Aluminum and Aluminum Alloys. 4. Auflage, 1998, 784 Seiten
- Calvin C. Willhite et al.: Systematic review of potential health risks posed by pharmaceutical, occupational and consumer exposures to metallic and nanoscale aluminum, aluminum oxides, aluminum hydroxide and its soluble salts. In: Critical reviews in toxicology. Band 44, Suppl 4, Oktober 2014, S. 1–80, doi:10.3109/10408444.2014.934439, PMID 25233067, PMC 4997813 (freier Volltext).
Weblinks
- Bundesinstitut für Risikobewertung (BfR), 20. Juli 2020: Fragen und Antworten zu Aluminium in Lebensmitteln und verbrauchernahen Produkten (als pdf)
- MATERIAL ARCHIV: Aluminium – Umfangreiche Materialinformationen und Bilder.
- Aluminium Deutschland e. V.: Internetauftritt des Verbands der deutschen Aluminiumindustrie
- Andrea Wille, Sigrid März: So schädlich ist Aluminium wirklich. In: quarks.de. 3. September 2020, abgerufen am 11. November 2021.
- Bayerischer Rundfunk (Hrsg.): Aluminium: Gefährlich für die Gesundheit? 16. Januar 2019 (br.de [abgerufen am 31. Mai 2019]).
- Lars Fischer: Wie gefährlich ist Aluminium? Spektrum.de, 14. Juli 2014.
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Aluminium) entnommen.
- IUPAC Commission on Isotopic Abundances and Atomic Weights: Standard Atomic Weights of 14 Chemical Elements Revised. In: Chemistry International. 40, 2018, S. 23, doi:10.1515/ci-2018-0409.
- Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: The Journal of Physical Chemistry A. 113, 2009, S. 5806–5812, doi:10.1021/jp8111556.
- Eintrag zu aluminum in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu aluminium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Aluminium) entnommen.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 74.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. (Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 868.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- W. B. Frank, W. E. Haupin, H. Vogt, M. Bruno, J. Thonstad, R. K. Dawless, H. Kvande, O. A. Taiwo: Aluminium. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2009, doi:10.1002/14356007.a01_459.pub2.
- Joseph L. Rose: Ultrasonic Waves in Solid Media. Cambridge University Press, 2004, ISBN 978-0-521-54889-2, S. 44 (eingeschränkte Vorschau in der Google-Buchsuche).
- Tribikram Kundu: Ultrasonic and Electromagnetic NDE for Structure and Material Characterization. CRC Press, 2012, ISBN 978-1-4398-3663-7, S. 94 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. CRC Press, 1998, ISBN 0-8493-0479-2.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Aluminium) entnommen.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 77.
- T. Merkel, K.-H. Thomas: Taschenbuch der Werkstoffe, 7. verbesserte Auflage, Carl Hanser Verlag, München 2008, S. 294.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Aluminium) entnommen.
- Eintrag zu Aluminium im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Aluminium, Pulver, nicht stabilisiert in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- Eintrag zu Aluminium, Pulver, phlegmatisiert in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- Datenblatt Aluminium bei AlfaAesar, abgerufen am 13. März 2011 (PDF) (JavaScript erforderlich).
- Alumina Production. In: world-aluminium.org. The International Aluminium Institute, abgerufen am 14. Februar 2016.
- Primary Aluminium Production. In: world-aluminium.org. The International Aluminium Institute, abgerufen am 14. Februar 2016.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
- N. A. Figurowski: Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen, in deutscher Übersetzung von Leo Korniljew/Ernst Lemke, Moskau 1981, ISBN 3-7614-0561-8, S. 64.
- Norman N. Greenwood, Alan Earnshaw: Chemistry of the Elements. 2. Auflage. Butterworth–Heinemann, 1997, ISBN 0-08-037941-9, S. 217.
- Mineral Species containing Aluminum (Al) auf Webmineral (englisch).
- B. V. Oleinikov, A. V. Okrugin, N. V. Leskova: Petrological significance of the occurrence of native aluminum in basic rocks. In: Doklady Akademii Nauk SSSR. Band 243, 1978, S. 191–194 (rruff.info [PDF; 240 kB; abgerufen am 11. Januar 2018]).
- Michael Fleischer, Adolf Pabst, J. A. Mandarino: New mineral names. In: American Mineralogist. Band 65, 1980, S. 205–210 (rruff.info [PDF; 1,1 MB; abgerufen am 11. Januar 2018]).
- Fundortliste für Aluminium beim Mineralienatlas und bei Mindat
- IMA/CNMNC List of Mineral Names; November 2018 (PDF 1,7 MB; Aluminium siehe S. 7)
- IMA/CNMNC List of Mineral Names; 2009 (PDF 1,8 MB, Aluminium siehe S. 7).
- Stefan Weiß: Das große Lapis Mineralienverzeichnis. Alle Mineralien von A – Z und ihre Eigenschaften. Stand 03/2018. 7., vollkommen neu bearbeitete und ergänzte Auflage. Weise, München 2018, ISBN 978-3-921656-83-9.
- David Barthelmy: Minerals Arranged by the New Dana Classification. 01.01.01 Gold group. In: webmineral.com. Abgerufen am 14. Januar 2019 (englisch).
- Aluminium. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America. 2001 (handbookofmineralogy.org [PDF; 57 kB; abgerufen am 11. Januar 2018]).
- Rudolf Debar: Die Aluminium-Industrie. 2. Auflage. Springer 1925, S. 55 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Eutektikum Aluminiumoxid/Kryolith. (Memento vom 19. April 2015 im Internet Archive)
- Aluminium und Silizium: von der Lagerstätte bis zur Verwendung. (Memento vom 30. Januar 2012 im Internet Archive) (PDF, Seminararbeit; 527 kB) S. 10.
- Matthias Dienhart: Ganzheitliche Bilanzierung der Energiebereitstellung für die Aluminiumherstellung. (PDF; 1,3 MB) Dissertation. Rheinisch-Westfälischen Technischen Hochschule Aachen, Juni 2003, S. 7.
- Rainer Quinkertz: Optimierung der Energienutzung bei der Aluminiumherstellung. Dissertation. Rheinisch-Westfälische Technische Hochschule Aachen, 2002, S. 75–77.
- United States Geological Survey: World Alumina Refinery and Bauxite Mine Production and Bauxite Reserves, S. 31, abgerufen am 2. September 2021.
- United States Geological Survey: World Smelter Production and Capacity, S. 20, abgerufen am 2. September 2021.
- R. Feige, G. Merker: SEROX – ein synthetischer Al-Glasrohstoff. (PDF; 217 kB).
- Recycling ist nur der zweitbeste Weg. In: Der Spiegel. Nr. 25, 1993 (online).
- Udo Boin, Thomas Linsmeyer, Franz Neubacher, Brigitte Winter: Stand der Technik in der Sekundäraluminiumerzeugung im Hinblick auf die IPPC-Richtlinie. (Österreichisches) Umweltbundesamt, Wien 2000, ISBN 3-85457-534-3. (umweltbundesamt.at PDF)
- Ralph W. G. Wyckoff: Crystal Structures. 2. Auflage. Band 1. John Wiley & Sons, New York, London, Sydney 1963, S. 3 (im Anhang).
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. Chemical-structural Mineral Classification System. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 35.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 71–78.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212–213.
- D. R. Askeland: Materialwissenschaft. Spektrum, Heidelberg 1996, ISBN 3-86025-357-3.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 79.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 77.
- Wolfgang Weißbach: Werkstoffkunde Strukturen, Eigenschaften, Prüfung. Springer-Verlag, 2012, ISBN 978-3-8348-8318-6, S. 196 (eingeschränkte Vorschau in der Google-Buchsuche).
- Bernhard Ilschner: Werkstoffwissenschaften und Fertigungstechnik Eigenschaften, Vorgänge, Technologien. Springer, Berlin 2010, ISBN 978-3-642-01734-6, S. 277.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 214.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212–214.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212, 214.
- Der Technologie-Leitfaden von ELB. In: Eloxalwerk Ludwigsburg.
- Was ist Gefahrgut im Passagiergepäck? (Memento vom 18. August 2017 im Internet Archive) Website des Luftfahrt-Bundesamtes.
- George E. Totten, D. Scott MacKenzie: Handbook of Aluminum Band 1: Physical Metallurgy and Processes. Marcel Dekker, Yew York, Basel. 2003, S. 33–34.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 98–99, 167–168.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 189–190.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 167–168.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 99.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 117–118.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 102–103.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 152–153.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 125–126.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 142–143.
- Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 153.
- Statistiken. Wirtschaftsvereinigung Stahl, abgerufen am 24. Juli 2017.
- Preisindex an der London Metall Exchange
- USA und Kanada legen Aluminium-Zollstreit bei orf.at, 16. September 2020, abgerufen am gleichen Tag.
- D. R. Askeland: Materialwissenschaft. Spektrum, Heidelberg 1996, S. 364.
- D. R. Askeland: Materialwissenschaft. Spektrum, Heidelberg 1996, S. 362.
- Gesamtverband der Aluminiumindustrie e. V.: Meerwasserbeständigkeit von Aluminiumknetlegierungen. (PDF; 54 kB) (Nicht mehr online verfügbar.) Archiviert vom Original am 13. Mai 2016; abgerufen am 29. März 2013.
- world-aluminium.org: The Global Aluminium Industry 40 years from 1972 (PDF; 308 kB), abgerufen am 17. November 2013.
- Absatzmärkte. Gesamtverband der Aluminiumindustrie e. V., abgerufen am 24. Juli 2017.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 34–39.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 39–41.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 52–57.
- René Flosdorff, Günther Hilgarth: Elektrische Energieverteilung. 8. Auflage. Teubner, 2003, ISBN 3-519-26424-2, Kapitel 1.2.2.4.
- Stanley Wolf: Silicon Processing for the VLSI Era. Volume 2: Process Integration. Lattice Press, Sunset Beach, Calif. 1990, ISBN 0-9616721-4-5, S. 191 ff.
- Stanley Wolf: Silicon Processing for the VLSI Era. Volume 4: Deep-Submicron Process Technology. Lattice Press, Sunset Beach 2002, ISBN 0-9616721-7-X, S. 723 ff.
- vgl. Stanley Wolf: Silicon Processing for the VLSI Era. Volume 4: Deep-Submicron Process Technology. Lattice Press, Sunset Beach 2002, ISBN 0-9616721-7-X, S. 713.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 63–64.
- Robert Brockmann: Verlust der Heliumdichtheit. In: Vakuum in Forschung und Praxis. Band 26, Nr. 2, 1. April 2014, S. 19–22, doi:10.1002/vipr.201400547.
- Verheilung von Aluminium: Aktuelles zum UST-Verfahren.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 65.
- How environmentally friendly is the european aluminium industry
- Joachim Achtziger, Günter Pfeifer, Rolf Ramcke, Konrad Zilch: Mauerwerk Atlas. Institut für internationale Architektur-Dokumentation, 2001, S. 59 (eingeschränkte Vorschau in der Google-Buchsuche).
- K. Zilch, C. J. Diederichs, R. Katzenbach, K. J. Beckmann (Hrsg.): Handbuch für Bauingenieure. Technik, Organisation und Wirtschaftlichkeit. 2. Auflage. Springer, 2012, ISBN 978-3-642-14449-3, S. 182.
- VDI 2035: Einfach erklärt für Hausbesitzer. 3. Februar 2020, abgerufen am 19. Oktober 2020.
- CO2 in Wassersystemen - SHKwissen - HaustechnikDialog. Abgerufen am 19. Oktober 2020.
- Kalk und Korrosion unterbinden - ingenieur.de. Abgerufen am 19. Oktober 2020.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 57–59.
- Alcoa Architectural Products (Hrsg.): Aluminium-Verbundplatten und -bleche: Umformen, Gestalten, Begeistern. 30. September 2013 (arconic.com [PDF; 720 kB; abgerufen am 21. Juni 2017] Faltblatt).
- Wolfgang Hoferer: Butzen aus Aluminium. Hrsg.: Aluminium-Werke Wutöschingen (= EG-Sicherheitsdatenblatt gemäß 91/155/EWG. EG-Richtlinie .9.99). 5. Mai 2008, Blatt 4 (aww.de [PDF; 33 kB; abgerufen am 21. Juni 2017] Erste Version 29. März 2007).
- Bernd Leitenberger: Chemische Raketentreibstoffe Teil 1. In: Bernd Leitenbergers Web Site.
- Aluminium auf Feuerwerk-Wiki: www.feuerwerk.net.
- Eberhard Roos, Karl Maile: Werkstoffkunde für Ingenieure, 4. bearbeitete Auflage, 2011, Springer, S. 252.
- A. Herbert Fritz, Günter Schulze: Fertigungstechnik. 10. Auflage. Springer, Berlin 2012, ISBN 978-3-642-29785-4, S. 36.
- Rüdiger Bähr: Urformen in: Molitor, Grote, Herold, Karpuschewski: Einführung in die Fertigungslehre, Shaker, 2008, S. 19.
- Heiko Lickfett: Wirtschaftliche Bedeutung der Gießereiindustrie in: Andreas Bühring-Polaczek, Walter Michaeli, Günter Spur (Hrsg.): Handbuch Urformen, Hanser, 2014, S. 13–16.
- Bernhard Ilschner, Robert F. Singer: Werkstoffwissenschaften und Fertigungstechnik: Eigenschaften, Vorgänge, Technologien. 5. Auflage. Springer, Berlin 2010, S. 449–450.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 419–422.
- Wolfgang Lehnert: Umformung von Aluminium-Werkstoff. In: Günter Drossel, Susanne Friedrich, Catrin Kammer, Wolfgang Lehnert (Hrsg.): Aluminium Taschenbuch: Band 2: Umformung von Aluminium-Werkstoffen, Gießen von Aluminium-Teilen, Oberflächenbehandlung von Aluminium, Recycling und Ökologie. 16. Auflage. Beuth, Berlin 2009, ISBN 978-3-410-22029-9, S. 1 (web.archive.org [PDF; 66 kB; abgerufen am 14. September 2014] Leseprobe).
- Fritz Klocke, Wilfried König: Fertigungsverfahren 4: Umformen. 5. Auflage. Springer, Heidelberg, S. 89–90.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 441–450.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 451–462.
- Eberhard Roos, Karl Maile: Werkstoffkunde für Ingenieure: Grundlagen, Anwendung, Prüfung. 4. Auflage. Springer, Berlin 2011, S. 240.
- Wilfried König, Fritz Klocke: Fertigungsverfahren 1: Drehen, Bohren, Fräsen. 8. Auflage. Springer 2008, ISBN 978-3-540-23458-6, S. 319.
- Thorsten Zurell: Absaugung von Aluminium-Schleifstäuben und -Schweißrauchen im Automobilbau mit ex-geschützten Filtersystemen. In: Gefahrstoffe – Reinhalt. Luft. 62, Nr. 11/12, 2002, S. 455–460.
- Hans J. Fahrenwaldt: Praxiswissen Schweißtechnik: Werkstoffe, Prozesse, Fertigung. 3. Auflage. Vieweg+Teubner, Wiesbaden 2008, ISBN 978-3-8348-0382-5, S. 205.
- Hans J. Fahrenwaldt: Praxiswissen Schweißtechnik: Werkstoffe, Prozesse, Fertigung. 3. Auflage. Vieweg+Teubner, Wiesbaden 2008, ISBN 978-3-8348-0382-5, S. 71, 206.
- Udo M. Spornitz: Anatomie und Physiologie. Lehrbuch und Atlas für Pflege- und Gesundheitsfachberufe. Springer, Berlin 2010, ISBN 978-3-642-12643-7.
- Eintrag zu Aluminium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2013.
- ALUMINIUM IN IMPFSTOFFEN. (arznei-telegramm.de [abgerufen am 6. Oktober 2018]).
- Waldemar Ternes: Biochemie der Elemente: Anorganische Chemie biologischer Prozesse. Springer DE, 2013, ISBN 978-3-8274-3019-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- Doris Oberle et al.: Impfkomplikationen und der Umgang mit Verdachtsfällen. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. Band 62, Nr. 4, 1. April 2019, S. 450–461, doi:10.1007/s00103-019-02913-1.
- J. -P. Goullé und L. Grangeot-Keros: Aluminum and vaccines: Current state of knowledge. In: Médecine et Maladies Infectieuses. 11. Oktober 2019, doi:10.1016/j.medmal.2019.09.012.
- Wilfried Puwein: Das „Waldsterben“ in Österreich und seine ökonomischen Folgen. Nr. 11, 1989 (wifo.ac.at PDF; 792 kB).
- Hideaki Matsumoto: Cell biology of aluminum toxicity and tolerance in higher plants. In: International Review of Cytology. Band 200, 2000, S. 1–46, doi:10.1016/S0074-7696(00)00001-2.
- Bunichi Ezaki et al.: Different mechanisms of four aluminum (Al)-resistant transgenes for Al toxicity in Arabidopsis. In: Plant Physiology. Band 127, Nr. 3, 2001, S. 918–927, PMID 11706174.
- Charlotte Poschenrieder et al.: A glance into aluminum toxicity and resistance in plants. In: Science of the Total Environment. Band 400, Nr. 1–3, 2008, S. 356–368, doi:10.1016/j.scitotenv.2008.06.003.
- Sanjib Kumar Panda, Frantisek Baluska, Hideaki Matsumoto: Aluminum stress signaling in plants. In: Plant Signaling & Behaviour. Band 4, Nr. 7, 2009, S. 592–597, PMID 19820334, PMC 2710549 (freier Volltext).
- Norwegens Süßwasserfische sterben am sauren Regen. In: Arbeiter-Zeitung. Wien 29. September 1981, S. 10, unten links (Die Internetseite der Arbeiterzeitung wird zurzeit umgestaltet. Die verlinkten Seiten sind daher nicht erreichbar. – Digitalisat).
- Bundesverband der Lebensmittelchemiker/-innen im öffentlichen Dienst e. V. (BLC): Aluminium in Lebensmitteln.
- Sabine Greßler und René Fries: Studie: "Aluminium-Toxikologie und gesundheitliche Aspekte körpernaher Anwendungen". Bundesministerium für Arbeit, Soziales, Gesundheit und Konsumentenschutz, abgerufen am 7. August 2019.
- Safety of aluminium from dietary intake ‐ Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials (AFC) In: The EFSA Journal. 754, 2008, S. 1–34; doi:10.2903/j.efsa.2008.754.
- Aluminium in Lebensmitteln: lebensmittel.org.
- Bundesinstitut für Risikobewertung (Hrsg.): Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen. (PDF; 106 kB) 22. Juli 2007.
- Reduzierung der Aluminiumaufnahme kann mögliche Gesundheitsrisiken minimieren. (PDF) In: Stellungnahme Nr. 045/2019 des Bundesinstituts für Risikobewertung (BfR). 18. November 2019, abgerufen am 1. Dezember 2019. doi:10.17590/20191115-135258.
- „Alufolie gehört nicht in die Küche“. Bundesinstitut warnt vor Risiken durch Aluminium im Körper. In: tagesspiegel.de. 19. November 2019, abgerufen am 1. Dezember 2019.
- Grenzwert nach Nr. 1 der Anlage 3 zu §§ 7 und 14 der Trinkwasserverordnung
- Eintrag zu E 173: Aluminium in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 16. Juni 2020.
- Aluminium in der Datenbank für Lebensmittelzusatzstoffe.
- Chemisches und Veterinäruntersuchungsamt Karlsruhe: Laugengebäck: Wie gelangt Aluminium in das Gebäck? (PDF; 1,3 MB) 2004.
- H. Eschnauer: Die Verwendung von Aluminium in der Weinwirtschaft. Vitis, 1, 1958, S. 313–320, zitiert von S. 319, vitis-vea.de (PDF; 729 kB).
- H. Lüllmann, K. Mohr, M. Wehling, L. Hein: Pharmakologie und Toxikologie, Thieme Verlag, 2016, ISBN 978-3-13-368518-4, S. 622–623.
- Wolfgang Maurer: Impfskeptiker – Impfgegner. Von einer anderen Realität im Internet. In: Pharmazie in unserer Zeit. Band 37, Nr. 1, Januar 2008, S. 64–70, doi:10.1002/pauz.200700252.
- H. E. Müller, W. Dünnleder, W. Mühlenberg, R. Ruckdeschel: Legionellen – ein aktives Problem der Sanitärhygiene. 3. Auflage. expert-Verlag, ISBN 978-3-8169-2725-9, S. 14 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pricilla Costa Ferreira et al.: Aluminum as a risk factor for Alzheimer’s disease. In: Revista Latino-Americana de Enfermagem. Band 16, Nr. 1, 2008, S. 151–157, doi:10.1590/S0104-11692008000100023, PMID 18392545.
- Hinnerk Feldwisch-Drentrup: Alu-Deos sind laut neuen Studien sicher. In: MedWatch. 12. Dezember 2019, abgerufen am 10. Oktober 2020.
- V. Rondeau et al.: Aluminum and Silica in Drinking Water and the Risk of Alzheimer’s Disease or Cognitive Decline: Findings From 15-Year Follow-up of the PAQUID Cohort. In: American Journal of Epidemiology. Band 169, Nr. 4, 2008, S. 489–496, doi:10.1093/aje/kwn348, PMID 19064650, PMC 2809081 (freier Volltext).
- Sakae Yumoto, Shigeo Kakimi, Akihiro Ohsaki, Akira Ishikawa: Demonstration of aluminum in amyloid fibers in the cores of senile plaques in the brains of patients with Alzheimer’s disease. In: Journal of Inorganic Biochemistry. Band 103, Nr. 11, 2009, S. 1579–1584, doi:10.1016/j.jinorgbio.2009.07.023, PMID 19744735.
- So schädlich ist Aluminium wirklich. In: Quarks. 3. September 2020, abgerufen am 10. Oktober 2020.
- Aluminium and Alzheimer’s disease. (Memento vom 11. März 2012 im Internet Archive) The Alzheimer’s Society. Abgerufen am 30. Januar 2009.
- Walter Stehling, Timo Grimmer, Alexander Kurz: Leichtes Metall mit schweren Folgen? Aluminium und die Alzheimer Krankheit. In: Archiv Alzheimer Info. DAlzG, März 2013, abgerufen am 11. Oktober 2019.
- Bundesinstitut für Risikobewertung (Hrsg.): Neue Studien zu aluminiumhaltigen Antitranspirantien: Gesundheitliche Beeinträchtigungen durch Aluminium-Aufnahme über die Haut sind unwahrscheinlich (PDF; 319 kB), 20. Juli 2020.
- BfR: Reduzierung der Aluminiumaufnahme kann mögliche Gesundheitsrisiken minimieren. (PDF) In: BfR. BfR, abgerufen am 8. Mai 2020.
- P. D. Darbre: Aluminium, antiperspirants and breast cancer. In: Journal of Inorganic Biochemistry. Band 99, Nr. 9, September 2005, S. 1912–1919, doi:10.1016/j.jinorgbio.2005.06.001, PMID 16045991.
- Moïse Namer et al.: [The use of deodorants/antiperspirants does not constitute a risk factor for breast cancer]. In: Bulletin Du Cancer. Band 95, Nr. 9, September 2008, S. 871–880, doi:10.1684/bdc.2008.0679, PMID 18829420.
- Prue J. Hardefeldt, Senarath Edirimanne, Guy D. Eslick: Deodorant Use and Breast Cancer Risk. In: Epidemiology. Band 24, Nr. 1, Januar 2013, S. 172, doi:10.1097/EDE.0b013e3182781684.
- Mohamed Farouk Allam: Breast Cancer and Deodorants/Antiperspirants: a Systematic Review. In: Central European Journal of Public Health. Band 24, Nr. 3, September 2016, S. 245–247, doi:10.21101/cejph.a4475, PMID 27755864.
- Hinnerk Feldwisch-Drentrup und Jakob Simmank: Aluminiumsalze: Die Alu-Deo-Hysterie. In: Die Zeit. Hamburg 12. Dezember 2019 (zeit.de [abgerufen am 28. Januar 2020]).
- Opinion on the safety of aluminium in cosmetic products Submission II (SCCS/1613/19). (PDF) Scientific Committee on Consumer Safety, 3. März 2020, abgerufen am 16. Juli 2020 (englisch).
- Uwe Kerkow, Jens Martens, Axel Müller: Vom Erz zum Auto. (Memento vom 10. Oktober 2015 im Internet Archive) (PDF) Aachen/ Bonn/ Stuttgart 2012, ISBN 978-3-943126-07-5, S. 29.
- Manfred Sietz, Stefan Seuring: Ökobilanzierung in der betrieblichen Praxis. Eberhard Blottner, Taunusstein 1997, S. 103 (eingeschränkte Vorschau in der Google-Buchsuche).
- Aluminium-Industrie (Memento vom 2. Mai 2010 im Internet Archive) auf staufenbiel.de
- Steel in the circular economy – A life cycle perspective. (Memento vom 12. April 2016 im Internet Archive) (PDF) S. 16.
- Hans Daxbeck, Adolf Merl, Eva Ritter, Paul H. Brunner: Analyse der Flüsse des lizenzierten Aluminiums in Österreich. Technische Universität Wien, Institut für Wassergüte und Abfallwirtschaft, 2000 (rma.at PDF).
- International Aluminium Journal. Nr. 6, 2013, S. 81 ff.
- International Aluminium Journal. Nr. 91, 2015, S. 53.
- Case history: The truth about recycling. In: The Economist. 2007.
- J. Strähle, E. Schweda: Jander · Blasius – Lehrbuch der analytischen und präparativen anorganischen Chemie, 16. Auflage, Hirzel, Stuttgart 2006, ISBN 3-7776-1388-6, S. 626.



_of_stamped_sheets.jpg.webp)

