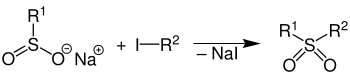Sulfinsäuren
Sulfinsäuren sind eine Klasse von chemischen Verbindungen mit organisch gebundenem Schwefel und Sauerstoff der allgemeinen Struktur R–S(=O)–OH, dabei ist R ein Alkyl- oder Arylrest. Die Grundsubstanz Sulfinsäure besitzt die Struktur H–S(=O)–OH und ist tautomer zur Sulfoxylsäure.[1] Die Salze der Sulfinsäuren sind die Sulfinate.
| Sulfinsäure und Sulfinate |
|---|
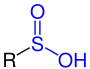 Sulfinsäure |
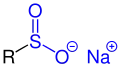 Sulfinate |
| R ist eine Organylgruppe. Die funktionelle Gruppe ist blau markiert. |
Darstellung
Säuren
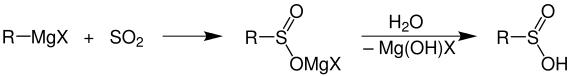
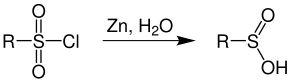
Sulfinsäuren, die als Zwischenstufe bei der Oxidation von Thiolen auftreten, können nicht isoliert werden. Zugänglich sind Sulfinsäuren durch
Grignard-Reaktion, in der ein metallorganisches Reagenz mit Schwefeldioxid reagiert
oder durch Reduktion von Sulfonylchloriden mittels Zinkstaub.[2]
Ester
Sulfinsäureester lassen sich gut herstellen durch Reaktion von Disulfiden mit N-Bromsuccinimid in Gegenwart des esterbildenden Alkohols. Die Reaktion mit primären Alkoholen gelingt gut, bei sekundären Alkoholen wirkt sich ein Zusatz einer kleinen Menge an Kaliumcarbonat günstig aus. Dichlormethan kann als Cosolvens dienen. Alkohole, die mit dem Halogenierungsmittel direkt reagieren, sind für diese Methode ungeeignet.[3] Die benötigten symmetrischen Disulfide lassen sich bequem durch oxidative Kupplung von Thiolen mit Luftsauerstoff herstellen.[4]
Eigenschaften
Die niedermolekularen Vertreter sind viskose Öle, die höheren Homologen sind kristalline Stoffe, die meisten sind gut wasserlöslich. Viele Sulfinsäuren sind instabil. Alle Sulfinsäuren werden von Luftsauerstoff zu Sulfonsäuren oxidiert. Auch unter Luftausschluss disproportionieren sie allmählich.[5]
Sulfinsäuren sind mittelstarke Säuren (pKS ≈ 2–3[2]) und bilden stabile Salze, die Sulfinsäuresalze.[6] Weitere stabile Derivate sind beispielsweise die als cyclische Ester aufzufassenden Sultine.
Reaktionen
Säuren
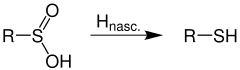
Eine Behandlung mit Reduktionsmitteln wie nascierendem Wasserstoff – etwa aus Zink und Salzsäure – führt zu Thiolen:[2]
Mit Halogenalkanen reagieren die Sulfinsäuresalze zu Sulfonen:[7]
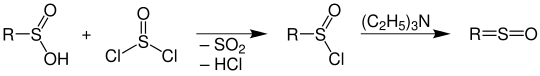
Bei der Reaktion mit Thionylchlorid entstehen aus Sulfinsäuren die Sulfinsäurehalogenide (Sulfinylhalogenide); diese sehr reaktiven Substanzen können – z. B. durch Einwirkung von Triethylamin – zu ketenanalogen Sulfinen (nach IUPAC Thioaldehydoxide und Thioketonoxide) umgesetzt werden:[6]
Ester
Reaktive Aromaten lassen sich nach Art der Friedel-Crafts-Reaktion sulfinylieren. Sulfinsäurester sind geeignet, die empfindlicheren Sulfinylchloride in der Friedel-Crafts-Sulfinylierung zu ersetzen. Die Reaktion vollzieht sich unter milden Bedingungen.[8]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 591.
- Siegfried Hauptmann: Organische Chemie. Deutscher Verlag für Grundstoffindustrie, 1985, ISBN 3-87144-902-4, S. 480–482.
- Peter Brownbridge, Ian C. Jowett: 'One-Pot' Synthesis of Sulphinic Esters from Disulphides. In: Synthesis. 1988, Nr. 03, 1988, S. 252–254. doi:10.1055/s-1988-27535.
- José Luis García Ruano, Alejandro Parra, José Alemán: Efficient synthesis of disulfides by air oxidation of thiols under sonication. In: Green Chemistry. 10, Nr. 6, 2008, S. 706. doi:10.1039/b800705e.
- Eintrag zu Sulfinsäuren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Februar 2013.
- Wissenschaft-Online-Lexika: Eintrag zu „Sulfinsäuren“ im Lexikon der Chemie, abgerufen am 17. Februar 2013.
- Hans Beyer: Lehrbuch der Organischen Chemie. S. Hirzer Verlag, 1998, ISBN 3-7776-0808-4, S. 158–160.
- Francisco Yuste, Angélica Hernández Linares, Virginia M. Mastranzo, Benjamín Ortiz, Rubén Sánchez-Obregón, Alberto Fraile, José Luis García Ruano: Methyl Sulfinates as Electrophiles in Friedel–Crafts Reactions. Synthesis of Aryl Sulfoxides. In: The Journal of Organic Chemistry. 76, Nr. 11, 2011, S. 4635–4644. doi:10.1021/jo2006335.