Osmium
Osmium () ist ein chemisches Element mit dem Elementsymbol Os und der Ordnungszahl 76; im Periodensystem der Elemente steht es in der 8. Gruppe, der Eisengruppe. Es ist ein hartes, sprödes, stahlblaues Übergangsmetall und gehört zu den Platinmetallen. Osmium besitzt mit 462 GPa den höchsten Kompressionsmodul aller Elemente, lediglich übertroffen von aggregierten Diamant-Nanostäbchen, und mit 22,6 g/cm3 die höchste Dichte.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Osmium, Os, 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 8, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | bläulich grau | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-114-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.285 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,01 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 190,23(3)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 130 (185) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 5d6 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 8.43823(20) eV[4] ≈ 814.17 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 17.0(1,0) eV[4] ≈ 1640 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 25.0(1,6) eV[4] ≈ 2410 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 41.0(1,7) eV[4] ≈ 3960 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 55.0(1,9) eV[4] ≈ 5310 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 22,59 g/cm3[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 1,5 · 10−5)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 3400 ± 50[9] K (ca. 3130 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 5273 K[10] (5000 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 8,42 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 678 kJ/mol[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 31,8 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 2,52 Pa bei 3300 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 4940 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 130 J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 10,9 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 88 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [11] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −2, 0, 2, 3, 4, 6, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,85 V (OsO4 + 8H+ + 8e− → Os + 4H2O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,2 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Biologische Funktionen von Osmium sind weder im menschlichen noch in anderen Organismen bekannt. Technisch wird Osmium wegen seines hohen Preises nur verwendet, wenn Haltbarkeit und Härte ausschlaggebend sind.
Geschichte
Osmium, das schwerste Homologe der 8. Gruppe im Periodensystem, wurde 1804 von Smithson Tennant zusammen mit Iridium im Rückstand von in Königswasser aufgelöstem Platin entdeckt. Der Name „Osmium“ entstammt dem rettichartigen Geruch (altgriechisch ὀσμή osmē „Geruch, Gestank“) seines in geringer Konzentration vorhandenen flüchtigen Tetroxids. Die zwei französischen Chemiker Louis-Nicolas Vauquelin und Antoine-François de Fourcroy entdeckten zur selben Zeit dieses Metall in Platin und benannten es ptène[13].
Die erste wichtige Anwendung des Metalls war am Anfang des 20. Jahrhunderts seine Verwendung als Material für Glühfäden in Glühlampen durch Carl Auer von Welsbach. Der Name der Firma Osram leitet sich von den dazu eingesetzten Metallen Osmium und Wolfram ab. In der Anwendung hatte die Verwendung von Osmium jedoch einige Nachteile. Neben dem hohen Preis war vor allem die schwierige Verarbeitung ein Problem. Osmium ist spröde und kann nicht zu Fäden gezogen werden. Daher wurden die Glühfäden durch Spritzen einer osmiumhaltigen Paste und anschließendes Verglühen der organischen Bestandteile hergestellt.[14] Die so erhaltenen Fäden waren allerdings zu dick für hohe Spannungen und außerdem empfindlich gegenüber Erschütterungen und Spannungsschwankungen. Nach kurzer Zeit wurden sie zunächst durch Tantal und schließlich durch Wolfram ersetzt.[15]
Vorkommen

Osmium ist mit einem Anteil von 1 · 10−8 an der Erdkruste sehr selten.[16] Es ist fast immer mit den anderen Platinmetallen Ruthenium, Rhodium, Iridium, Palladium und Platin vergesellschaftet. Osmium kommt häufig gediegen, aber auch gebunden als Sulfid, Selenid oder Tellurid vor.
Bei den Osmiumvorkommen wird zwischen primären und sekundären Lagerstätten unterschieden. Primäre Lagerstätten sind Kupfer-, Nickel-, Chrom- oder Eisenerze, in denen geringe Mengen an Platinmetallen in gebundener Form enthalten sind. Es gibt keine eigenständigen Osmiumerze. Neben diesen Erzen existieren sekundäre Lagerstätten oder Seifenlagerstätten, in denen Osmium und die anderen Platinmetalle gediegen vorkommen. Dabei wurden die Metalle nach Verwitterung vom Wasser ausgewaschen und haben sich – bedingt durch ihre hohe Dichte – an geeigneten Stellen angereichert (vgl. Gold). Osmium kommt dabei vor allem in den natürlichen Legierungen Osmiridium und Iridosmium vor, die neben Osmium vor allem Iridium enthalten und nach ihrem überwiegenden Bestandteil unterschieden werden.
Die wichtigsten Vorkommen sind die platinmetallreichen Nickelerze in Kanada (Sudbury, Ontario), Russland (Ural) und Südafrika (Witwatersrand). Sekundäre Lagerstätten befinden sich am Fuß des Urals, in Kolumbien, Äthiopien und auf Borneo.
Osmium als Mineral
Seit der 1991 erfolgten Neudefinition der Platingruppen-Elementminerale und -legierungen durch Donald C. Harris und Louis J. Cabri werden innerhalb des ternären Systems Os-Ir-Ru alle hexagonalen Legierungen mit Os als Hauptelement als Osmium angesprochen. Die früher parallel verwendeten Mischkristall-Mineralnamen Iridosmin, Osmiridium und Rutheniridosmium sind entsprechend diskreditiert und gelten nun als Varietäten von Osmium.[17]
Osmium ist seit dieser Neudefinition von der International Mineralogical Association (IMA) als eigenständiges Mineral anerkannt.[18] Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Osmium unter der System-Nr. 1.AF.05 (Elemente – Metalle und intermetallische Verbindungen – Platin-Gruppen-Elemente (PGE) – Rutheniumgruppe)[19] (8. Auflage: Osmium-Reihe I/A.05a) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.02.02.01.[20]
Insgesamt sind weltweit bisher mehr als 200 Fundorte für gediegenes Osmium und seine Varietäten bekannt (Stand 2017).[21]
Gewinnung und Darstellung

Die Herstellung von Osmium ist aufwendig und erfolgt im Zuge der Gewinnung anderer Edelmetalle wie Gold oder Platin. Die dazu verwendeten Verfahren nutzen die unterschiedlichen Eigenschaften der einzelnen Edelmetalle und ihrer Verbindungen, wobei nach und nach die Elemente voneinander getrennt werden.
Als Ausgangsmaterial dienen edelmetallhaltige Erze oder Anodenschlamm aus der Nickel- oder Goldgewinnung. Das Erz wird zunächst in Königswasser gelöst. Dabei gehen Gold, Palladium und Platin in Lösung, die anderen Platinmetalle und Silber bleiben zurück. Das Silber reagiert zunächst zu unlöslichem Silberchlorid, das mit Bleicarbonat und Salpetersäure (Bildung von Silbernitrat) entfernt werden kann. Durch Schmelzen mit Natriumhydrogensulfat und anschließendem Auslaugen kann Rhodium als Rhodium(III)-sulfat gelöst und abgetrennt werden. Danach wird der verbleibende Rückstand mit Natriumperoxid geschmolzen, wodurch Osmium und Ruthenium gelöst werden und das unlösliche Iridium zurückbleibt. Wenn diese Lösung mit Chlor behandelt wird, entstehen die flüchtigen Stoffe Rutheniumtetroxid und Osmiumtetroxid. Bei Zugabe von alkoholischer Natronlauge löst sich nur Osmiumtetroxid und kann auf diese Weise vom Ruthenium abgetrennt werden. Das Osmium wird mit Ammoniumchlorid als Komplex ausgefällt und schließlich mit Wasserstoff zu metallischem Osmium reduziert:
Osmium wird nur in sehr geringen Mengen gewonnen, die Produktionsmenge liegt weltweit bei ca. 100 kg pro Jahr.[1]
Eigenschaften
Physikalische Eigenschaften
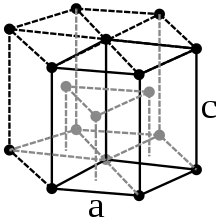

Metallisches Osmium ist ein auch bei höheren Temperaturen glänzendes Schwermetall von stahlblauer Farbe. Es kristallisiert in einer hexagonal-dichtesten Kugelpackung in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 273,5 pm, c = 431,9 pm sowie zwei Formeleinheiten pro Elementarzelle.[22]
Osmium ist vor Iridium das Element mit der höchsten Dichte. Kristallographische Berechnungen ergeben für Osmium 22,59 g/cm3 und für Iridium 22,56 g/cm3[7] im natürlichen Isotopenverhältnis. Damit ist Osmium das dichteste auf der Erde natürlich vorkommende Element.
Osmium besitzt von allen Platinmetallen den höchsten Schmelzpunkt und den niedrigsten Dampfdruck. Sein Kompressionsmodul von 462 GPa ist unter den höchsten aller bekannten Elemente und Verbindungen; damit ist es sogar weniger komprimierbar als Diamant mit 443 GPa,[23] nur aggregierte Diamant-Nanostäbchen sind noch härter (bis zu 491 GPa). Unterhalb der Sprungtemperatur von 0,66 K[24] wird Osmium zum Supraleiter.
Chemische Eigenschaften
Osmium gehört zu den Edelmetallen und ist damit reaktionsträge. Es reagiert direkt nur mit den Nichtmetallen Fluor, Chlor und Sauerstoff. Eine Reaktion von Sauerstoff und kompaktem Osmium findet erst bei Rotglut statt. Je nach Reaktionsbedingungen entsteht Osmiumtetroxid (weniger hohe Temperaturen, hoher Sauerstoffdruck) oder Osmiumtrioxid (nur in der Gasphase stabil[25]). Feinverteiltes Osmium bildet schon bei Raumtemperatur in Spuren hochgiftiges Osmiumtetroxid.
In nichtoxidierenden Mineralsäuren ist Osmium unlöslich, selbst Königswasser kann Osmium bei niedrigen Temperaturen nicht auflösen. Starke Oxidationsmittel wie beispielsweise konzentrierte Salpetersäure und heiße Schwefelsäure sowie alkalische Oxidationsschmelzen wie Natriumperoxid- und Kaliumchloratschmelzen können Osmium jedoch angreifen.
Isotope
Von Osmium sind insgesamt 34 Isotope und 6 Kernisomere bekannt, davon kommen die sieben Isotope mit den Massen 184, 186, 187, 188, 189, 190 und 192 natürlich vor. 192Os ist mit einem Anteil von 40,78 %[26] des natürlichen Osmiums das häufigste Isotop, 184Os mit 0,02 %[26] das seltenste. Als einziges der natürlichen Isotope ist 186Os radioaktiv, jedoch mit über 2 Billiarden Jahren Halbwertszeit nur schwach. Neben diesen gibt es noch weitere 27 kurzlebige Isotope von 162Os bis 196Os,[26] die wie die kurzlebigen Kernisomere nur künstlich herstellbar sind.
Die zwei Isotope 187Os und 189Os können für kernspintomographische Untersuchungen verwendet werden. Von den künstlichen Nukliden werden 185Os (Halbwertszeit 96,6 Tage) und 191Os (15 Tage) als Tracer verwendet. Das Verhältnis von 187Os zu 188Os kann in Rhenium-Osmium-Chronometern zur Altersbestimmung in Eisenmeteoriten benutzt werden, da 187Re langsam zu 187Os zerfällt (Halbwertszeit: 4,12 · 1010 Jahre[26]).[27]
Verwendung
Für das Element gibt es wegen seiner Seltenheit, seines komplizierten Herstellungsverfahrens und des damit einhergehenden hohen Preises von 400 US-Dollar pro Feinunze (Stand Nov. 2018)[28] verhältnismäßig wenige technische Anwendungen.[29] Aufgrund der hohen Giftigkeit der Oxide wird Osmium selten in reinem Zustand verwendet. In abrasiven und verschleißenden Anwendungen wie in Spitzen von Füllfederhaltern, phonographischen Abtastnadeln, Wellen und Zapfen im Instrumentenbau sowie elektrischen Kontakten kommen harte osmiumhaltige Legierungen der Platinmetalle zum Einsatz. Eine Legierung aus 90 % Platin und 10 % Osmium wird zu medizinischen Implantaten und künstlichen Herzklappen verarbeitet sowie in Herzschrittmachern verwendet. Manchmal wird Osmium als Katalysator für Hydrierungen benutzt. Osmium wurde auch in Legierung mit Wolfram in den Glühfäden der Osram-Glühlampen verwendet.
Nachweis
Mögliche Nachweise von Osmium können über das Osmiumtetroxid erfolgen. Ein einfacher, aber wegen der Giftigkeit nicht empfehlenswerter Nachweis wäre über den charakteristischen Geruch des Osmiumtetroxids. Es sind aber auch chemische Nachweise möglich. Dabei wird eine osmiumhaltige Probe auf Filterpapier mit Benzidin- oder Kaliumhexacyanoferratlösung zusammengebracht. Mit Benzidin verfärbt sich das Papier bei Anwesenheit von Osmiumtetroxid violett, mit Kaliumhexacyanoferrat hellgrün.[30]
In der modernen Analytik sind diese Nachweise nicht mehr von Bedeutung; heute kann Osmium mittels instrumenteller Verfahren wie Neutronenaktivierungsanalyse, Voltammetrie, Atomspektrometrie oder Massenspektrometrie[31] nicht nur nachgewiesen, sondern mit hoher Genauigkeit quantitativ bestimmt werden. Die NMR-Spektroskopie und Röntgenbeugung ermöglichen die Strukturanalytik von organischen und anorganischen Osmiumverbindungen.
Sicherheitshinweise
Metallisches Osmium ist harmlos.[32]
Osmiumtetroxid ist giftig. Stäube können eine Lungenreizung mit Hyperämie bis zum Lungenödem hervorrufen sowie zu Haut- oder Augenschäden führen.[33] Da an der Luft aus pulverförmigem metallischem Osmium stets geringe Mengen Osmiumtetroxid entstehen, ist auch bei dieser Form des Elements Vorsicht geboten.
Metallisches Osmium ist als fein verteiltes Pulver oder Staub leichtentzündlich, in kompakter Form aber nicht brennbar. Zum Löschen von Osmiumbränden müssen Metallbrandlöscher (Klasse D) oder Löschpulver verwendet werden, keinesfalls darf Wasser verwendet werden, wegen der Explosionsgefahr durch entstehenden Wasserstoff.[12]
Verbindungen
Es sind Verbindungen und Komplexe in den Oxidationsstufen von −II bis +VIII bekannt, die stabilste Oxidationsstufe ist +IV. Osmium zählt zusammen mit Ruthenium und Xenon zu den wenigen Elementen, die die Oxidationsstufe +VIII erreichen. Lediglich Iridium weist eine höhere Oxidationsstufe von +IX auf. Osmium bildet mit den meisten Nichtmetallen Verbindungen wie Oxide, Halogenide, Sulfide, Telluride, und Phosphide.
Osmiumtetroxid
Osmiumtetroxid OsO4 ist die bekannteste Verbindung des Osmiums und eine der wenigen stabilen Verbindungen, in der Osmium die Oxidationsstufe +VIII besitzt. Die Verbindung bildet sich durch Einwirkung von Oxidationsmitteln wie Salpetersäure auf metallisches Osmium. Es ist ein leichtflüchtiger Feststoff, der sehr stark oxidierend wirkt. Im Unterschied zu vielen anderen Oxidationsmitteln kann die Reaktion unter stereochemischer Kontrolle ablaufen. Aufgrund dieser Eigenschaften hat die Verbindung trotz der hohen Toxizität und des hohen Preises einige Anwendungen gefunden. Osmiumtetroxid wird häufig nur in katalytischen Mengen eingesetzt.
Es wird zur Fixierung und Kontrastverstärkung von Lipiden (Fetten) und Zellmembranen in der Elektronenmikroskopie und bei der Spurensicherung (Fingerabdrücke) eingesetzt. In der Organischen Chemie dient es als Oxidationsmittel zur cis-Hydroxylierung von Alkenen zu vicinalen Diolen und bei der Jacobsen-Katsuki-Reaktion bzw. bei der Sharpless-Epoxidierung zur stereoselektiven Epoxidierung.
Weitere Osmiumverbindungen
Mit Sauerstoff bildet Osmium weitere Verbindungen, die Oxide Osmiumtrioxid OsO3 und Osmiumdioxid OsO2. Osmiumtrioxid ist nur in der Gasphase stabil, Osmiumdioxid dagegen ein stabiler, hochschmelzender Feststoff in Rutil-Struktur.
Mit den Halogenen Fluor, Chlor, Brom und Iod sind eine Vielzahl von Verbindungen bekannt. Die möglichen Oxidationsstufen des Osmiums reichen dabei von +VII bei Osmium(VII)-fluorid bis +I bei Osmium(I)-iodid.
Des Weiteren sind Verbindungen mit Arsen und Schwefel bekannt, die auch in der Natur vorkommen und als Minerale Erlichmanit (OsS2), Osarsit (OsAsS) und Omeiit (OsAs2) anerkannt sind.[34]
Komplexverbindungen
Neben diesen Verbindungen sind zahlreiche Komplexverbindungen bekannt. Vom Osmiumtetroxid leiten sich die Osmate, anionische Komplexe des Osmiums ab. Auch mit anderen Liganden, wie Ammoniak, Kohlenstoffmonoxid, Cyanid und Stickstoffmonoxid sind viele Komplexe in verschiedenen Oxidationsstufen bekannt. Mit organischen Liganden, wie Cyclopentadien kann der Osmiumkomplex Osmocen, der zu den Metallocenen gehört, gebildet werden. Neben klassischen Komplexen, bei denen jede Metall-Ligand-Bindung eindeutig bestimmt werden kann, existieren auch nicht-klassische Komplexe. Bei diesen liegen Metallcluster aus mehreren Osmiumatomen vor. Ihre konkrete Gestalt kann mit Hilfe der Wade-Regeln bestimmt werden.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Hans Breuer: dtv-Atlas Chemie. Band 1, 9. Auflage. München 2000, ISBN 3-423-03217-0.
- Michael Binnewies: Allgemeine und Anorganische Chemie. 1. Auflage. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-0208-5.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. Weinheim 1988, ISBN 3-527-26169-9.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
Weblinks
- Mineralienatlas:Osmium (Wiki)
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Osmium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu osmium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu osmium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Osmium) entnommen.
- J. W. Arblaster: Densities of Osmium and Iridium. In: Platinum Metals Review. 33, 1, 1989, S. 14–16; (Volltext; PDF; 209 kB).
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- J. W. Arblaster: What is the True Melting Point of Osmium? In: Platinum Metals Review. 49, 4, 2005, S. 166–168; (Volltext; PDF; 610 kB); doi:10.1595/147106705X70264.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Osmium) entnommen.
- Eintrag zu Osmium, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. April 2020. (JavaScript erforderlich)
- Rolf Haubrichs, Pierre-Léonard Zaffalon: Osmium vs. ‘Ptène’: The Naming of the Densest Metal. In: Johnson Matthey Technology Review. Nr. 61, 2017, doi:10.1595/205651317x695631 (matthey.com).
- Glühlampe bei wissen.de
- 100 Jahre Osram. September 2006 (PDF; 4,9 MB), S. 16.
- Hans Breuer: dtv-Atlas Chemie. Band 1, 9. Auflage. dtv-Verlag, 2000, ISBN 3-423-03217-0.
- Donald C. Harris, Louis J. Cabri: Nomenclature of platinum-group-element alloys: Review and revision. In: The Canadian Mineralogist. Band 29, 1991, S. 231–237 (rruff.info [PDF; 738 kB; abgerufen am 1. Januar 2018]).
- IMA/CNMNC List of Mineral Names; July 2019 (PDF 1,67 MB; Osmium siehe S. 144)
- IMA/CNMNC List of Mineral Names; 2009 (PDF 1,8 MB, Osmium siehe S. 211).
- Webmineral – Minerals Arranged by the New Dana Classification. 01.02.02 Osmium group (Space Group P63/mmc)
- Fundortliste für Osmium beim Mineralienatlas und bei Mindat
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. B30, 1974, S. 193–204; doi:10.1107/S0567740874002469.
- Osmium is Stiffer than Diamond. In: Physical Review Focus. 27. März 2002.
- Physikalische Eigenschaften von Osmium bei webelements.com (engl.)
- Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3689 (eingeschränkte Vorschau in der Google-Buchsuche).
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- J. L. Birck, M. Roy-Barman, C. J. Allegre: The Rhenium Osmium Chronometer: The Iron Meteorites Revisited. In: Meteoritics. 26, 1991, S. 318; (Volltext); Preprint.
- The Cost, Characteristics, and Uses of Osmium (Verweis auf Engelhard Industrial Bullion (EIB) Prices)
- Rohstoffrisikobewertung – Platingruppenmetalle. In: Deutsche Rohstoffagentur (Hrsg.): DERA Rohstoffinformationen. Nr. 26. Berlin 2014, ISBN 978-3-943566-20-8, S. 44.
- N. A. Tananaeff, A. N. Romanjuk: Tüpfelmethode zum Nachweis von Osmium. Analytisches Laboratorium des Kiewer Industrie-Institutes, 1936.
- Seo JH, Sharma M, Osterberg EC, Jackson BP: Determination of Osmium Concentration and Isotope Composition at Ultra-low Level in Polar Ice and Snow., Anal Chem. 2018 May 1;90(9):5781-5787, PMID 29627976
- A. I. G. McLaughlin, R. Milton, Kenneth M. A. Perry: Toxic Manifestations of Osmium Tetroxide. In: British Journal of Industrial Medicine. Band 3, Nr. 3, Juli 1946, S. 183–186, PMID 20991177, PMC 1035752 (freier Volltext).
- Datenblatt Osmium (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Malcolm Back, William D. Birch, Michel Blondieau und andere: The New IMA List of Minerals – A Work in Progress – Updated: March 2020. (PDF; 2,44 MB) In: cnmnc.main.jp. IMA/CNMNC, Marco Pasero, März 2020, abgerufen am 18. April 2020 (englisch).



.jpg.webp)