Dithionate
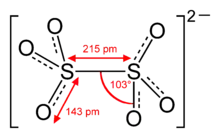
Dithionate (veraltet auch Hypodisulfate) sind die anorganischen Salze der unbeständigen Dithionsäure (Dischwefel(V)-säure, H2S2O6) und schwache Oxidationsmittel[1]. Die Salze bestehen aus einem Dithionat-Ion S2O62−, das im sauren Milieu (H+-Überschuss) als Dianion vorliegt, und einem Metallkation.[1] Das Dithionat-Anion weist an beiden Schwefelatomem eine tetraedrische Anordnung auf und ist sterisch mit Ethan vergleichbar. Es gibt auch hier eine gestaffelte und eine ekliptische Konformation; im Hydrat von Natriumdithionat Na2S2O6·2H2O ist die Anordnung gestaffelt, während das wasserfreie Salz ekliptisch aufgebaut ist.[2]
Darstellung
Die reine Dithionsäure ist nur in verdünnter wässriger Lösung darstellbar:
Die so erhaltene Lösung muss noch vom Bariumsulfat abgetrennt werden und kann dann bei Raumtemperatur über Phosphorpentoxid bis zu einer Dichte von 1,347 g·cm−3 eingeengt werden. Höhere Aufkonzentrierung führt zur Zersetzung der enthaltenen Dithionsäure.[3]
Dithionate werden im Normalfall nicht direkt aus der Dithionsäure gebildet, sondern mit Hilfe einer stabileren Säure. Die Dithionsäure dient hier nur als Namensstamm. Als Beispiel kann die Bildung von Mangan(II)-dithionat aus Braunstein und Schwefliger Säure (schematisch) angeführt werden:
Auch durch anodische Oxidation von Hydrogensulfaten können Dithionate hergestellt werden.
Stabilität
Wie auch die Dithionsäure disproportionieren die Dithionate beim Erhitzen oder Ansäuern leicht in SO2 und SO42−.
So zerfällt zum Beispiel Kaliumdithionat bei 258 °C in Kaliumsulfat und Schwefeldioxid.[1]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 519.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Edition, Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4.
- Georg Brauer: Dithionsäure. In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag Stuttgart, 1954, S. 305.