Liste der Häufigkeiten chemischer Elemente
Die Liste der Häufigkeiten chemischer Elemente gibt die relative Häufigkeit der einzelnen chemischen Elemente in verschiedenen Systemen – wie dem gesamten Universum, der Erde oder dem menschlichen Körper – an. Die Häufigkeit der Elemente unterscheidet sich je nach betrachtetem System stark voneinander.

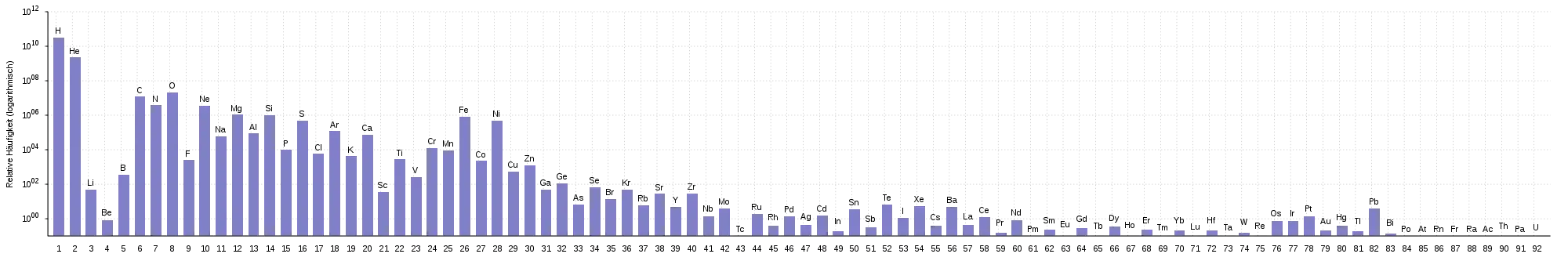
Wird das gesamte Universum betrachtet, ist Wasserstoff das mit Abstand häufigste Element. Danach folgt Helium, das teilweise schon durch die primordiale Nukleosynthese entstanden ist, aber auch im Zuge des Wasserstoffbrennens in Sternen entsteht. Alle weiteren Elemente zusammen machen nur einen kleinen Teil der im Universum vorhandenen Materie aus. Die Häufigkeiten folgen dabei großteils den Reaktionszyklen der stellaren Nukleosynthese. So sind die nicht direkt in Sternen gebildeten Elemente Lithium, Bor und Beryllium selten, die darauf folgenden wie Kohlenstoff und Sauerstoff häufig. Ein häufiges schweres Element ist Eisen, das den Endpunkt der stellaren Nukleosynthese darstellt. Alle schwereren Elemente können nur durch andere astrophysikalische Ereignisse wie Novae oder Supernovae gebildet werden und sind dementsprechend seltener. Charakteristisch ist auch die unterschiedliche Häufigkeit von Elementen mit gerader und ungerader Ordnungszahl, die ebenfalls mit der Nukleosynthese über Heliumkerne zusammenhängt (Harkin-Regel).
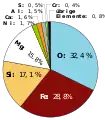
Auf der Erde unterscheidet sich die Elementhäufigkeit von der im Weltraum. So sind die im Universum dominierenden leichtesten Elemente Wasserstoff und Helium selten, da sie sich gasförmig gravitativ nur in viel größeren Himmelskörpern, den Sternen wie der Sonne und Gasplaneten wie etwa Jupiter, zusammenballen. Stattdessen sind die häufigsten Elemente Sauerstoff, Eisen und Silicium. Es gibt auf der Erde große Unterschiede in der Verteilung. So findet sich ein Großteil des Eisens im Erdkern, während Sauerstoff und Silicium vorwiegend in der Erdkruste zu finden sind. Betrachtet man andere Systeme auf der Erde, etwa die Meere oder biologische Systeme, liegen wiederum geänderte Häufigkeiten der Elemente vor.
Die ersten systematischen Untersuchungen zur Elementhäufigkeit stammen von Victor Moritz Goldschmidt, nach ihm heißt die grafische Darstellung der Elementhäufigkeiten Goldschmidt-Diagramm.
Legende
| Element | Name des Elementes | ||
| Symbol | Elementsymbol des jeweiligen Elementes | ||
| Ordnungszahl | Ordnungszahl des jeweiligen Elementes | ||
| Atommasse | Atommasse des jeweiligen Elementes in der Einheit u | ||
| Häufigkeit | Häufigkeit des Elementes im betrachteten System in den angegebenen Einheiten (ppmw (ppm weight) bezieht sich jeweils auf ein Massenverhältnis) | ||
| Bemerkungen | Hinweise zur Elementhäufigkeit, etwa zur Verteilung oder Entstehung | ||
| essentiell? | Ist das Element essentiell für den menschlichen Organismus? |
Häufigkeiten im Sonnensystem
| Element (85 Stück) |
Sym- bol |
Ord- nungs- zahl |
Atom- Masse (u) |
Häufigkeit rel. zu Silicium mit 106[1] (Rang) |
Bemerkungen |
|---|---|---|---|---|---|
| Wasserstoff | H | 1 | 1,008 | 3.2e10 (1.) | häufigstes Element, kein zusammengesetzter Atomkern (außer beim schweren Wasserstoff (Deuterium)) |
| Helium | He | 2 | 4,003 | 2.2e9 (2.) | zweithäufigstes Element, entstand teilweise durch primordiale Nukleosynthese sowie durch Wasserstoffbrennen |
| Lithium | Li | 3 | 6,941 | 5.0e1 (30.) | entstand in Spuren bei der primordialen Nukleosynthese |
| Beryllium | Be | 4 | 9,012 | 8.1e-1 (53.) | |
| Bor | B | 5 | 10,811 | 3.5e2 (26.) | |
| Kohlenstoff | C | 6 | 12,011 | 1.2e7 (4.) | entsteht durch den Drei-Alpha-Prozess |
| Stickstoff | N | 7 | 14,007 | 3.7e6 (5.) | |
| Sauerstoff | O | 8 | 15,999 | 2.2e7 (3.) | entsteht durch Weiterreaktion des Drei-Alpha-Prozesses |
| Fluor | F | 9 | 18,998 | 2.5e3 (22.) | |
| Neon | Ne | 10 | 20,180 | 3.4e6 (6.) | entsteht durch Kohlenstoffbrennen |
| Natrium | Na | 11 | 22,990 | 6.0e4 (14.) | |
| Magnesium | Mg | 12 | 24,305 | 1.1e6 (7.) | entsteht durch Kohlenstoff- und Neonbrennen |
| Aluminium | Al | 13 | 26,982 | 8.5e4 (12.) | |
| Silicium | Si | 14 | 28,086 | 1.0e6 (8.) | entsteht durch Sauerstoffbrennen |
| Phosphor | P | 15 | 30,974 | 9.6e3 (17.) | entsteht durch Sauerstoffbrennen |
| Schwefel | S | 16 | 32,065 | 5.0e5 (10.) | entsteht durch Sauerstoffbrennen |
| Chlor | Cl | 17 | 35,453 | 5.7e3 (19.) | |
| Argon | Ar | 18 | 39,948 | 1.2e5 (11.) | |
| Kalium | K | 19 | 39,098 | 4.2e3 (20.) | |
| Calcium | Ca | 20 | 40,078 | 7.2e4 (13.) | |
| Scandium | Sc | 21 | 44,956 | 3.5e1 (33.) | |
| Titan | Ti | 22 | 47,867 | 2.8e3 (21.) | |
| Vanadium | V | 23 | 50,942 | 2.6e2 (27.) | |
| Chrom | Cr | 24 | 51,996 | 1.3e4 (16.) | |
| Mangan | Mn | 25 | 54,938 | 9.3e3 (18.) | |
| Eisen | Fe | 26 | 55,845 | 8.3e5 (9.) | Endpunkt der Kernfusion in Sternen, entsteht durch Siliciumbrennen |
| Cobalt | Co | 27 | 58,933 | 2.2e3 (23.) | |
| Nickel | Ni | 28 | 58,693 | 4.8e4 (15.) | |
| Kupfer | Cu | 29 | 63,546 | 5.4e2 (25.) | |
| Zink | Zn | 30 | 65,409 | 1.2e3 (24.) | |
| Gallium | Ga | 31 | 69,723 | 4.8e1 (31.) | |
| Germanium | Ge | 32 | 72,640 | 1.2e2 (28.) | |
| Arsen | As | 33 | 74,922 | 6.6e0 (37.) | |
| Selen | Se | 34 | 78,960 | 6.7e1 (29.) | |
| Brom | Br | 35 | 79,904 | 1.4e1 (36.) | |
| Krypton | Kr | 36 | 83,798 | 4.7e1 (32.) | |
| Rubidium | Rb | 37 | 85,468 | 5.9e0 (39.) | |
| Strontium | Sr | 38 | 87,620 | 2.7e1 (35.) | |
| Yttrium | Y | 39 | 88,906 | 4.8e0 (41.) | |
| Zirconium | Zr | 40 | 91,224 | 2.8e1 (34.) | |
| Niob | Nb | 41 | 92,906 | 1.4e0 (48.) | |
| Molybdän | Mo | 42 | 95,940 | 4.0e0 (43.) | |
| Technetium | Tc | 43 | 98,906 | (84.) | kein stabiles Isotop |
| Ruthenium | Ru | 44 | 101,070 | 1.9e0 (46.) | |
| Rhodium | Rh | 45 | 102,906 | 4.0e-1 (59.) | |
| Palladium | Pd | 46 | 106,420 | 1.3e0 (50.) | |
| Silber | Ag | 47 | 107,868 | 4.5e-1 (57.) | |
| Cadmium | Cd | 48 | 112,411 | 1.5e0 (47.) | |
| Indium | In | 49 | 114,818 | 1.9e-1 (70.) | |
| Zinn | Sn | 50 | 118,710 | 3.6e0 (45.) | hat die meisten stabilen Isotope |
| Antimon | Sb | 51 | 121,760 | 3.2e-1 (63.) | |
| Tellur | Te | 52 | 127,600 | 6.4e0 (38.) | |
| Iod | I | 53 | 126,904 | 1.1e0 (52.) | |
| Xenon | Xe | 54 | 131,293 | 5.4e0 (40.) | |
| Caesium | Cs | 55 | 132,905 | 3.9e-1 (61.) | |
| Barium | Ba | 56 | 137,327 | 4.8e0 (42.) | |
| Lanthan | La | 57 | 138,906 | 4.5e-1 (58.) | |
| Cer | Ce | 58 | 140,116 | 1.2e0 (51.) | |
| Praseodym | Pr | 59 | 140,908 | 1.5e-1 (73.) | |
| Neodym | Nd | 60 | 144,240 | 7.8e-1 (54.) | |
| Promethium | Pm | 61 | 146,915 | (85.) | kein stabiles Isotop |
| Samarium | Sm | 62 | 150,360 | 2.3e-1 (65.) | |
| Europium | Eu | 63 | 151,964 | 8.5e-2 (75.) | |
| Gadolinium | Gd | 64 | 157,250 | 3.0e-1 (64.) | |
| Terbium | Tb | 65 | 158,925 | 5.5e-2 (78.) | |
| Dysprosium | Dy | 66 | 162,500 | 3.6e-1 (62.) | |
| Holmium | Ho | 67 | 164,930 | 7.9e-2 (76.) | |
| Erbium | Er | 68 | 167,259 | 2.3e-1 (66.) | |
| Thulium | Tm | 69 | 168,934 | 3.4e-2 (81.) | |
| Ytterbium | Yb | 70 | 173,040 | 2.2e-1 (67.) | |
| Lutetium | Lu | 71 | 174,967 | 3.6e-2 (80.) | |
| Hafnium | Hf | 72 | 178,490 | 2.1e-1 (68.) | |
| Tantal | Ta | 73 | 180,948 | 2.1e-2 (83.) | seltenstes stabiles Element |
| Wolfram | W | 74 | 186,840 | 1.6e-1 (72.) | |
| Rhenium | Re | 75 | 186,207 | 5.3e-2 (79.) | |
| Osmium | Os | 76 | 190,230 | 7.5e-1 (55.) | |
| Iridium | Ir | 77 | 192,217 | 7.2e-1 (56.) | |
| Platin | Pt | 78 | 195,078 | 1.4e0 (49.) | |
| Gold | Au | 79 | 196,967 | 2.0e-1 (69.) | |
| Quecksilber | Hg | 80 | 200,590 | 4.0e-1 (60.) | |
| Thallium | Tl | 81 | 204,383 | 1.9e-1 (71.) | |
| Blei | Pb | 82 | 207,200 | 4.0e0 (44.) | stabiles Element mit der höchsten Ordnungszahl, Endpunkt mehrerer Zerfallsreihen |
| Bismut | Bi | 83 | 208,980 | 1.4e-1 (74.) | instabil, auf Grund langer Halbwertszeit noch nicht zerfallen |
| Thorium | Th | 90 | 232,038 | 5.8e-2 (77.) | instabil, auf Grund langer Halbwertszeit noch nicht zerfallen |
| Uran | U | 92 | 238,029 | 2.6e-2 (82.) | instabil, auf Grund langer Halbwertszeit noch nicht zerfallen |
Häufigkeiten auf der Erde
Massenanteile der Elemente …
 an der ganzen Erde
an der ganzen Erde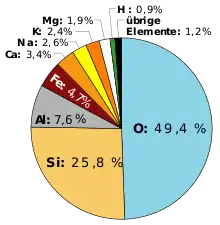 an der Erdhülle
an der Erdhülle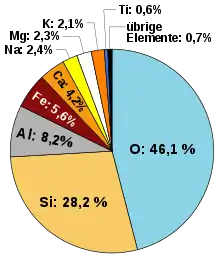 an der Erdkruste
an der Erdkruste im Menschen (englisch)
im Menschen (englisch)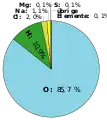 Volumenanteile der Elemente in den Ozeanen
Volumenanteile der Elemente in den Ozeanen
| Element (94 Stück) |
Sym- bol |
Ord- nungs- zahl |
Häufigkeit [ppmw] | Bemerkungen | |||
|---|---|---|---|---|---|---|---|
| ge- samte Erde[2] |
Erdhülle[3] (Rang) | Kontinen- tale Erd- kruste[4] |
Ozeane [mg/l][4] | ||||
| Wasserstoff | H | 1 | 2.6e2 | 8.8e3 (9.) | 1.4e3 | 1.1e5 | überwiegend in Wasser enthalten: Grund-, Oberflächenwasser, Eis, Troposphäre |
| Helium | He | 2 | 4.0e-3 (78.) | 8.0e-3 | 7.0e-6 | entsteht in der Erde durch α-Zerfall, in Erdgas enthalten, entweicht laufend ins All | |
| Lithium | Li | 3 | 2.3e0 | 6.0e1 (27.) | 2.0e1 | 1.8e-1 | Vorkommen in Mineralen wie Amblygonit und in Salzseen |
| Beryllium | Be | 4 | 4.6e-2 | 5.3e0 (48.) | 2.8e0 | 5.6e-6 | selten, Minerale sind bsp. Beryll und Bertrandit |
| Bor | B | 5 | 2.6e-1 | 1.6e1 (37.) | 1.0e1 | 4.4e0 | Vorkommen in Borat-Mineralen wie Borax und Kernit |
| Kohlenstoff | C | 6 | 1.7e3 | 8.7e2 (13.) | 2.0e2 | 2.8e1 | selten auch elementar als Diamant und Graphit, vor allem in Carbonat-Mineralen, auch in Biosphäre, Erdöl- und Kohlelagern |
| Stickstoff | N | 7 | 1.3e0 | 3.0e2 (17.) | 1.9e1 | 5.0e-1 | überwiegend als N2 in der Atmosphäre enthalten, selten gebunden in Mineralen wie Chilesalpeter |
| Sauerstoff | O | 8 | 3.2e5 | 4.9e5 (1.) | 4.6e5 | 8.5e5 | elementar als O2 in der Atmosphäre, große Zahl von oxidischen und silicatischen Mineralen |
| Fluor | F | 9 | 5.1e0 | 2.8e2 (18.) | 5.9e2 | 1.3e0 | häufigste Minerale sind Fluorit und Fluorapatit |
| Neon | Ne | 10 | 5.0e-3 (75.) | 5.0e-3 | 1.2e-4 | seltener Bestandteil der Erdatmosphäre | |
| Natrium | Na | 11 | 1.9e3 | 2.6e4 (6.) | 2.4e4 | 1.1e4 | häufiger Bestandteil des Meerwassers, viele Minerale wie Halit |
| Magnesium | Mg | 12 | 1.6e5 | 1.9e4 (8.) | 2.3e4 | 1.3e3 | vor allem in Carbonaten wie Dolomit und Silicaten wie Olivin zu finden, häufigerer Bestandteil des Meerwassers |
| Aluminium | Al | 13 | 1.5e4 | 7.6e4 (3.) | 8.2e4 | 2.0e-3 | häufig, weit verbreitet in Oxiden, Hydroxiden und Alumosilicaten wie Feldspat |
| Silicium | Si | 14 | 1.7e5 | 2.6e5 (2.) | 2.8e5 | 2.2e0 | zweithäufigster Bestandteil der Erdkruste, große Zahl von Silicat-Mineralen |
| Phosphor | P | 15 | 6.9e2 | 9.0e2 (12.) | 1.1e3 | 6.0e-2 | in Phosphaten, vor allem Apatit gebunden |
| Schwefel | S | 16 | 4.6e3 | 4.8e2 (15.) | 3.5e2 | 9.1e2 | auch elementar, dazu eine Vielzahl Sulfid- und Sulfat-Minerale |
| Chlor | Cl | 17 | 1.0e1 | 1.9e3 (11.) | 1.5e2 | 1.9e4 | als Chlorid, große Halit-Vorkommen, häufiger Bestandteil des Meerwassers |
| Argon | Ar | 18 | 3.6e0 (53.) | 3.5e0 | 4.5e-1 | häufigstes Edelgas auf der Erde, Bestandteil der Atmosphäre | |
| Kalium | K | 19 | 1.7e2 | 2.4e4 (7.) | 2.1e4 | 4.0e2 | wichtige Kalisalze sind Sylvin und Carnallit |
| Calcium | Ca | 20 | 1.6e4 | 3.4e4 (5.) | 4.2e4 | 4.1e2 | häufig, als Carbonat (Calcit), Silicat, Sulfat (Gips), Phosphat (Apatit) und Fluorid (Fluorit) zu finden |
| Scandium | Sc | 21 | 1.0e1 | 5.1e0 (50.) | 2.2e1 | 6.0e-7 | selten, ein Scandium-Mineral ist Thortveitit |
| Titan | Ti | 22 | 7.6e2 | 4.1e3 (10.) | 5.7e3 | 1.0e-3 | häufig, vor allem als Rutil und Ilmenit zu finden |
| Vanadium | V | 23 | 9.3e1 | 4.1e2 (16.) | 1.2e2 | 2.5e-3 | seltene Minerale sind u. a. Vanadinit und Patrónit, vor allem als Beimischung in anderen Erzen |
| Chrom | Cr | 24 | 4.2e3 | 1.9e2 (21.) | 1.0e2 | 3.0e-4 | häufigstes Mineral ist Chromit, Einzelfunde gediegenen Chroms sind bekannt |
| Mangan | Mn | 25 | 1.4e3 | 8.5e2 (14.) | 9.5e2 | 2.0e-4 | häufig in Oxiden wie Braunsteinen, Manganknollen in der Tiefsee |
| Eisen | Fe | 26 | 2.9e5 | 4.7e4 (4.) | 5.6e4 | 2.0e-3 | der Erdkern besteht großteils aus Eisen, in der Erdkruste v. a. oxidische und sulfidische Minerale, selten auch gediegen |
| Cobalt | Co | 27 | 8.0e2 | 3.7e1 (29.) | 2.5e1 | 2.0e-5 | gediegen in Meteoriten und Erdkern, gebunden vor allem in Sulfid- und Arsenidmineralen wie Smaltit oder Cobaltit |
| Nickel | Ni | 28 | 1.7e4 | 1.5e2 (22.) | 8.4e1 | 5.6e-4 | gediegen in Meteoriten und Erdkern, gebunden vor allem in Sulfid- und Arsenidmineralen wie Millerit oder Nickelin |
| Kupfer | Cu | 29 | 6.5e1 | 1.0e2 (25.) | 6.0e1 | 2.5e-4 | auch gediegen, sulfidische und oxidische Minerale wie Chalkopyrit und Cuprit |
| Zink | Zn | 30 | 2.4e1 | 1.2e2 (24.) | 7.0e1 | 4.9e-3 | Vorkommen vor allem als Sphalerit, Wurtzit und Smithsonit |
| Gallium | Ga | 31 | 3.1e0 | 1.4e1 (38.) | 1.9e1 | 3.0e-5 | selten, vergesellschaftet mit Zink, Aluminium oder Germanium |
| Germanium | Ge | 32 | 7.3e0 | 5.6e0 (46.) | 1.5e0 | 5.0e-5 | selten, vor allem in sulfidischen Mineralen |
| Arsen | As | 33 | 1.1e0 | 5.5e0 (47.) | 1.8e0 | 3.7e-3 | selten gediegen, gebunden in Arseniden, Arsenchalcogeniden wie Realgar und Arsenaten |
| Selen | Se | 34 | 2.5e0 | 8.0e-1 (59.) | 5.0e-2 | 2.0e-4 | Selenide kommen selten in sulfidischen Erzen vor |
| Brom | Br | 35 | 4.0e-1 | 6.0e0 (43.) | 2.4e0 | 6.73e1 | als Bromid meist zusammen mit Chlorid, auch im Meerwasser und Salzseen enthalten |
| Krypton | Kr | 36 | 1.9e-5 (82.) | 1.0e-4 | 2.1e-4 | seltener Bestandteil der Atmosphäre | |
| Rubidium | Rb | 37 | 6.0e-1 | 2.9e1 (31.) | 9.0e1 | 1.2e-1 | in geringen Mengen in anderen Alkalimetallerzen enthalten |
| Strontium | Sr | 38 | 1.4e1 | 1.4e2 (23.) | 3.7e2 | 7.9e0 | als Sulfat (Coelestin) und Carbonat (Strontianit) zu finden |
| Yttrium | Y | 39 | 2.4e0 | 2.6e1 (32.) | 3.3e1 | 1.3e-5 | vergesellschaftet mit den schwereren Lanthanoiden bspw. in Gadolinit |
| Zirconium | Zr | 40 | 6.8e0 | 2.1e2 (20.) | 1.7e2 | 3.0e-5 | häufigstes Mineral ist Zirkon, seltener Baddeleyit |
| Niob | Nb | 41 | 4.7e-1 | 1.9e1 (34.) | 2.0e1 | 1.0e-5 | vergesellschaftet mit Tantal vor allem in Mineralen der Columbit- und Tapiolit-Reihe |
| Molybdän | Mo | 42 | 1.7e0 | 1.4e1 (39.) | 1.2e0 | 1.0e-2 | häufigstes Vorkommen als Molybdänit, seltener als Wulfenit oder Powellit |
| Technetium | Tc | 43 | 1.2e-15 (91.) | äußerst selten als kurzlebiges Spaltprodukt von Uran | |||
| Ruthenium | Ru | 44 | 1.8e-1 | 2.0e-2 (71.) | 1.0e-3 | 7.0e-7 | selten, kommt gediegen vor, vergesellschaftet mit anderen Platinmetallen |
| Rhodium | Rh | 45 | 2.3e-1 | 1.0e-3 (79.) | 1.0e-3 | selten, kommt gediegen vor, vergesellschaftet mit anderen Platinmetallen | |
| Palladium | Pd | 46 | 8.8e-1 | 1.1e-2 (72.) | 1.5e-2 | gediegen, in Sulfiden gebunden, mit den anderen Platinmetallen | |
| Silber | Ag | 47 | 4.6e-2 | 1.2e-1 (67.) | 7.5e-2 | 4.0e-5 | gediegen, in sulfidischen Erzen wie Argentit, selten auch als Halogenid (Chlorargyrit) |
| Cadmium | Cd | 48 | 1.8e-1 | 3.0e-1 (63.) | 1.5e-1 | 1.1e-4 | vergesellschaftet mit Zinkerzen als Greenockit und Otavit |
| Indium | In | 49 | 9.4e-3 | 1.0e-1 (68.) | 2.5e-1 | 2.0e-2 | selten, vergesellschaftet mit Zink |
| Zinn | Sn | 50 | 3.9e-1 | 3.5e1 (30.) | 2.3e0 | 4.0e-6 | selten gediegen, häufigstes Mineral ist Kassiterit |
| Antimon | Sb | 51 | 4.0e-2 | 6.5e-1 (61.) | 2.0e-1 | 2.4e-4 | selten gediegen, gebunden in Antimoniden und Antimonchalcogeniden wie Stibnit |
| Tellur | Te | 52 | 3.1e-1 | 1.0e-2 (73.) | 1.0e-3 | selten, auch elementar, sonst als Tellurid | |
| Iod | I | 53 | 4.0e-2 | 6.0e-2 (70.) | 4.5e-1 | 6.0e-2 | als Iodid und Iodat, u. a. als Lautarit in Chilesalpeter |
| Xenon | Xe | 54 | 9.0e-6 (83.) | 3.0e-5 | 5.0e-5 | seltener Bestandteil der Atmosphäre | |
| Caesium | Cs | 55 | 4.1e-2 | 6.5e0 (42.) | 3.0e0 | 3.0e-4 | in geringen Mengen in anderen Alkalimetallerzen enthalten |
| Barium | Ba | 56 | 4.1e0 | 2.6e2 (19.) | 4.3e2 | 1.3e-2 | häufigstes Mineral ist das Sulfat Baryt, auch als Carbonat (Witherit) |
| Lanthan | La | 57 | 4.2e-1 | 1.7e1 (36.) | 3.9e1 | 3.4e-6 | mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit |
| Cer | Ce | 58 | 1.1e0 | 4.3e1 (28.) | 6.6e1 | 1.2e-6 | mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit |
| Praseodym | Pr | 59 | 1.7e-1 | 5.2e0 (49.) | 9.2e0 | 6.4e-7 | mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit |
| Neodym | Nd | 60 | 8.1e-1 | 2.2e1 (33.) | 4.2e1 | 2.8e-6 | mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit |
| Promethium | Pm | 61 | 1.5e-15 (90.) | äußerst selten als kurzlebiges Spaltprodukt | |||
| Samarium | Sm | 62 | 2.6e-1 | 6.0e0 (44.) | 7.5e0 | 4.5e-7 | mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit |
| Europium | Eu | 63 | 9.8e-2 | 9.9e-2 (69.) | 2.0e0 | 1.3e-7 | mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit |
| Gadolinium | Gd | 64 | 3.5e-1 | 5.9e0 (45.) | 6.2e0 | 7.0e-7 | mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit |
| Terbium | Tb | 65 | 6.7e-2 | 8.5e-1 (58.) | 1.2e0 | 1.4e-7 | mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit |
| Dysprosium | Dy | 66 | 4.2e-1 | 4.3e0 (51.) | 5.2e0 | 9.1e-7 | mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit |
| Holmium | Ho | 67 | 9.6e-2 | 1.1e0 (57.) | 1.3e0 | 2.2e-7 | mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit |
| Erbium | Er | 68 | 2.8e-1 | 2.3e0 (56.) | 3.5e0 | 8.7e-7 | mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit |
| Thulium | Tm | 69 | 4.2e-2 | 1.9e-1 (66.) | 5.2e-1 | 1.7e-7 | mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit |
| Ytterbium | Yb | 70 | 2.8e-1 | 2.5e0 (55.) | 3.2e0 | 8.2e-7 | mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit |
| Lutetium | Lu | 71 | 4.3e-2 | 7.0e-1 (60.) | 8.0e-1 | 1.5e-7 | mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit |
| Hafnium | Hf | 72 | 2.0e-1 | 4.2e0 (52.) | 3.0e0 | 7.0e-6 | praktisch nur als Bestandteil von Zirconium-Mineralen zu finden, einzige bekannte Ausnahme ist das Hafniumsilikat Hafnon |
| Tantal | Ta | 73 | 2.8e-2 | 8.0e0 (41.) | 2.0e0 | 2.0e-6 | vergesellschaftet mit Niob vor allem in Mineralen der Columbit- und Tapiolit-Reihe |
| Wolfram | W | 74 | 1.7e-1 | 6.4e1 (26.) | 1.3e0 | 1.0e-4 | überwiegend als Wolframat oder Oxid, bsp. als Wolframit oder Scheelit |
| Rhenium | Re | 75 | 6.3e-2 | 1.0e-3 (80.) | 7.0e-4 | 4.0e-6 | selten, vorwiegend in Molybdän-Erzen |
| Osmium | Os | 76 | 8.2e-1 | 1.0e-2 (74.) | 1.5e-3 | selten, kommt gediegen vor, vergesellschaftet mit anderen Platinmetallen | |
| Iridium | Ir | 77 | 7.7e-1 | 1.0e-3 (81.) | 1.0e-3 | selten, kommt gediegen vor, vergesellschaftet mit anderen Platinmetallen | |
| Platin | Pt | 78 | 1.6e0 | 5.0e-3 (76.) | 5.0e-3 | häufigstes Platinmetall, vergesellschaftet mit den anderen Platinmetallen | |
| Gold | Au | 79 | 1.0e-1 | 5.0e-3 (77.) | 4.0e-3 | 4.0e-6 | überwiegend gediegen, selten auch als Tellurid |
| Quecksilber | Hg | 80 | 2.0e-2 | 4.0e-1 (62.) | 8.5e-2 | 3.0e-5 | vorwiegend als Sulfid in Zinnober, seltener auch gediegen in Form von Tröpfchen |
| Thallium | Tl | 81 | 4.0e-3 | 2.9e-1 (64.) | 8.5e-1 | 1.9e-5 | in Mineralen wie Avicennit, vergesellschaftet mit Blei, Rubidium, Zink oder Eisen |
| Blei | Pb | 82 | 6.7e-1 | 1.8e1 (35.) | 1.4e1 | 3.0e-5 | selten gediegen, häufigstes Mineral ist Galenit |
| Bismut | Bi | 83 | 1.6e-2 | 2.0e-1 (65.) | 8.5e-3 | 2.0e-5 | elementar, in Oxiden wie Bismit und Sulfiden wie Bismutin |
| Polonium | Po | 84 | 2.1e-11 (87.) | 2.0e-10 | 1.5e-14 | sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen | |
| Astat | At | 85 | 3.0e-21 (94.) | sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen | |||
| Radon | Rn | 86 | 6.1e-11 (86.) | 4.0e-13 | 6.0e-16 | sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen | |
| Francium | Fr | 87 | 1.3e-18 (93.) | sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen | |||
| Radium | Ra | 88 | 9.5e-11 (85.) | 9.0e-7 | 8.9e-11 | sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen | |
| Actinium | Ac | 89 | 6.1e-14 (88.) | 5.5e-9 | sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen | ||
| Thorium | Th | 90 | 5.1e-2 | 1.1e1 (40.) | 9.6e0 | 1.0e-6 | radioaktiv, vergesellschaftet mit den Lanthanoiden, vor allem in Monazit |
| Protactinium | Pa | 91 | 9.0e-8 (84.) | 1.4e-6 | 5.0e-11 | sehr seltenes Zwischenprodukt beim Zerfall von Uran | |
| Uran | U | 92 | 1.4e-2 | 3.2e0 (54.) | 2.7e0 | 3.2e-3 | radioaktiv, wichtigstes Mineral ist Uraninit |
| Neptunium | Np | 93 | 4.0e-14 (89.) | sehr seltenes Zwischenprodukt beim Zerfall von Uran | |||
| Plutonium | Pu | 94 | 2.0e-16 (92.) | geringe Mengen des langlebigsten Isotops 244Pu finden sich in manchen Uranerzen | |||
Zusammensetzung des menschlichen Körpers (70 kg)
| Element (36 Stück) |
Sym- bol |
Ord- nungs- zahl |
Masse in g[5] (Rang) |
Masse in % | Stoff- menge in mol |
essentiell ? | Bemerkungen |
|---|---|---|---|---|---|---|---|
| Sauerstoff | O | 8 | 43000 (1.) | ca. 61.4 | 2.7e3 | ja | vor allem als Wasser gebunden. Bestandteil vieler organischer Verbindungen |
| Kohlenstoff | C | 6 | 16000 (2.) | ca. 22.9 | 1.3e3 | ja | Grundlage aller organischen Verbindungen des Körpers |
| Wasserstoff | H | 1 | 7000 (3.) | ca. 10 | 6.9e3 | ja | Häufigstes Element, vor allem als Wasser gebunden. Bestandteil vieler organischer Verbindungen |
| Stickstoff | N | 7 | 1800 (4.) | ca. 2.6 | 1.3e2 | ja | Bestandteil vieler organischer Verbindungen |
| Calcium | Ca | 20 | 1200 (5.) | ca. 1.7 | 3.0e1 | ja | Knochenaufbau und Modifikation der Synapsenaktivität |
| Phosphor | P | 15 | 780 (6.) | ca. 1.1 | 2.5e1 | ja | als Phosphat; Bestandteil der DNA, Energiestoffwechsel, als Knochenbildner Hydroxylapatit |
| Schwefel | S | 16 | 140 (7.) | ca. 0.20 | 4.4e0 | ja | in den Aminosäuren Cystein und Methionin enthalten |
| Kalium | K | 19 | 125 (8.) | ca. 0.18 | 3.2e0 | ja | wichtig für das Membranpotential inner- und außerhalb der Zellen |
| Natrium | Na | 11 | 100 (9.) | ca. 0.14 | 4.3e0 | ja | wichtig für das Membranpotential inner- und außerhalb der Zellen und Impulsübertragung in Nervenfasern |
| Chlor | Cl | 17 | 95 (10.) | ca. 0.13 | 2.7e0 | ja | Als Chlorid Bestandteil der Magensäure und Regulation des Wasserhaushalts |
| Magnesium | Mg | 12 | 25 (11.) | ca. 0.036 | 1.0e0 | ja | Bestandteil verschiedener Enzyme |
| Fluor | F | 9 | 5 (12.) | ca. 0.007 | 2.6e-1 | nein | als Fluorapatit im Zahnschmelz und in Knochen enthalten |
| Eisen | Fe | 26 | 4 (13.) | – | 7.2e-2 | ja | Bestandteil vieler Enzyme und des Hämoglobins |
| Zink | Zn | 30 | 2,3 (14.) | – | 3.5e-2 | ja | Bestandteil vieler Enzyme |
| Silicium | Si | 14 | 1 (15.) | – | 3.6e-2 | ja | in Spuren als Silicat in Knochen |
| Titan | Ti | 22 | 0,70 (16.) | – | 1.5e-2 | nein | keine bekannten biologischen Funktionen |
| Rubidium | Rb | 37 | 0,68 (17.) | – | 8.0e-3 | nicht eindeutig | wegen Ähnlichkeit zu Kalium im Körper enthalten |
| Strontium | Sr | 38 | 0,32 (18.) | – | 3.7e-3 | nein | wegen Ähnlichkeit zu Calcium im Körper enthalten |
| Brom | Br | 35 | 0,26 (19.) | – | 3.3e-3 | nein | Bromid wegen Ähnlichkeit zu Chlorid im Körper enthalten |
| Blei | Pb | 82 | 0,12 (20.) | – | 5.8e-4 | nicht eindeutig | giftig, kann in Knochen bei Verdrängung von Calcium gespeichert werden |
| Kupfer | Cu | 29 | 0,07 (21.) | – | 1.1e-3 | ja | Bestandteil verschiedener Enzyme, v. a. Oxidasen, Ähnlichkeit zu Eisen |
| Aluminium | Al | 13 | 0,06 (22.) | – | 2.2e-3 | nein | Keine biologische Funktion bekannt |
| Cer | Ce | 58 | 0,04 (23.) | – | 2.9e-4 | nein | keine bekannten biologischen Funktionen |
| Zinn | Sn | 50 | 0,03 (24.) | – | 2.5e-4 | nicht eindeutig | keine genaue Funktion bekannt |
| Barium | Ba | 56 | 0,02 (25.) | – | 1.5e-4 | nein | wegen Ähnlichkeit zu Calcium im Körper enthalten |
| Cadmium | Cd | 48 | 0,02 (26.) | – | 1.8e-4 | nicht eindeutig | kann teilweise Zink verdrängen |
| Bor | B | 5 | 0,018 (27.) | – | 1.7e-3 | nicht eindeutig | essentielles Element für manche Pflanzen |
| Nickel | Ni | 28 | 0,015 (28.) | – | 2.6e-4 | ja | Bestandteil von Enzymen |
| Iod | I | 53 | 0,015 (29.) | – | 1.2e-4 | ja | in Schilddrüsenhormonen enthalten |
| Selen | Se | 34 | 0,014 (30.) | – | 1.8e-4 | ja | in der Aminosäure Selenocystein enthalten |
| Mangan | Mn | 25 | 0,012 (31.) | – | 2.2e-4 | ja | Bestandteil verschiedener Enzyme, in Pflanzen wichtig für die Photosynthese |
| Arsen | As | 33 | 0,007 (32.) | – | 9.3e-5 | nicht eindeutig | biologische Bedeutung geringer Arsenmengen nicht genau bekannt, in höheren Dosen toxisch |
| Lithium | Li | 3 | 0,007 (33.) | – | 1.0e-3 | nein | wegen Ähnlichkeit zu Natrium im Körper enthalten |
| Molybdän | Mo | 42 | 0,005 (34.) | – | 5.2e-5 | ja | Bestandteil von Enzymen wie der Xanthinoxidase |
| Chrom | Cr | 24 | 0,002 (35.) | – | 2.8e-5 | ja | als dreiwertiges Chrom möglicherweise am Fettstoffwechsel beteiligt |
| Cobalt | Co | 27 | 0,002 (36.) | – | 3.4e-5 | ja | im Vitamin B12 enthalten |
Literatur
- H. Binder: Lexikon der chemischen Elemente – Das Periodensystem in Fakten, Zahlen und Daten. Hirzel Verlag, Stuttgart/ Leipzig 1999, ISBN 3-7776-0736-3.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
Einzelnachweise
- A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews. 15, 1973, S. 121–146.
- Claude Allègre, Gérard Manhès, Éric Lewin: Chemical composition of the Earth and the volatility control on planetary genetics. In: Earth and Planetary Science Letters. Band 185, Nr. 1-2, 2001, S. 49–69, doi:10.1016/S0012-821X(00)00359-9.
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag 1999, ISBN 3-7776-0736-3.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 85. Auflage. CRC Press, Boca Raton, Florida, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth’s Crust and in the Sea.
- Wolfgang Kaim, Brigitte Schwederski: Bioanorganische Chemie. 4. Auflage. Teubner, 2005, ISBN 3-519-33505-0.