Chloride
Chloride sind Verbindungen des chemischen Elementes Chlor. Dieses kann mit Metallen, Halb- oder Nichtmetallen verbunden vorliegen. Metallchloride wie z. B. Natrium- und Cobalt(II)-chlorid sind Salze der Chlorwasserstoffsäure, besser bekannt als Salzsäure (chemische Formel: HCl). Ein solches Chlorid enthält in seinem Ionengitter einfach negativ geladene Chlor(−I)-Ionen Cl− (meist Chlorid-Ionen genannt). Nichtmetallchloride wie Chlorwasserstoff, Schwefelchloride, Kohlenstofftetrachlorid (Tetrachlormethan) und Chlordioxid sind als molekulare Verbindungen wesentlich flüchtiger als salzartige Chloride. Chlorhaltige Kohlenwasserstoffe werden in der Organik als Derivate der verschiedensten Verbindungen der Kohlenwasserstoffe betrachtet und benannt. So wird Methan, bei dem ein Wasserstoffatom gegen ein Chloratom ausgetauscht (substituiert) wurde, Chlormethan bzw. Methylchlorid genannt. Hier liegt jedoch nicht wie bei den oben angesprochenen ionischen Verbindungen Chlor als Chloridion vor, sondern ist kovalent mit dem Kohlenstoffatom verbunden. Chlorid ist im eigentlichen Sinne jedoch nur die Kurzbezeichnung für das einfach negativ geladene Chloridion. Organische Amine bilden mit Chlorwasserstoff organische Hydrochloride, die Chloridionen enthalten.
Vorkommen
Chloride kommen in der Natur in großen Lagerstätten vor, z. B. Natriumchlorid als Steinsalz oder Halit, Kaliumchlorid als Sylvin, Carnallit, Kainit und Sylvinit, Magnesiumchlorid als Bischofit. Der größte Anteil der Chloride kommt gelöst im Meerwasser und in großen unterirdischen Salzlagern vor, die durch das Verdunsten des Wassers urzeitlicher Weltmeere entstanden sind.
Nachweis
Zum nasschemischen qualitativen Nachweis von Chlorid wird zunächst eine Lösung hergestellt. Vorteilhaft ist der Sodaauszug, da in dessen Filtrat zahlreiche störende Kationen abgetrennt werden. Danach können Halogenidnachweise durchgeführt werden. Chloride werden mit Silbernitrat-Lösung als weißes, wasserunlösliches Silberchlorid gefällt.
Der quantitative Nachweis kann mit Titrationsverfahren für Halogenide erfolgen.
Eigenschaften
Anorganische Chloride
Chloride sind farblose oder farbige Salze, die in unterschiedlichsten Kristallstrukturen vorkommen können. Sie haben sehr hohe Schmelz- und Siedepunkte.
Als Schmelzen oder in Lösung leiten sie den elektrischen Strom. Chloride lösen sich in protischen und polaren Lösungsmitteln.
Entstehung
Anorganische Chloride
Chloride entstehen bei der Redoxreaktion von Metallen mit elementarem Chlor oder mit Salzsäure nur, wenn sie in der Spannungsreihe unterhalb des Wasserstoffes stehen, da Salzsäure nicht oxidierend wirkt. Sie entstehen aber auch bei der Reaktion von Hydroxiden, Metalloxiden, Carbonaten, Hydrogencarbonaten und allgemein von Salzen schwächerer Säuren mit Salzsäure.
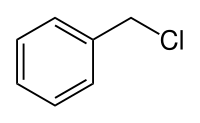
Organische Chloride
Durch Substitutions- und Additionsreaktionen an Kohlenwasserstoffen sowie Carbonsäuren und ihren Derivaten können Chloride gewonnen werden. Es gibt organische Chloride, in denen das Chlor als Chlorid-Ion vorliegt, z. B. in den Hydrochloriden und den N-Acyliminiumchloriden.
In den Carbonsäurechloriden ist ein Chloratom über eine stark polarisierte kovalente Bindung an einen Acylrest gebunden. In den Chloralkanen – traditionelle Bezeichnung: Alkylchloride – ist das jeweilige Chloratom über eine geringer polarisierte kovalente Bindung an ein Kohlenstoffatome gebunden. Die Bezeichnung dieser nicht salzartigen organischen Verbindungen als „Chlorid“ ist fragwürdig, aber dennoch üblich.
Verwendung und Beispiele

-chlorid.JPG.webp)
Bekanntestes Beispiel für ein Chlorid ist das Natriumchlorid (chemische Formel: NaCl), besser bekannt als Koch- und Speisesalz. Es dient als Würzmittel und zum Konservieren.
Weitere wichtige Chloride sind:
- Lithiumchlorid – LiCl
- Kaliumchlorid – KCl
- Caesiumchlorid – CsCl
- Magnesiumchlorid – MgCl2
- Calciumchlorid – CaCl2
- Blei(II)-chlorid – PbCl2
- Eisen(II)-chlorid – FeCl2
- Eisen(III)-chlorid – FeCl3
- Silberchlorid – AgCl
- Zinkchlorid – ZnCl2
- Quecksilber(I)-chlorid – Hg2Cl2
- Quecksilber(II)-chlorid – HgCl2
- Ammoniumchlorid – NH4Cl
- Bariumchlorid – BaCl2
- Aluminiumchlorid – AlCl3
- Dibortetrachlorid – B2Cl4
Sehr viele Chloride dieser Salze bilden Hydrate.
Beispiele für organische Chloride mit kovalenter Kohlenstoff-Chlor-Bindung:
- Methylenchlorid (bessere Benennung: Dichlormethan) – CH2Cl2
- Allylchlorid – CH2=CHCH2Cl
- Benzylchlorid – C6H5CH2Cl
Siehe auch
- Weitere Halogenide: Fluoride, Bromide, Iodide
- Weitere Salze chlorhaltiger Oxosäuren: Hypochlorite, Chlorit, Chlorate, Perchlorate
- Elektrophile Substitution, Nukleophile Substitution, Elektrophile Addition, Nukleophile Addition
_chloride.jpg.webp)

.jpg.webp)