Wasser
Wasser (lateinisch Aqua) ist insbesondere die chemische Verbindung H2O, bestehend aus den Elementen Sauerstoff (O) und Wasserstoff (H).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Wasser | ||||||||||||||||||
| Summenformel | H2O | ||||||||||||||||||
| Kurzbeschreibung |
klare, farb- und geruchlose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 18,02 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,998 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Dipolmoment |
6,18·10−30 C·m[3] | ||||||||||||||||||
| Brechungsindex |
1,333[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−285,83 kJ·mol−1[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||


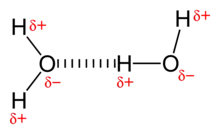

Die Bezeichnung Wasser wird dabei für den flüssigen Aggregatzustand verwendet. Im festen Zustand spricht man von Eis, im gasförmigen Zustand von Wasserdampf. In der Natur kommt Wasser selten rein vor, sondern enthält meist gelöste Anteile von Salzen, Gasen und organischen Verbindungen.
Ohne Wasser kein Leben auf der Erde. Biologische Vorgänge laufen nur dank Wasser ab. Der Mensch als biologisches Wesen (Wasseranteil 70 %) nutzt das Wasser zur Sicherung seines eigenen Überlebens und für seine kulturelle und wirtschaftliche Entwicklung. Da Wasser als einziger natürlicher Stoff auf der Erde im festen, flüssigen und gasförmigen Zustand vorkommt, prägt es von geologischen Prozessen innert Jahrmillionen bis zu Wetterphänomenen im Minutentakt die unbelebte Natur. Es gilt als eine der naturwissenschaftlich am besten untersuchten chemischen Verbindungen.
Wasser besitzt eine herausragende kulturelle Bedeutung in allen Zivilisationen und hat für zahlreiche Zivilisationen eine religiöse Bedeutung erlangt.
Bezeichnungen
Etymologie
Das deutsche Wort Wasser (mittelhochdeutsch wazzer, althochdeutsch wazzar) ist urverwandt mit indogermanisch *wódr̥ und *wédōr, das bereits in hethitischen Texten des 2. Jahrtausends v. Chr. (etwa als watar) belegt ist. Das Wort gehört zur indogermanischen Wurzel *wēd oder *wŏd, vgl. englisch wet, „feucht“.[6]
Verwandte Wörter finden sich in den meisten indogermanischen Sprachen, z. B.
- Germanisch: niederdeutsch, niederländisch und englisch water; isländisch vatn
- Keltisch: schottisch uisge (vgl. Whiskey); irisch uisce
- Slawisch: russisch вода (woda, vgl. Wodka); polnisch woda; obersorbisch woda
- Baltisch: litautisch vanduo; lettisch ūdens
Auch das altgriechische Wort für „Wasser“, ὕδωρ hydor, von dem sich alle Fremdwörter mit dem Wortbestandteil hydr(o)- ableiten, gehört zu dieser Familie.
Alternative chemische Bezeichnungen
Andere – nach der chemischen Nomenklatur zulässige – Bezeichnungen für Wasser sind:
- Wasserstoffoxid: Es existieren allerdings noch weitere Oxide des Wasserstoffs (siehe Wasserstoffoxide).
- Diwasserstoffmonoxid, Wasserstoffhydroxid, Dihydrogeniumoxid, Hydrogeniumoxid, Hydrogeniumhydroxid, Oxan, Oxidan (IUPAC) oder Dihydrogenmonoxid (DHMO).
Eigenschaften von Wasser
mit allen chemischen und physikalischen Daten in der Infobox, Verwendung als Chemikalie und Dichteanomalie des Wassers.
Wasser (H2O) ist eine chemische Verbindung aus den Elementen Sauerstoff (O) und Wasserstoff (H). Wasser ist als Flüssigkeit durchsichtig, weitgehend farb-, geruch- und geschmacklos. Es kommt in zwei Isomeren (para- und ortho-Wasser) vor, die sich im Kernspin der beiden Wasserstoffatome unterscheiden.
Wassermolekül


Wasser besteht aus Molekülen, gebildet aus je zwei Wasserstoffatomen und einem Sauerstoffatom.
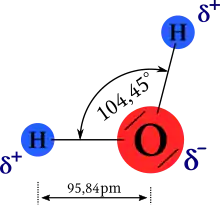
Sauerstoff hat auf der Pauling-Skala mit 3,5 eine höhere Elektronegativität als Wasserstoff mit 2,1. Das Wassermolekül weist dadurch ausgeprägte Partialladungen auf, mit einer negativen Polarität auf der Seite des Sauerstoffs und einer positiven auf der Seite der beiden Wasserstoffatome. Es resultiert ein Dipol, dessen Dipolmoment in der Gasphase 1,84 Debye beträgt.
Tritt Wasser als Ligand in einer Komplex-Bindung auf, so ist Wasser ein einzähniger Ligand.
Geometrisch ist das Wassermolekül gewinkelt, wobei die beiden Wasserstoffatome und die beiden Elektronenpaare in die Ecken eines gedachten Tetraeders gerichtet sind. Der Winkel, den die beiden O-H-Bindungen einschließen, beträgt 104,45°. Er weicht aufgrund des erhöhten Platzbedarfs der freien Elektronenpaare vom idealen Tetraederwinkel (~109,47°) ab. Die Bindungslänge der O-H-Bindungen beträgt jeweils 95,84 pm.
Wassermoleküle kommen wegen des Kernspins der Wasserstoffatome in zwei Isomeren (para- und ortho-Wasser) mit fast identischen physikalischen Eigenschaften vor. Es ist möglich, die beiden Formen zu trennen und die unterschiedliche chemischen Reaktivitäten zu untersuchen.[7][8]
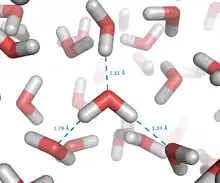
Weil Wassermoleküle Dipole sind, besitzen sie ausgeprägte zwischenmolekulare Anziehungskräfte und können sich durch Wasserstoffbrückenbindung zu Clustern zusammenlagern. Dabei handelt es sich nicht um beständige, feste Verkettungen. Der Verbund über Wasserstoffbrückenbindungen besteht nur für Bruchteile von Sekunden, wonach sich die einzelnen Moleküle wieder aus dem Verbund lösen und sich in einem ebenso kurzen Zeitraum erneut – mit anderen Wassermolekülen – verketten. Dieser Vorgang wiederholt sich ständig und führt letztendlich zur Ausbildung von variablen Clustern. Diese Vorgänge bewirken die besonderen Eigenschaften des Wassers:
Wasser hat
- eine Dichte von rund 1000 kg/m³ (ursprünglich die Definition des Kilogramms), genauer: 999,975 kg/m³ bei 3,98 °C. Als Dichteanomalie bezeichnet man die auf der Wasserstoffbrückenbindung beruhende Eigenschaft, dass Wasser bei dieser Temperatur die höchste Dichte hat und beim Abkühlen unter diese Temperatur kontinuierlich und beim Gefrieren sogar sprunghaft an Volumen zunimmt, also an Dichte verliert, so dass Eis auf Wasser schwimmt,
- eine Viskosität von 1,0019 mPa·s (0,010019 Poise) bei 20 °C[9],
- eine der höchsten spezifischen Wärmekapazitäten von Flüssigkeiten bei Raumtemperatur (75,366 J·mol−1·K−1 entsprechend 4,18 kJ·kg−1·K−1 bei 20 °C[10]),
- eine der größten Oberflächenspannungen aller Flüssigkeiten (Quecksilber hat allerdings eine noch größere); bei Wasser beträgt sie in feuchter Luft 72 mN/m bei +20 °C, so dass die Tröpfchenbildung erleichtert wird,
- eine der größten spezifischen Verdampfungsenthalpien aller Flüssigkeiten (44,2 kJ/mol entsprechend 2453 kJ/kg bei 20 °C; daher rührt der kühlende Effekt bei der Transpiration) sowie eine hohe Schmelzenthalpie (6,01 kJ/mol entsprechend 333 kJ/kg; so dass Salzwasser eine nur geringe Gefrierpunktserniedrigung im Vergleich zu reinem Wasser zeigt),
- eine geringe Wärmeleitfähigkeit (0,6 W/(m K) bei 20 °C).
Je nach Isotopenzusammensetzung des Wassermoleküls unterscheidet man normales „leichtes Wasser“ (zwei Atome Wasserstoff: H2O), „Halbschweres Wasser“ (ein Atom Wasserstoff und ein Atom Deuterium: HDO), „schweres Wasser“ (zwei Atome Deuterium: D2O) und „überschweres Wasser“ (zwei Atome Tritium: T2O), wobei mit HTO und DTO noch weitere Moleküle mit gemischten Isotopen vorkommen.
Wasser kann unter Hochspannung eine Wasserbrücke zwischen zwei Glasgefäßen ausbilden.[11]
Synthese, Elektrolyse und chemische Verwendung
Wasser als chemische Verbindung wurde zum ersten Mal synthetisiert, als Henry Cavendish im 18. Jahrhundert ein Gemisch aus Wasserstoff und Luft zur Explosion brachte (siehe Knallgas-Reaktion).
Wasserstoff gilt als Energieträger der Zukunft.[12]
Wasserstoff ist, wie auch elektrische Energie, keine Primärenergie, sondern muss, analog zur Stromerzeugung, aus Primärenergie hergestellt werden.
Zur Demonstration wird Wasser im Hofmannschen Wasserzersetzungsapparat in seine Bestandteile zerlegt. Reaktionsschema:
Nachweis
Nachweisreaktion: Wasser färbt weißes, kristallwasserfreies Kupfersulfat hellblau, und blaues Cobalt(II)-chloridpapier wird durch Wasser rot gefärbt.
In der Analytik wird Wasser in Kleinmengen (Feuchte bzw. Trockenheit) überwiegend quantifiziert mittels Karl-Fischer-Titration (nach Karl Fischer). Monographien in Pharmakopoen zum quantitativen Nachweis von Wasser beruhen überwiegend auf der Karl-Fischer-Titration.
Entstehung der Bläschen im siedenden Wasser
Wärmeeinwirkung verursacht eine schnellere Bewegung der Wassermoleküle. Werden an der Stelle der Wärmeeinwirkung 100 °C erreicht, geht es dort (je nach Keim mit mehr oder weniger Siedeverzug) vom flüssigen in den gasförmigen Aggregatzustand (Dampf) über, dessen Volumen um etwa das 1600-fache höher ist (siehe Wasserdampf) und der infolge seiner im Verhältnis zum umgebenden Wasser geringeren Dichte als mehr oder weniger große Blasen aufsteigt: Das Wasser beginnt zu sieden, wobei die Dampfblasen von Schichten noch nicht so heißen Wassers abgekühlt werden und wieder zu flüssigem Wasser kondensieren. Erreicht schließlich die gesamte Wassermenge die Temperatur von 100 °C, so gelangen die nun großen Dampfblasen bis an die Oberfläche: Das Wasser kocht.
Druck und Temperatur sind die bestimmenden Faktoren für die Löslichkeit von Gasen im Wasser. Gasbläschen, die bereits bei geringfügiger Erwärmung sichtbar werden, bestehen nicht aus Wasserdampf, sondern aus gelösten Gasen. Ursache ist die geringere Wasserlöslichkeit von Gasen bei Erwärmung. Wasser, das sich eine Zeit lang in einer unter Druck stehenden Leitung oder Flasche befunden hat, hat oft einen Überschuss an Gasen gelöst. Daher reicht schon das Wegnehmen des äußeren Drucks, dass sich – bevorzugt an Keimen an der Wandung – Gasblasen ausscheiden und bis zu einer Größe von 1–2 mm auch haften bleiben.
Wasser und Mensch
Geschichte der Wassernutzung

Die Geschichte der menschlichen Nutzung des Wassers und somit jene der Hydrologie, der Wasserwirtschaft und besonders des Wasserbaus, ist durch eine vergleichsweise geringe Zahl von Grundmotiven geprägt. Von den ersten sesshaft werdenden Menschen zu den Hochkulturen der Antike über das Mittelalter bis zur Neuzeit stand im Zentrum immer ein Konflikt zwischen einem Zuviel und einem Zuwenig an Wasser. Ihm war man dabei fast immer ausgeliefert, ob durch Dürren die Ernte einging oder Hochwasser Leben und Besitz bedrohte. Es wurde auch zum Gegenstand der Mythologie und der Naturphilosophie. Noch heute kommt dem Wasser in den meisten Religionen der Welt eine Sonderstellung zu, besonders dort, wo die Frage des Überlebens von der Lösung der zahlreichen Wasserprobleme abhängt.
Ziel war es, allen Nutzungsansprüchen gerecht zu werden und dabei jedem Menschen den ihm zustehenden Teil des Wassers zu garantieren. Hierbei diente das Wasserrecht als eine der ersten Rechtsformen zur Mitbegründung der ersten zentralistischen Zivilisationen Mesopotamiens und Ägyptens sowie jener, die in den Flusstälern Chinas und Indiens entstanden.
Die lange Geschichte der Wassernutzung zeigt sich dabei, wie die Menschheitsgeschichte insgesamt, nicht als ein kontinuierlicher Entwicklungspfad. Sie wurde vor allem durch einzelne Zentren hohen wasserwirtschaftlichen Standards sowie durch immer wiederkehrende Brüche geprägt, neben oft jahrhundertelang währenden Stagnationsphasen. So beeindruckend die frühen wasserbaulichen Anlagen dabei auch waren, wie groß sich Innovationskraft und Kreativität unserer Vorfahren auch zeigten, letztlich war und ist man auch heute noch abhängig von der Natur, die man jedoch erst in vergleichsweise jüngster Zeit anfing wirklich zu verstehen.
Wasser in den antiken Wissenschaften und der Philosophie
Aufgrund der großen Bedeutung des Wassers wurde es nicht zufällig bei den frühesten Philosophen zu den vier Urelementen gezählt. Thales von Milet sah im Wasser sogar den Urstoff allen Seins. Wasser ist in der von Empedokles eingeführten und dann vor allem von Aristoteles vertretenen Vier-Elemente-Lehre neben Feuer, Luft und Erde ein Element.
Wasser ist in der taoistischen Fünf-Elemente-Lehre (neben Holz, Feuer, Erde, Metall) vertreten. Die Bezeichnung Elemente ist hier jedoch etwas irreführend, da es sich um verschiedene Wandlungsphasen eines zyklischen Prozesses handelt. Wasser hat verschiedene Orientierungen was zu unterschiedlichen (symbolischen) Strukturen führt.[13]
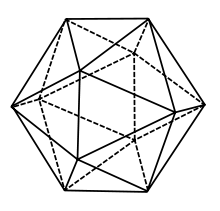
Im antiken Griechenland wurde dem Element Wasser das Ikosaeder als einer der fünf Platonischen Körper zugeordnet.
Wasser in der Religion
Wasser ist in den Mythologien und Religionen der meisten Kulturen von zentraler Bedeutung. Mit den Vorsokratikern begann vor etwa 2500 Jahren das abendländische Denken als eine Philosophie des Wassers. In vielen Religionen des Altertums wurden Gewässer allgemein und vor allem Quellen, als Heiligtum verehrt.[14] Die ungeborenen Kinder wähnte man in Quellen, Brunnen oder Teichen verborgen, aus denen sie die Kindfrauen (Hebammen) holten (Kinderglauben).
Wasser ist der Inbegriff des Lebens. In den Religionen hat es einen hohen Stellenwert. Oft wird die reinigende Kraft des Wassers beschworen, zum Beispiel im Islam in Form der rituellen Gebetswaschung vor dem Betreten einer Moschee, oder im Hindu-Glauben beim rituellen Bad im Ganges.
So gut wie jede Gemeinde im Judentum besitzt eine Mikwe, ein Ritualbad mit fließendem reinen Wasser, das oft aus einem tief reichenden Grundwasserbrunnen stammt, wenn Quellwasser nicht zur Verfügung steht. Nur wer vollständig untertaucht, wird rituell gereinigt. Notwendig ist dies für zum Judentum Bekehrte, für Frauen nach der Menstruation oder einer Geburt, und bei orthodoxen Juden vor dem Sabbat und anderen Feiertagen.

Im Christentum wird die Taufe teils durch Untertauchen oder Übergießen mit Wasser als Ganzkörpertaufe vollzogen, in der westlichen Kirche heute meist durch Übergießen mit Wasser. In der katholischen Kirche, den orthodoxen Kirchen und der anglikanischen Kirche spielt die Segnung mit Weihwasser eine besondere Rolle.
Wasser in der Esoterik
In der Esoterik spielt das Wasser eine Rolle, Kraftorte werden oft an Quellen oder Flüssen gesucht.
Wasser in der Lyrik
Zahlreiche Gedichte beschäftigen sich mit dem Wasser und werden in Anthologien zusammengefasst.[15]
Wasser in Sagen und geflügelten Worten
In vielen Sagen und Märchen spielt Wasser eine Rolle, zum Beispiel in Das Wasser des Lebens der Gebrüder Grimm. Die Bedeutung des Wassers findet sich im geflügelten Wort Kein Wässerchen trüben können.
Menschliche Gesundheit

Der menschliche Körper besteht zu über 70 % aus Wasser. Ein Mangel an Wasser führt daher beim Menschen zu gravierenden gesundheitlichen Problemen (Dehydratation, Exsikkose), da die Funktionen des Körpers, die auf das Wasser angewiesen sind, eingeschränkt werden. Zitat der Deutschen Gesellschaft für Ernährung (DGE): Geschieht dies (die Wasserzufuhr) nicht ausreichend, kann es zu Schwindelgefühl, Durchblutungsstörungen, Erbrechen und Muskelkrämpfen kommen, da bei einem Wasserverlust die Versorgung der Muskelzellen mit Sauerstoff und Nährstoffen eingeschränkt ist.[16]

Wie hoch der tägliche Mindestbedarf liegt ist unklar. Empfehlungen von 1,5 Litern und mehr pro Tag für einen gesunden, erwachsenen Menschen können wissenschaftlich nicht gestützt werden.[17] Bei einem durchschnittlichen Tageskonsum von 2 Litern werden in 80 Jahren über 55.000 Liter Wasser getrunken. Der Wasserbedarf kann bei erhöhter Temperatur größer sein.
Das Trinken exzessiver Mengen an Wasser mit mehr als 20 L/Tag kann ebenfalls zu gesundheitlichen Schäden führen. Es kann eine „Wasservergiftung“ eintreten bzw. genauer zu einem Mangel an Salzen, d. h. zu einer Hyponatriämie mit permanenten neurologischen Schäden oder Tod führen.[18]
In der Medizin wird Wasser (in Form von isotonischen Lösungen) vor allem bei Infusionen und bei Injektionen verwendet. Bei der Inhalation wird aerosolisiertes Wasser zur Heilung, etwa von Husten, benutzt.
Wasser, äußerlich angewendet, hat auf die Gesundheit und die Hygiene sehr günstige Einflüsse. Siehe auch: Baden, Balneologie, Kneippen, Sauna, Schwimmen, Waschen. Die antiken Römer pflegten aus diesen Gründen eine „Wasserkultur“ im Thermalbad.
Bedeutung für Anbau, Wirtschaft und Entwicklung

Wasser ist eine Grundvoraussetzung für das Leben: ohne Regen keine Trinkwasserversorgung, keine Landwirtschaft, keine Gewässer mit Fischen zum Verzehr, keine Flüsse zum Gütertransport, keine Industrie. Letztere benötigt für alle Produktionsvorgänge viel Wasser, das geklärt in den Kreislauf zurückgeführt wird. Wasser wird wegen seiner hohen Verdampfungsenthalpie in Form von Wasserdampf zum Antrieb von Dampfmaschinen und Dampfturbinen sowie zur Beheizung von chemischen Produktionsanlagen benutzt. Wegen seiner hohen Wärmekapazität und Verdampfungsenthalpie dient Wasser als umlaufendes bzw. verdampfendes Kühlmittel; in Deutschland dienten 1991 allein in Kraftwerken 29 Milliarden m³ als Kühlwasser. Wasser kann auch als Kältemittel (R-718) in Kältemaschinen eingesetzt werden.[19] Im Salzbergbau wird Wasser als Lösemittel zum Auslaugen, zum Transport, als Sole und zum Reinigen eingesetzt.
Wasser als Trinkwasser, Produkt und Ware

Die Wasserversorgung nutzt unterschiedliche Wasservorkommen als Trinkwasser, zum Teil aber auch für Betriebswasserzwecke: Niederschlagswasser, Oberflächenwasser in Flüssen, Seen, Talsperren, Grundwasser, Mineralwasser und Quellwasser. Die Nutzung der Gewässer wird in Deutschland im Wasserhaushaltsgesetz geregelt. In Mitteleuropa gibt es eine zuverlässige, weitgehend kostendeckende und hochwertige Trinkwasserversorgung. Diese wird meist durch öffentliche Anbieter (kommunale Versorger) gewährleistet, die die ökologische Verantwortung übernehmen und es als Leitungswasser zur Verfügung stellen. Der weltweite Wassermarkt hat ein Wachstum wie kaum eine andere Branche. Deshalb haben private Anbieter großes Interesse, Wasser als Handelsware zu definieren, um diesen Markt zu übernehmen.
Wo Trinkwasser keine direkte Handelsware ist, wurde der Begriff Virtuelles Wasser eingeführt, um dem nicht sichtbaren Wasseranteil der Produkte oder dem mitunter hohen Wasserbedarf, der im direkten Zusammenhang mit der Produktion eines Produktes anfällt, Rechnung zu tragen.
Wasserverbrauch
Als Wasserverbrauch wird die Menge des vom Menschen in Anspruch genommenen Wassers bezeichnet. Der umgangssprachliche Begriff ist – wie „Energieverbrauch“ – nicht korrekt, da nirgends Wasser „vernichtet“ wird: seine Gesamtmenge auf der Erde bleibt konstant; „Wasserbedarf“ wäre treffender. Dieser umfasst den unmittelbaren menschlichen Genuss (Trinkwasser und Kochen) ebenso wie den zum alltäglichen Leben (Waschen, Toilettenspülung etc.) sowie den für die Landwirtschaft, das Gewerbe und die Industrie (siehe Nutzwasser) gegebenen Bedarf. Das ist daher nicht nur eine Kenngröße für die nachgefragte Wassermenge, sondern zumeist auch für die Entsorgung oder Wiederaufbereitung des bei den meisten Wassernutzungen entstehenden Abwassers (Kanalisation, Kläranlage). Die aus der Versorgungsleitung entnommene Wassermenge wird durch einen Wasserzähler gemessen und zur Kostenberechnung herangezogen.
Weltweit liegt der Süßwasserbedarf bei jährlich geschätzt 4.370 km³ (2015), wobei die Grenze der nachhaltigen Nutzung bei 4.000 km³ angegeben wird (siehe auch Welterschöpfungstag). Ein dabei bislang unterschätzter Faktor ist die Verdunstung genutzten oder zur Nutzung vorgehaltenen Wassers bspw. durch Pflanzen („Evapotranspiration“), die nach neuer Daten-Analyse mit ca. 20 % des Gesamtverbrauchs angenommen wird.[20]
In Deutschland betrug 1991 der Wasserbedarf 47,9 Milliarden Kubikmeter, wovon allein 29 Milliarden Kubikmeter als Kühlwasser in Kraftwerken dienten. Rund elf Milliarden Kubikmeter wurden direkt von der Industrie genutzt, 1,6 Milliarden Kubikmeter von der Landwirtschaft. Nur 6,5 Milliarden Kubikmeter dienten der Trinkwasserversorgung. Der durchschnittliche Wasserbedarf (ohne Industrie) beträgt rund 130 Liter pro Einwohner und Tag, davon etwa 1–2 Liter in Speisen und Getränken einschließlich des in Fertiggetränken enthaltenen Wassers.
Wasserversorgung
Die Versorgung der Menschheit mit sauberem Wasser stellt Menschen nicht nur in den Entwicklungsländern vor ein großes logistisches Problem. Nur 0,3 % der weltweiten Wasservorräte sind als Trinkwasser verfügbar, das sind 3,6 Millionen Kubikkilometer von insgesamt ca. 1,38 Milliarden Kubikkilometern.
Die Wasserknappheit kann sich in niederschlagsarmen Ländern zu einer Wasserkrise entwickeln. Zur Linderung einer Wasserknappheit sind insbesondere angepasste Technologien geeignet. Es wurden aber auch schon ausgefallen erscheinende Ideen erwogen. So wurde vorgeschlagen, Eisberge über das Meer in tropische Regionen zu schleppen, die unterwegs nur wenig abschmelzen würden, um am Ziel Trinkwasser daraus zu gewinnen.
Siehe auch: Wasserverteilungssystem, Wasseraufbereitung, Wasseraufbereitungsanlage, Siedlungswasserwirtschaft in Deutschland, Wasserreinhaltung
Wassergehalt in einigen Nahrungsmitteln
- Butter 18 Prozent
- Brot 40 Prozent
- Käse 30 bis 60 Prozent
- Joghurt, Milch 87,5 Prozent
- Fleisch 60–75 Prozent
- Apfel, Birne 85 Prozent
- Wassermelone 90 Prozent
- Mohrrüben 94 Prozent
- Gurken, Tomaten 98 Prozent
Wasserverfügbarkeit
Weltweit haben etwa 4 Mrd. Menschen bzw. zwei Drittel der Weltbevölkerung mindestens einen Monat im Jahr nicht ausreichend Wasser zur Verfügung. 1,8 bis 2,9 Mrd. Menschen leiden 4 bis 6 Monate im Jahr unter schwerer Wasserknappheit, ca. 0,5 Mrd. Menschen ganzjährig.[21] Die Urbanisierung verschärft die Wasserknappheit in ländlichen Gebieten und erhöht den Wettbewerb zwischen Städten und der Landwirtschaft um Wasser.[22] Bei der Dürre und Hitze in Europa 2018 sind die Ernten teilweise massiv zurückgegangen.
Wasser als Menschenrecht
Auf Antrag Boliviens erklärte die UN-Vollversammlung am 28. Juli 2010 mit den Stimmen von 122 Ländern und ohne Gegenstimme den Zugang zu sauberem Trinkwasser und zu sanitärer Grundversorgung zu Menschenrechten. 41 Länder enthielten sich der Stimme, darunter USA, Kanada und 18 EU-Staaten. Da Resolutionen der UN-Vollversammlung völkerrechtlich unverbindlich sind, ergeben sich zunächst keine rechtlichen Konsequenzen. Jedoch könnte die neue Resolution nun die Auffassung stützen, dass sauberes Wasser und Sanitäranlagen zu einem „angemessenen“ Lebensstandard gehören und somit aufgrund des völkerrechtlich bindenden Internationalen Paktes über wirtschaftliche, soziale und kulturelle Rechte, der das Recht auf einen angemessenen Lebensstandard enthält, eingeklagt werden. Einige Länder wie Südafrika oder Ecuador haben das Recht auf Wasser in ihre Verfassung übernommen.[23]
Gesetzliche Grundlagen und Behörden
Die wasserrechtlichen Grundlagen der Wasserwirtschaft und des öffentlichen Umganges mit den Wasserressourcen bilden in Deutschland das Wasserhaushaltsgesetz und die Europäische Wasserrahmenrichtlinie. Wichtige Behörden und Institutionen sind:
- die Oberen und Unteren Wasserbehörden (auf Kreisebene, je nach Bundesland in Deutschland unterschiedlich)
- Wasser- und Schifffahrtsamt
- LAWA (Arbeitsgemeinschaft)
Wasser in den Wissenschaften
Wasser spielt eine zentrale Rolle in vielen Wissenschaften und Anwendungsgebieten. Die Wissenschaft, die sich mit der räumlichen wie zeitlichen Verteilung des Wassers und dessen Eigenschaften beschäftigt, bezeichnet man als Hydrologie. Insbesondere untersucht die Ozeanologie das Wasser der Weltmeere, die Limnologie das Wasser der Binnengewässer, die Hydrogeologie das Grundwasser und die Aquifere, die Meteorologie den Wasserdampf der Atmosphäre und die Glaziologie das gefrorene Wasser unseres Planeten. In flüssiger Form wurde Wasser bislang nur auf der Erde nachgewiesen. Bereiche der Umweltökonomie befassen sich mit Wasser als Ressource (Water Economics).
Wasserchemie
Die Wasserchemie befasst sich mit den Eigenschaften des Wassers, seinen Inhaltsstoffen und mit den Umwandlungen, die im Wasser stattfinden oder durch das Wasser verursacht werden, sowie mit dem Stoffhaushalt der Gewässer. Sie behandelt Reaktionen und Auswirkungen im Zusammenhang mit der Herkunft und Beschaffenheit der unterschiedlichen Wassertypen. Sie beschäftigt sich mit allen Bereichen des Wasserkreislaufs und berücksichtigt damit die Atmosphäre und den Boden. Dabei beschäftigt sie sich unter anderem mit der Analyse von im Wasser gelösten Stoffen, den Eigenschaften des Wassers, dessen Nutzung, dessen Verhaltensweise in verschiedenen Zusammenhängen.
Wasser ist ein Lösungsmittel für viele Stoffe, für Ionenverbindungen, aber auch für hydrophile Gase und hydrophile organische Verbindungen. Sogar gemeinhin als in Wasser unlöslich geltende Verbindungen sind in Spuren im Wasser enthalten. Daher liegt Wasser auf der Erde nirgends in reinem Zustand vor. Es hat je nach Herkunft die unterschiedlichsten Stoffe in mehr oder weniger großen Konzentrationen in sich gelöst.
In der Wasseranalytik unterscheidet man unter anderem folgende Wassertypen:
- Trinkwasser
- Mineralwasser
- Heilwasser
- Tafelwasser
- Süßwasser/Meerwasser/Salzwasser/Brackwasser
- Reinstwasser
- Demineralisiertes Wasser
- Destilliertes Wasser
- Enteisentes Wasser
- Prozesswasser
- Nutzwasser
- Abwasser, (Haushalts-Abwässer, landwirtschaftliche Abwässer, Industrie-Abwässer)
- Regenwasser
- Grundwasser
- Oberflächenwasser (Fließ- und Stehgewässer)
Aber auch bei den wässrigen Auslaugungen (Eluaten) von Sedimenten, Schlämmen, Feststoffen, Abfällen und Böden wird die Wasseranalytik eingesetzt.
Um die Eigenschaften des Wassers und eventuell darin gelöster Stoffe, bzw. damit in Kontakt stehender fester Phasen aufzuklären, kann auch die Molekulardynamik-Simulation sinnvoll sein.
Wasser in den Geowissenschaften
In den Geowissenschaften haben sich Wissenschaften herausgebildet, die sich besonders mit dem Wasser beschäftigen: die Hydrogeologie, die Hydrologie, die Glaziologie, die Limnologie, die Meteorologie und die Ozeanographie. Besonders interessant für die Geowissenschaften ist, wie Wasser das Landschaftsbild verändert (von kleinen Veränderungen über einen großen Zeitraum bis hin zu Katastrophen, bei denen Wasser innerhalb weniger Stunden ganze Landstriche zerstört), dies geschieht zum Beispiel auf folgende Weisen:
- Flüsse oder Meere reißen Erdmassen mit sich und geben sie an anderer Stelle wieder ab (Erosion).
- Durch sich bewegende Gletscher werden ganze Landschaften umgestaltet.
- Wasser wird von Steinen gespeichert, gefriert in diesen und sprengt die Steine auseinander, weil es sich beim Gefrieren ausdehnt (Frostverwitterung).
- Durch Dürren werden die natürlichen Ökosysteme stark beeinflusst.
Wasser ist nicht nur ein bedeutender Faktor für die mechanische und chemische Erosion von Gesteinen, sondern auch für die klastische und chemische Sedimentation von Gesteinen. Dadurch entstehen unter anderem Grundwasserleiter.
Auch interessiert Geowissenschaftler die Vorhersage des Wetters und besonders von Regenereignissen (Meteorologie).
Siehe auch: Gewässer, Permafrostboden, Binnenmeer, Binnensee, Teich, Meer, Ozean, Bach, Flussaue.
Wasser in der Hydrodynamik
Die verschiedenen strömungstechnischen Eigenschaften und Wellentypen in mikroskopischem bis globalem Maßstab werden untersucht, konkret zu folgenden Fragestellungen:
- Optimierung von Bootskörpern und exponierter Baukörper (zum Beispiel Wehre) – Minimierung des Strömungswiderstandes
- Optimierung des Wirkungsgrades von wassergetriebenen Turbinenrädern und Schiffsantrieben
- Untersuchung von Strömungsphänomenen (Tsunami, Monsterwellen)
- Wasserstoß (Wasserwidder)
- Meeresströmungen im Zusammenhang mit Wetter und Klimaerscheinungen
- Strömungen in Gewässern mit Transport und Ablagerung von Sediment, Fischwanderung, Austausch von Sauerstoff, gelösten Stoffen, Plankton
- Hochdruckwasserstrahl als Reinigungs- und Schneidemittel
Wasser und Natur
Vorkommen auf der Erde
Die Bezeichnung Wasser wird im Allgemeinen für den flüssigen Aggregatzustand verwendet. Im festen Zustand spricht man von Eis, im gasförmigen Zustand von Wasserdampf. In der Natur kommt Wasser selten rein vor, sondern enthält meist gelöste Anteile von Salzen, Gasen und organischen Verbindungen.
Verteilung und Verfügbarkeit
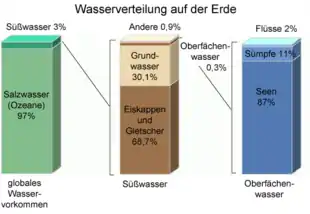
Der größte Teil der Erdoberfläche (71 %) ist von Wasser bedeckt, besonders die Südhalbkugel und als Extrem die Wasserhemisphäre. Die Wasservorkommen der Erde belaufen sich auf circa 1,4 Milliarden Kubikkilometer (entspricht dem Volumen eines Würfels mit 1120 km Kantenlänge), wovon der allergrößte Teil auf das Salzwasser der Weltmeere entfällt. Nur 48 Millionen Kubikkilometer (3,5 %) des irdischen Wassers liegen als Süßwasser vor. Das mit 24,4 Millionen Kubikkilometern (1,77 %) meiste Süßwasser ist dabei als Eis an den Polen, Gletschern und Dauerfrostböden gebunden und somit zumindest für prompte Nutzung nicht verfügbar. Einen weiteren wichtigen Anteil macht das Grundwasser mit 23,4 Millionen Kubikkilometern aus. Das Wasser der Fließgewässer und Binnenseen (190.000 km³), der Atmosphäre (13.000 km³), des Bodens (16.500 km³) und der Lebewesen (1.100 km³) ist im Vergleich rein mengenmäßig recht unbedeutend. Dabei ist jedoch nur ein geringer Teil des Süßwassers auch als Trinkwasser verfügbar. Insgesamt liegen 98,233 % des Wassers in flüssiger, 1,766 % in fester und 0,001 % in gasförmiger Form vor. In seinen unterschiedlichen Formen weist das Wasser dabei spezifische Verweilzeiten auf und zirkuliert fortwährend im globalen Wasserkreislauf. Diese Anteile sind jedoch nur näherungsweise bestimmbar und wandelten sich auch stark im Laufe der Klimageschichte, wobei im Zuge der globalen Erwärmung von einem Anstieg des Wasserdampfanteils ausgegangen wird.
Tiefenwasser in schon deutlich wärmeren geologischen Schichten wird direkt oder über Wärmetausch als Wärme-Energiequelle genutzt, wobei sowohl natürliche Thermalquellen und Geysire an der Oberfläche vorliegen als auch der Mensch danach bohrt. Durch den Gebirgsdruck bleibt Wasser in der Tiefe auch bei Temperaturen über dem Siedepunkt bei Normaldruck von 100 °C flüssig. Neue Erkenntnisse lassen vermuten, dass auch in etwa 500 km Tiefe, im Zwischenbereich von oberem und unterem Erdmantel Wasser in flüssiger Form vorliegt.[24]
Die bislang noch fehlende bzw. unzureichende Versorgung eines großen Teils der Weltbevölkerung mit hygienischem und toxikologisch unbedenklichem Trinkwasser, sowie mit einer ausreichenden Menge Nutzwasser, stellt eine der größten Herausforderungen der Menschheit in den nächsten Jahrzehnten dar. Seit 1990 haben rund 2,6 Milliarden weitere Menschen Zugang zu einer sicheren Wasserversorgung erhalten, zum Beispiel mithilfe von Pumpbrunnen oder einem Leitungssystem. Aber immer noch trinken 663 Millionen Menschen jeden Tag Wasser, das verschmutzt ist und krank machen kann.[25]
Herkunft des irdischen Wassers
Die Herkunft des Wassers auf der Erde, insbesondere die Frage, warum auf der Erde deutlich mehr Wasser vorkommt als auf den anderen inneren Planeten, ist bis heute nicht befriedigend geklärt. Ein Teil des Wassers gelangte zweifellos durch das Ausgasen von Magma in die Atmosphäre, stammt also letztlich aus dem Erdinneren. Ob dadurch aber die Menge an Wasser erklärt werden kann, wird stark angezweifelt. Das Element Wasserstoff ist das häufigste Element im Universum, und auch Sauerstoff kommt in großen Mengen vor, allerdings normalerweise gebunden in Silikaten und Metalloxiden; beispielsweise ist der Mars mit großen Anteilen an Eisen(III)-oxid bedeckt, was ihm seine rote Farbe verleiht. Wasser hingegen ist dort – im Vergleich zur Erde – nur in geringen Mengen zu finden.
Vorkommen im Universum
Außerhalb der Erde kommt ebenfalls Wasser vor. Beispielsweise wurde Wassereis in Kometen, auf dem Mars, einigen Monden der äußeren Planeten und dem Exoplaneten OGLE-2005-BLG-390Lb nachgewiesen. Allein die Saturnringe enthalten überschlägig etwa 20 bis 30 Mal so viel Wasser, wie auf der Erde vorkommt. Hinweise auf das Vorhandensein von Wassereis in polnahen Meteoritenkratern gibt es beim Erdmond und sogar beim Merkur, dem sonnennächsten Planeten. Als Flüssigwasser wird es unter den eisigen Oberflächen von Europa, Enceladus, ein paar weiteren Monden sowie bei OGLE-2005-BLG-390Lb vermutet. Direkt fotografisch belegt wurde außerirdisches Flüssigwasser bisher aber nur in Form weniger salzwasserhaltiger Schlammtröpfchen auf dem Mars. Außerirdischer Wasserdampf konnte unter anderem in den Atmosphäre von Mars und Titan, den höheren Atmosphärenschichten roter Riesensterne, in interstellaren Nebeln und sogar im Licht ferner Quasare nachgewiesen werden.
Klima
Wasser beeinflusst entscheidend unser Klima und ist Basis nahezu aller Wettererscheinungen, vor allem bedingt durch seine hohe Mobilität und Wärmekapazität. In den Ozeanen wird die einstrahlende Sonnenenergie gespeichert. Diese regional unterschiedliche Erwärmung führt wegen Verdunstung zu unterschiedlichen Konzentrationen der gelösten Stoffe, da diese nicht mitverdunsten (vor allem Salinität (Salzgehalt)). Dieses Konzentrationsgefälle erzeugt globale Meeresströmungen, die sehr große Energiemengen (Wärme) transportieren (z. B. Golfstrom, Humboldtstrom, äquatorialer Strom, mitsamt ihren Gegenströmungen). Ohne den Golfstrom würde in Mitteleuropa arktisches Klima herrschen.
Im Zusammenhang mit dem Treibhauseffekt stellen Ozeane die wirksamste CO2-Senke dar, da Gase wie Kohlendioxid in Wasser gelöst werden (Kohlenstoffzyklus). Die mit der globalen Erwärmung einhergehende Temperaturerhöhung der Weltmeere führt zu einem geringeren Haltevermögen an Gasen und damit zu einem Anstieg des CO2 in der Atmosphäre. Wasserdampf stellt in der Atmosphäre ein wirksames Treibhausgas dar. (siehe Treibhauseffekt)
Bei der Erwärmung verdunstet Wasser, es entsteht Verdunstungskälte. Als „trockener“ Dampf (nicht kondensierend) und als „nasser“ Dampf (kondensierend: Wolken, Nebel) enthält und transportiert es latente Wärme, die für sämtliche Wetterphänomene entscheidend verantwortlich ist (siehe auch Luftfeuchtigkeit, Gewitter, Föhn). Die Wärmekapazität des Wassers und die Phänomene der Verdunstungskälte und latenten Wärme sorgen in der Nähe von großen Gewässern für gemäßigte Klimate mit geringen Temperaturschwankungen im Jahres- und Tagesgang. Wolken verringern zudem die Einstrahlung durch die Sonne und die Erwärmung der Erdoberfläche durch Reflexion.
Der aus Wolken fallende Niederschlag und der Wasserdampf (Auskämmung und Photosynthese bzw. Atmung) bewässern die terrestrischen Ökotope. Auf den Landmassen können so Gewässer oder Eismassen entstehen, die auch meso- und mikroklimatische Wirkungen haben. Das Verhältnis von Evapotranspiration (Gesamtverdunstung eines Gebietes) zu Niederschlag entscheidet, ob sich trockene (aride, Steppen, Wüsten) oder feuchte (humide, Wälder, Waldsteppen) Klimate bilden. Auf den Landmassen ist außerdem der Wasserhaushalt der Vegetation eine klimatische Größe.
Bedeutung des Wassers für das Leben
Wasser ist vermutlich der Entstehungsort des Lebens und eine seiner Bedingungen. In Organismen und in unbelebten Bestandteilen der Ökosphäre spielt es als vorherrschendes Medium bei fast allen Stoffwechselvorgängen beziehungsweise geologischen und ökologischen Elementarprozessen eine entscheidende Rolle. Die Erdoberfläche ist zu circa 72 % von Wasser bedeckt, wobei Ozeane hieran den größten Anteil tragen. Süßwasserreserven bilden lediglich 2,53 % des irdischen Wassers und nur 0,3 % sind als Trinkwasser zu erschließen (Dyck 1995). Durch die Rolle des Wassers in Bezug auf Wetter und Klima, als Landschaftsgestalter im Zuge der Erosion und durch seine wirtschaftliche Bedeutung, unter anderem in den Bereichen der Land-, Forst- und Energiewirtschaft, ist es zudem in vielfältiger Weise mit Geschichte, Wirtschaft und Kultur der menschlichen Zivilisation verbunden. Die Bedeutung des Wassers für das Leben war insofern auch immer Gegenstand der Naturphilosophie.
Grundbaustein des Lebens
Das Leben ist nach dem heutigen Erkenntnisstand im Wasser entstanden (siehe auch Evolution). Autotrophe Schwefelbakterien (Prokaryoten) produzieren aus Schwefelwasserstoff und Kohlendioxid unter Zufuhr von Lichtenergie organische Kohlenstoffverbindungen und Wasser:
Als Nachfolger nutzten Blaubakterien (Cyanobakterien) und alle späteren autotrophen Eukaryoten das hohe Redoxpotential des Wassers: Unter Zufuhr von Licht produzieren sie aus Wasser und Kohlendioxid Traubenzucker und Sauerstoff:
Durch diesen Prozess reicherte sich im Wasser und in der Atmosphäre immer mehr Sauerstoff an. Damit wurde die Gewinnung von Energie durch Zellatmung (Dissimilation) möglich:
Voraussetzung für die Fähigkeit, mit dem giftigen Sauerstoff (Oxidation der empfindlichen Biomoleküle) umzugehen, waren Enzyme wie die Katalase, die eine strukturelle Ähnlichkeit mit dem Sauerstoff transportierenden Hämoglobin aufweist. Aerobe Purpurbakterien nutzten vielleicht als erstes den giftigen Sauerstoff zum energieliefernden Abbau von organischen Stoffen. Nach der Endosymbiontentheorie nahmen damals noch anaerobe Eukaryoten die aeroben Prokaryoten (wahrscheinlich Purpurbakterien) auf.
Wasser wurde damit zum Medium grundlegender biochemischer Vorgänge (Stoffwechsel) zur Energiegewinnung und -speicherung:
Auf Grund des Dipolmomentes eignet sich Wasser als Lösungsmittel für polare Substanzen und wegen der daraus entspringenden Viskosität und Dichte als Transportmittel. Wasser transportiert Nährstoffe, Abbauprodukte, Botenstoffe und Wärme innerhalb von Organismen (zum Beispiel Blut, Lymphe, Xylem) und Zellen. Die Eigenschaften des Wassers werden bei Pflanzen und Tieren (inklusive Mensch) mannigfaltig, z. B. für die Temperaturregulierung benutzt, in Form von Guttation, Schwitzen etc., oder z. B. als Basis für antibakterielle Schutzfilme bei Kröten und Fischen.
Pflanzen und Tieren ohne Skelett verleiht der Turgordruck des Wassers Form und Festigkeit. Durch Turgoränderungen können sie sich auch bewegen (zum Beispiel Blattbewegung bei Pflanzen).
Die Stachelhäuter, zu denen die Seeigel, Seesterne und Seewalzen gehören, haben statt eines festen Skeletts ein System hydraulisch arbeitender Gefäße (Ambulacralsystem). Sie bewegen sich durch gezielte Druckänderungen in diesem Gefäßsystem.
Wasser und Ökosysteme
In terrestrischen Ökosystemen ist Wasser begrenzender Faktor der Produktivität. Es ist essenziell für den Stoffwechsel von Lebewesen (Biosphäre) sowie für die Herausbildung und Prägung ihrer Standorte (Pedosphäre, Erdatmosphäre/Klima). Niederschläge speisen Gewässer und Grundwasser als Ressource für das Pflanzenwachstum und als Trinkwasser für die Tiere.
Die meiste Biomasse und größte Produktivität findet sich in aquatischen Ökosystemen, vor allem in Ozeanen, in denen der begrenzende Produktionsfaktor die Menge der im Wasser gelösten Nährstoffe ist, also vor allem Phosphat, Stickstoffverbindungen (Ammonium, Nitrat) und CO2 (Kohlendioxid). Die Eigenschaften des Wassers werden mit hoher Effizienz genutzt, z. B. bei der Oberflächenspannung von Insekten, Spinnentieren, bei der Dichte und den optischen Eigenschaften vom Plankton etc.
Die Temperaturabhängigkeit der Wasserdichte führt in Gewässern zu einer Temperaturschichtung, zu Sprungschichten und Ausgleichsströmungen, die vor allem in limnischen (Süßwasser-)Biotopen charakteristisch sind (siehe Ökosystem See), aber auch in marinen Ökosystemen anzutreffen sind und genutzt werden (Wale nutzen z. B. die Schallreflexionen an Sprungschichten zur Verbesserung ihrer Kommunikation). Die Dichteanomalie des Wassers ermöglicht auch das Überleben von Lebewesen im Winter, da stehende Gewässer dadurch nicht bis zum Grund durchfrieren (Ausnahme flache Gewässer und „Frosttrocknis“). Zusätzlich bewirkt die Dichteanomalie in tieferen Seen der gemäßigten Zonen im Frühling und Herbst bei Erreichen einer einheitlichen Temperatur eine Umwälzung des Wassers und somit einen Austausch von Oberflächen- und Tiefenwasser, der für Nährstoff- und Sauerstoffkreislauf wesentlich ist.
Auch wenn aquatische Ökosysteme durch die Wärmekapazität des Wassers sehr stabile Lebensräume darstellen, haben auch geringere Temperaturschwankungen deutliche Folgen (vgl. Ökosystem See). So wird die Temperaturerhöhung der Ozeane Veränderungen in marinen Ökosystemen zur Folge haben.
Ökologischer Zustand von Gewässern
Der ökologische Zustand von Fließ- bzw. Oberflächengewässern (wie von Grundwasser) wird in der Europäischen Union (EU) nach der Richtlinie 2000/60/EG (EU-Wasserrahmenrichtlinie, WRRL) nach verschiedenen Kriterien analysiert und nach fünf Graden eingeteilt: „sehr gut“, „gut“, „mäßig“, „unbefriedigend“, „schlecht“.[26][27]
Wasser in der Technik
Wasser hat in der Technik verschiedene Anwendungsmöglichkeiten, meist im flüssigen Zustand, gelegentlich auch als Eis oder Dampf.
- Die Gewichtskraft von Wassermassen wird in den verschiedenen Wassermühlen und Wasserturbinen zur Gewinnung von mechanischer oder elektrischer Energie genutzt. Beim durch Wasserschlag pumpenden Wasserwidder kommt zusätzlich die geringe Kompressibilität von Wasser dazu.
- Dampf wird genutzt in Dampfturbinen die in vielen modernen Kraftwerken vorkommen um die primär erzeugte Wärme zunächst in mechanische Energie und schließlich mit einem Generator in elektrische Energie umzuwandeln. Die (Kolben-)Dampfmaschine war vor allem in der industriellen Revolution von Bedeutung.
- Eismaschinen dienen der Verarbeitung von Speiseeis und Herstellung von Eiswürfel und Scherbeneis, die Eisbearbeitungsmaschine zum Glätten der von Kunsteisbahnen. Iglus sind Gebäude aus Eis.
Bei der Wärmeübertragung dient Wasser für Heizung oder in der Wasserkühlung und die Erzeugung von Kälte durch Verdunstung, etwa in Kühltürmen. Kältemaschinen funktionieren auf Basis der Adsorption von Ammoniak in Wasser oder Wasserdampf in (wässriger) Lithiumbromid-Lösung.
Wasser dient kalt und warm zum reinigenden Waschen (eventuell mit Detergentien oder Laugen oder Säuren), Lösen (Auslaugen von Salzlagerstätten), Trennen über Chromatographie oder Extraktion (Aufgussgetränke), Umkristallisieren (Abbinden von Gips, Zement, (zusammen mit Kohlenstoffdioxid:) Kalk; jedoch auch Reinigen von löslichen Substanzen im Chemielabor). Als Druckstrahl zum Spülen, Brausen, Hochdruckreinigen eventuell mit abrasivem Zusatzstoff, und zum Wasserstrahlschneiden auch etwa im hygienesensiblen Bereich der Lebensmittelindustrie.
In Form von Gel wird Wasser als Schallübertragungsmedium vom Sensorkopf zum menschlichen Körper bei der Ultraschalldiagnostik genutzt. Wasser ist Schallübertragungsmedium beim Echolot.
Als Medium mit hoher Oberflächenspannung und guter Verdunstungsrate dient Wasser zum verschieblichen Anklatschen von Beschriftungsfolie auf Schaufenstern, Autokarosserien und anderen glatten zu kaschierenden Oberflächen, ebenso als Gleit- und Dichtmittel für Saugnäpfe. Die Oberflächenspannung von Wasser erlaubt im Zusammenspiel mit Seife Seifenblasen und das Bauen von Schichten ab Moleküldicke und feiner Membrane für physikalische Experimente. Der Wasserläufer kann mittels Dellen in der Oberfläche laufen, Biofilme können sich ausbreiten, aber auch ölige Substanzen spreiten.
Ursprüngliche Hydraulik verwendet Wasser als Druckübertragungsmedium, sowie als Fontänen in Springbrunnen und Wasserspielen, die auch Verdunstungskühlung und Lichteffekte ermöglichen. Das Aufbrechen von geologischen Schichten beim Fracking ist ebenfalls eine Hochdruckanwendung.
Durch Wasser erzeugter Auftrieb erlaubt Schiffen, Bojen und Lebewesen das Schwimmen. Ballasttanks helfen, unbeladene oder ungleichmäßig beladene Schiffe zu stabilisieren und U-Booten, auf- und abzutauchen. Es gibt Seilbahnen und Lifte, die im Gegenzug von Wasserballasttanks gezogen bzw. gehoben werden.
Wasser als Dissoziationsmedium dient für Elektrolyse, Galvanik, Akku- und Batterietechnik, sowie in alten Kraftwerken als Strom-Regelungstank. Weiters kommt Wasser als Lösungsmittel aller wässrigen Chemie, ob beim Mikroverfahren der Tüpfelplatte, dem grafisch wirksamen Entwickeln fotografischer Platten und Filme oder der großtechnischen Herstellung von Nitramoncal aus Ammoniak und Salpetersäure, zum Einsatz.
In der Medizin dient Wasser als lösendes Medium zum Injizieren oder Infundieren von Stoffen in den Körper, um den Wasserhaushalt des Körpers zu korrigieren, zum Aufweichen harter Haut oder von Nägeln oder zum Spülen des Darms. Das Kopfhaar mit Wasser reversibel aufzuquellen und in Wellen und Locken zu formen, ist Friseurhandwerk.
Weidenruten, Peddigrohr etc. werden in Wasser gelegt zum Flechten biegsam gemacht. Hartholz wird unter Wasserdampf zu Bugholzmöbeln geformt.
Wasser kann Infrarotstrahlung aus Glühlampenlicht ausfiltern und absorbiert ionisierende Strahlung im Abklingbecken von Kernkraftwerken.
In Wasserwerfern wird Wasser, mit und ohne chemischem Zusatz, als Munition eingesetzt.
Reinstwasser leitet Strom schlecht. Erst, wenn andere Stoffe, die sich in Ionen auflösen können, hinzukommen, kann es elektrischen Strom übertragen.[28]
In Kernkraftwerken wird Wasser als Moderator genutzt, d. h., um Neutronen abzubremsen.
Ausstellungen und Veranstaltungen rund ums Wasser
- Von 2005 bis 2014 hat die UNO zur Internationalen Aktionsdekade „Wasser – Quelle des Lebens“ aufgerufen
- Weltwasserforum
- Weltwassertag
- WasserForum – Museum der Wasserversorgung und -gewinnung der HWW (Hamburger Wasserwerke/Hamburg Wasser)
- Gute Güte – Projekt zur Wasserrahmenrichtlinie der EU in Hannover.
- Wasser (Musical) – Musical von Siegfried Faderl und Ewald Mayrbäurl.
- Wasserleitungsmuseen Kaltenbrunn und Wildalpen der I. Wiener Hochquellenleitung, Wasserspielparks in Wien beim Wasserturm Favoriten und auf der Donauinsel.
Literatur
- Ole Pollem: Regulierungsbehörden für den Wassersektor in Low-Income Countries. Eine vergleichende Untersuchung der Regulierungsbehörden in Ghana, Sambia, Mosambik und Mali. Verlag Dr. Kovac, Hamburg 2009, ISBN 978-3-8300-4473-4.
Allgemeine Inhalte
- Sibylle Selbmann: Mythos Wasser, Symbolik und Kulturgeschichte. Badenia, Karlsruhe 1995, ISBN 3-7617-0309-0.
- Philip Ball: H2O – Biographie des Wassers. Piper, München 2001, ISBN 3-492-04156-6.
- Siegfried Dyck, Gerd Peschke: Grundlagen der Hydrologie. 3. Auflage. Verlag für Bauwesen, Berlin 1995, ISBN 3-345-00586-7.
- Dieter Gerten: Wasser. Knappheit, Klimawandel, Welternährung. C. H. Beck, München 2018, ISBN 978-3-406-68133-2.
- Vollrath Hopp: Wasser-Krise? Wasser, Natur, Mensch, Technik und Wirtschaft. Wiley-VCH, Weinheim 2004, ISBN 3-527-31193-9.
- Ernst Schmidt (Hrsg.): Properties of Water and Steam in SI-Units. Springer, Berlin 1981, ISBN 3-540-09601-9. („Thermodynamische Eigenschaften von Wasser und Wasserdampf, 0–800 °C, 0–1000 bar“)
- Helmut Lehn, Oliver Parodi: Wasser – elementare und strategische Ressource des 21. Jahrhunderts. I. Eine Bestandsaufnahme. In: Umweltwissenschaften und Schadstoff-Forschung. Band 21, Nr. 3, 2009, S. 272–281.
- Wolfram Mauser: Wie lange reicht die Ressource Wasser? Vom Umgang mit dem blauen Gold. Fischer-Taschenbuch, Frankfurt am Main 2007, ISBN 978-3-596-17273-3.
- Érik Orsenna: Die Zukunft des Wassers: eine Reise um unsere Welt (Originaltitel: L’ avenir de l’eau, übersetzt von Caroline Vollmann). Beck, München 2010, ISBN 978-3-406-59898-2; als Taschenbuch: dtv, München 2012, ISBN 978-3-423-34690-0.
- Helge Bergmann: Wasser Mythen, Märkte, Moleküle. Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32959-5.
- Leopold Schua: Lebensraum Wasser . Geheimnisse in einer unbekannten Welt. (= Kosmos Bibliothek. Band 268). Stuttgart 1970, ISBN 3-440-00268-3 (pdf; 23 MB).
Wasserchemie
- Heinrich Sontheimer, Paul Spindler, Ulrich Rohmann: Wasserchemie für Ingenieure. DVGW-Forschungsstelle am Engler-Bunte-Institut der Uni Karlsruhe. ZfGW-Verlag, Frankfurt 1980, ISBN 3-922671-00-4.
- Bernd Naumann: Chemische Untersuchungen der Lebensgrundlage Wasser. (= Anregungen zur ökologischen Bildung. Bd. 2). Landesinstitut für Lehrerfortbildung, Lehrerweiterbildung und Unterrichtsforschung von Sachsen-Anhalt (LISA), Halle 1994.
- Günter Wieland: Wasserchemie. 12. Auflage. Vulkan-Verlag, Essen 1999, ISBN 3-8027-2542-5.
- Karl Höll, Andreas Grohmann u. a.: Wasser. Nutzung im Kreislauf. Hygiene, Analyse und Bewertung. 8. Auflage. Walter de Gruyter, Berlin 2002, ISBN 3-11-012931-0. (Standardwerk der Wasseruntersuchung).
- Leonhard A. Hütter: Wasser und Wasseruntersuchung – Methodik, Theorie u. Praxis chemischer, chemisch-physikalischer, biologischer u. bakteriologischer Untersuchungsverfahren. Sauerländer, Frankfurt am Main 1994, ISBN 3-7935-5075-3.
Nutzung und Schutz
- Christian Opp (Hrsg.): Wasserressourcen. Nutzung und Schutz; Beiträge zum Internationalen Jahr des Süßwassers 2003. Marburger Geographische Gesellschaft, Marburg/Lahn 2004, ISBN 3-88353-049-2.
- Christian Leibundgut, Franz-Josef Kern: Wasser in Deutschland – Mangel oder Überfluss? In: Geographische Rundschau. Band 58, Nr. 2, 2006, S. 12–19.
Konflikte um Wasser
- Aboubacry Athie: Die politischen Implikationen der Wasserverfügbarkeit in Afrika südlich der Sahara dargestellt am Beispiel der Sahelländer Westafrikas. Wissenschaftlicher Verlag, Berlin 2002, ISBN 3-936846-05-7.
- Hans Huber Abendroth: Der „Wasserkrieg“ von Cochabamba. Zur Auseinandersetzung um die Privatisierung einer Wasserversorgung in Bolivien. Bundeskammer für Arbeiter und Angestellte, Wien 2004, ISBN 3-7062-0081-3.
- Detlef Müller-Mahn: Wasserkonflikte im Nahen Osten – eine Machtfrage. In: Geographische Rundschau. Band 58, Nr. 2, 2006, S. 40–48.
- Lisa Stadler, Uwe Hoering: Das Wasser-Monopoly. Von einem Allgemeingut und seiner Privatisierung. Rotpunktverlag, Zürich 2003, ISBN 3-85869-264-6.
- Karo Katzmann: Schwarzbuch Wasser – Verschwendung, Verschmutzung, bedrohte Zukunft. Molden, Wien 2007, ISBN 978-3-85485-196-7.
- Andreas Hoppe: Wasser im Nahen Osten – ein Kriegsgrund? In: Naturwissenschaftliche Rundschau. Band 59, Nr. 5, 2006, S. 241–247.
Religiöse Bedeutung
- Claudia Sticher: Wasser. Symbol des Lebens und des Glauben. Mit einem Beitrag von Norbert Lohfink. Verlag Katholisches Bibelwerk, Stuttgart 2014, ISBN 978-3-460-27174-6.
Lyrisches
Hermann Peter Piwitt und Susann Henschel (Hrsg.): Des Wassers Überfluss – Von Brunnen, Quellen und schönen Wassern, Philipp Reclam jun., Stuttgart 2006, ISBN 978-3-15-018450-9.
Weblinks
- Wasserlexikon der Uni Bremen
- Grafik, die die weltweite Verteilung von Wasser in allen Formen darstellt
- Sämtliche physikalischen Daten von Wasser (englisch), abgerufen am 25. November 2011
- Das Absorptionsspektrum von flüssigem Wasser vom UV bis zum IR (englisch)
- Grafik, die zeigt, wie es ausshähe, wenn alles Wasser auf oder nahe der Erdoberfläche eine große Kugel bilden würde
- Woher kommt unser Wasser? aus der Fernseh-Sendereihe alpha-Centauri (ca. 15 Minuten). Erstmals ausgestrahlt am 4. Aug. 2002.
- Ist Wasser magisch? aus der Fernseh-Sendereihe alpha-Centauri (ca. 15 Minuten). Erstmals ausgestrahlt am 27. Okt. 2002.
- Marko Pauli: Wasser – Eine rätselhafte Flüssigkeit. In: Deutschlandfunk Kultur – Feature. 16. Januar 2020, abgerufen am 18. Januar 2020.
- Thema Wasser beim Bundesamt für Umwelt (Schweiz)
Einzelnachweise
- Datenblatt Pure Water Density Standard bei Sigma-Aldrich, abgerufen am 21. Februar 2017 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 85. Auflage. (Internet-Version: 2005), CRC Press/Taylor and Francis, Boca Raton, FL, Fluid Properties, S. 6-3 – 6-5.
- Charles E. Mortimer, Ulrich Müller: Chemie: das Basiswissen der Chemie. 9., überarb. Auflage. Georg Thieme Verlag, Stuttgart 2007, ISBN 978-3-13-484309-5, S. 165 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ulrich Hübschmann: Tabellen zur Chemie in Ausbildung und Beruf. Handwerk und Technik, Hamburg 2002, ISBN 3-582-01234-4, S. 37.
- P. W. Atkins, Julio De Paula: Physikalische Chemie. 5. Auflage. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-68289-8, S. 73.
- Friedrich Kluge, Alfred Götze: Etymologisches Wörterbuch der deutschen Sprache. 20. Auflage. Hrsg. von Walther Mitzka. De Gruyter, Berlin / New York 1967; Neudruck („21. unveränderte Auflage“) ebenda 1975, ISBN 3-11-005709-3, S. 840.
- Wasser ist nicht gleich Wasser: Trennung und Untersuchung der Isomere des Wassers (para- und ortho-Wasser, para-Wasser reagiert 25 % schneller mit Diazenylium-Ionen «protonierter Stickstoff»), chemie.de, 31. Mai 2018.
- Wasser ist nicht gleich Wasser. Universität Basel, 29. Mai 2018.
- J. F. Swindells, J. R. Coe, Jr., and T. B. Godfrey: Absolute Viscosity of Water at 20 °C. Hrsg.: Journal of Research of the National Bureau of Standards. Band 48, Nr. 1, Januar 1952.
- C.E. Mortimer, U. Müller: Chemie – Das Basiswissen der Chemie. 12. Auflage. Thieme, 2015, ISBN 978-3-13-484312-5, S. 61.
- Thomas Kramar: Physik: Eine Brücke aus H2O. In: Die Presse. 8. November 2007.
- Wasserstoff als Energieträger der Zukunft (Memento vom 26. Oktober 2012 im Internet Archive), VDE, abgerufen am 3. August 2011.
- Bilden von Strukturen.
- Sibylle Selbmann: Mythos Wasser. Symbolik und Kulturgeschichte. Badenia Verlag, Karlsruhe 1995, ISBN 3-7617-0309-0.
- Hermann Peter Piwitt und Susann Henschel (Hrsg.): Des Wassers Überfluss – Von Brunnen, Quellen und schönen Wassern, Gedichte, Philipp Reclam jun., Stuttgart 2006, ISBN 978-3-15-018450-9.
- Deutsche Gesellschaft für Ernährung e. V.: In der Hitze des Sommers viel trinken. Dge.de, 28. Juli 2006, abgerufen am 6. Juli 2010.
- Health Marketing – Waterlogged? von Margaret McCartney, doi:10.1136/bmj.d4280.
- Linda F. Fried, Paul M. Palevsky: Hyponatremia and Hypernatremia. In: Medical Clinics of North America. Vol. 81, Nr. 3, 1. Mai 1997, S. 585–609. doi:10.1016/S0025-7125(05)70535-6.
- Die Wasser-Kältemaschine, BINE Informationsdienst.
- Dagmar Röhrlich: Ressourcen knapper als gedacht. Deutschlandfunk.de, Forschung Aktuell. 3. Dezember 2015, abgerufen am 3. Dezember 2015. Nach: F. Jaramillo, G. Destouni: Local flow regulation and irrigation raise global human water consumption and footprint. In: Science. Band 350, Nr. 6265, 4. Dezember 2015, S. 1248–1251, doi:10.1126/science.aad1010 (sciencemag.org [abgerufen am 29. Mai 2019]).
- Mesfin M. Mekonnen, Arjen Y. Hoekstra: Four billion people facing severe water scarcity. In: Science. 2016, doi:10.1126/sciadv.1500323.
- Dustin Garrick, Lucia De Stefano u. a.: Rural water for thirsty cities: a systematic review of water reallocation from rural to urban regions. In: Environmental Research Letters. Band 14, Nr. 4, 2019, S. 043003, doi:10.1088/1748-9326/ab0db7.
- Wasser ist ein Menschenrecht. In: Red Globe. 29. Juli 2010, abgerufen am 29. Juli 2010.
Recht auf Wasser nicht einklagbar. In: der Standard. 29. Juli 2010, abgerufen am 29. Juli 2010. - Wolfgang Baumjohann: Dann gehe ich lieber in die Berge. Interview mit Tiz Schaffer. In: Falter. 04/15, 21. Januar 2015. Abgerufen am 3. Mai 2015.
- Zugang zu sauberem Trinkwasser. Abgerufen am 26. Juli 2017.
- Umweltziele – der gute Zustand für unsere Gewässer, bmnt.gv.at. Abgerufen am 4. April 2018. Umweltziele – der gute Zustand für unsere Gewässer, bmnt.gv.at (Memento vom 5. April 2018 im Internet Archive)
- Sibylle Wilke: Ökologischer Zustand der Fließgewässer. In: Umweltbundesamt. 18. Oktober 2013 (umweltbundesamt.de [abgerufen am 4. April 2018]).
- Elektrische Leitfähigkeit des Wassers. Abgerufen am 26. April 2021.

