Aluminate
Aluminate sind Salze der Aluminiumsäure HAlO2·H2O, die mit Aluminiumhydroxid (welches amphoter ist) identisch ist, bei denen Aluminium ein komplexes Anion [Al(OH)4]− mit Hydroxidionen als Liganden bildet, sowie Salze, bei denen das Anion als Kondensat des Aluminat-Ions vorliegt.
Die allgemeine Zusammensetzung solcher Verbindungen ist MI[Al(OH)4] mit M als einwertiges Kation. Vollständig kondensierte (wasserfreie) Verbindungen haben die allgemeine Zusammensetzung MIAlO2 mit AlO2− als Anion.[1]
Mit zweiwertigen Kationen gibt es zahlreiche in der Natur vorkommende mineralische Verbindungen, wie z. B. Magnesiumaluminat (MgAl2O4, siehe Spinell), Zinkaluminat (ZnAl2O4, siehe Gahnit), Eisenaluminat (FeAl2O4, siehe Hercynit) und Manganaluminat (MnAl2O4, siehe Galaxit). Aluminium liegt bei allen diesen Verbindungen in der Oxidationsstufe (III) vor.
Beispiele
Ein sehr bekanntes Aluminat ist Natriumaluminat, das durch Auflösen von Aluminiumhydroxid in Natronlauge z. B. beim Bayer-Verfahren zur Herstellung von Aluminium aus Bauxit entsteht:
In der Ionenschreibweise:
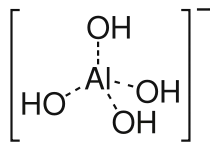
Das Tetrahydroxoaluminat-Ion (beispielsweise in: Natrium-tetrahydroxoaluminat) neigt zur Kondensation unter Bildung von Dialuminat-Ionen [(HO)3Al–O–Al(OH)3]2− und höheren Polymeren. Die Polymerisation erfolgt ähnlich wie bei der Orthokieselsäure. Die Endprodukte einer solchen Kondensation werden durch das Verschmelzen von Aluminiumoxid und Metalloxiden gewonnen.
Weitere Aluminate sind die Calciumaluminate, die entweder durch Schmelzen von Aluminiumoxiden mit Kalk oder durch Reaktion von Natriumaluminat mit Kalkmilch entstehen:
Calciumaluminate können mit Anionen Salze bilden, beispielsweise mit Sulfaten unterschiedliche Calciumaluminatsulfate, je nach Reaktionsbedingungen Calciumaluminat-monosulfat oder Calciumaluminat-trisulfat, das auch als Ettringit-Mineral bekannt ist. Alle Calciumaluminate spielen in der Zementchemie eine wichtige Rolle.
Chromaluminat wird durch Erhitzen einer Mischung von Tonerde, Calciumfluorid und Ammoniumdichromat gewonnen und als Keramikfarbe eingesetzt.
Bariumaluminat wird aus Bauxit, Baryt und Kohle gewonnen und dient zum Reinigen industrieller Abwässer und als Kesselsteinlösungsmittel.
Bleialuminat entsteht beim Erhitzen einer Mischung von Bleiglätte und Tonerde, der als weißes, festes Pigment und zum Herstellen von Ziegeln und feuerfesten Auskleidungen verwendet wurde.[2]
Literatur
- Aluminate. In: Meyers Konversations-Lexikon. 4. Auflage. Band 1, Verlag des Bibliographischen Instituts, Leipzig/Wien 1885–1892, S. 429.
- Aluminate. In: Brockhaus Konversations-Lexikon 1894–1896, 1. Band, S. 482.
Einzelnachweise
- Erich Ammedick, Heinz Kadner: Lehrbuch der Chemie. 2. Auflage. 1974, S. 329, VLN 152-915/59/75.
- Eidgenössische Zollverwaltung: Kapitel 28: Anorganische chemische Erzeugnisse; anorganische oder organische Verbindungen von Edelmetallen, radioaktiven Elementen, Seltenerdmetallen oder Isotopen, abgerufen am 17. Juni 2017.