Luft
Als Luft bezeichnet man das Gasgemisch der Erdatmosphäre. Trockene Luft besteht hauptsächlich aus den zwei Gasen Stickstoff (rund 78,08 Vol.-%) und Sauerstoff (rund 20,95 Vol.-%). Daneben gibt es noch die Komponenten Argon (0,93 Vol.-%), Kohlenstoffdioxid (0,04 Vol.-%) und andere Gase in Spuren.
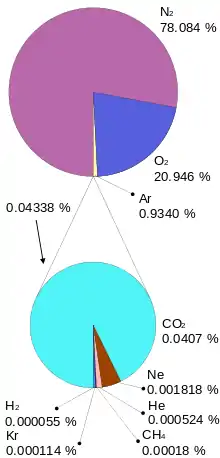
der Luft in Vol.-%
Feste und flüssige Teilchen, Aerosole genannt, sind ebenfalls Bestandteile von Luft. Wasser und Wasserdampf ist im Mittel zu 0,4 Vol.-% in der gesamten Erdatmosphäre enthalten. Diese Bestandteile werden separat aufgelistet.
Zusätzlich enthält Luft auch Staub und biologische Teilchen (z. B. Pollen, Pilz- und Farn-Sporen). Im natürlichen Zustand ist sie für Menschen geruch- und geschmacklos.
Die Dichte von Luft beträgt auf Meereshöhe als Faustregel etwa 1,25 kg/m3 – also nur 1/800 der von Wasser – und wird von Temperatur, Wasserdampfgehalt und Druck, der mit der Seehöhe abnimmt, bedeutend beeinflusst. In Druckluftflaschen mit einem Druck von typisch 0,5 bis 30 Megapascal (5 bis 300 bar) hat Luft bei 27 °C etwa die 5- bis 270-fache Dichte der Luft bei 0,1 Megapascal (grob Atmosphärendruck 1 bar auf Meereshöhe).[1]
Zusammensetzung
| Gas | Formel | Volumenanteil | Massenanteil |
|---|---|---|---|
| Hauptbestandteile der trockenen Luft auf Meereshöhe | |||
| Stickstoff | N2 | 78,084 %[2] | 75,518 % |
| Sauerstoff | O2 | 20,942 %[2] | 23,135 % |
| Argon | Ar | 0,934 %[2] | 1,288 % |
| Zwischensumme | 99,960 % | 99,941 % | |
| Gehalt an Spurengasen (eine Auswahl) | |||
| Kohlenstoffdioxid | CO2 | 0,040 % oder 400 ppm[3][4] | 0,059 % oder 590 ppm |
| Neon | Ne | 18,18 ppm[5] | 12,67 ppm |
| Helium | He | 5,24 ppm[5] | 0,72 ppm |
| Methan | CH4 | 1,85 ppm[4] | 0,97 ppm |
| Krypton | Kr | 1,14 ppm[5] | 3,30 ppm |
| Wasserstoff | H | ~500 ppb[5] | 36 ppb |
| Distickstoffoxid | N2O | 328 ppb[6] | 480 ppb |
| Kohlenstoffmonoxid | CO | 100–250 ppb[7] | 100–250 ppb |
| Xenon | Xe | 87 ppb[5] | 400 ppb |
| Dichlordifluormethan (CFC-12) | CCl2F2 | 520 ppt[6] | 2200 ppt |
| Trichlorfluormethan (CFC-11) | CCl3F | 234 ppt[6] | 1100 ppt |
| Chlordifluormethan (HCFC-22) | CHClF2 | 253 ppt[8] | 480 ppt |
| Tetrachlorkohlenstoff | CCl4 | 81 ppt[6] | 510 ppt |
| Trichlortrifluorethan (CFC-113) | C2Cl3F3 | 71 ppt[6] | 520 ppt |
| 1,1-Dichlor-1-fluorethan (HCFC-141b) | CCl2F-CH3 | 26 ppt[8] | 70 ppt |
| 1-Chlor-1,1-difluorethan (HCFC-142b) | CClF2-CH3 | 23 ppt[8] | 50 ppt |
| Schwefelhexafluorid | SF6 | 8 ppt[6] | 25 ppt |
| Bromchlordifluormethan | CBrClF2 | 4 ppt[9] | 25 ppt |
| Bromtrifluormethan | CBrF3 | 3,4 ppt[9] | 13 ppt |
| Gehalt an radioaktiven Stoffen | |||
| Radiokohlenstoff | 14CO2 | 10−13 % | |
| Radon | Rn | 10−19 % | |
| Gesamtmasse (trocken) | 100 % | 5,135 · 1015 t | |
| Wasser | +0,4 % | +0,013 · 1015 t | |
| Gesamtmasse (feucht) | 100,4 % | 5,148 · 1015 t | |
Die Anteile der Atmosphärengase sind keine Naturkonstanten. In der seit Jahrmilliarden andauernden Entwicklung der Erdatmosphäre veränderte sich die Zusammensetzung ständig und mehrmals grundlegend. Seit 350 Millionen Jahren sind die Hauptbestandteile weitgehend stabil. Die aktuelle Mischung ist für trockene Luft in der Tabelle rechts wiedergegeben, wobei zwischen Hauptbestandteilen und Spurengasen unterschieden wird. Die angegebenen Konzentrationen stellen globale Mittelwerte für die freie Troposphäre dar. Die der chemisch stabilen Komponenten sind abseits von Quellen in der gesamten Homosphäre einheitlich, also bis in eine Höhe von etwa 100 km. Bei reaktiven Spurenstoffen gibt es erhebliche Gradienten.
- Trennung in die Bestandteile
Tiefkalt verflüssigt kann Flüssige Luft durch fraktionierende Destillation in ihre Bestandteile zerlegt werden, dies erfolgt meist mit Hilfe des Linde-Verfahrens.
Stickstoff
Der Hauptbestandteil der Luft ist chemisch inert. Er wird durch die natürliche (biotische und abiotische) Stickstofffixierung organisch gebunden und damit für Lebewesen nutzbar. Technisch wird der Luftstickstoff über das Haber-Bosch-Verfahren zur Düngemittelherstellung verwendet. Der entgegengesetzte chemische Prozess – die Denitrifikation verläuft rascher, so dass der Stickstoffkreislauf den Stickstoffanteil in der Atmosphäre kaum verändert.
Aus dem Stickstoff der Luft entstehen durch kosmische Strahlung geringe Mengen radioaktiver Kohlenstoff (14C), was mit der Radiokarbonmethode für archäologische Datierungen ausgenutzt wird.
Sauerstoff
Der molekulare Sauerstoff der Luft ist hauptsächlich durch Photosynthese aus Wasser gebildet worden, wobei die im Laufe der Erdgeschichte hergestellte Menge etwa das Zwanzigfache der heute in der Atmosphäre vorliegenden Menge beträgt. Er verleiht der Atmosphäre ihren oxidierenden Charakter und stellt das wichtigste Oxidationsmittel dar, das für die biologische Atmung bzw. die chemischen Verbrennungsvorgänge benötigt wird.
Der in der Luft enthaltene Sauerstoff ist für alle aeroben Lebewesen zum Leben notwendig. Durch Atmung führen sie Sauerstoff ihrem Stoffwechsel zur Verbrennung (Katabolismus) zu. Pflanzen nutzen das in der Luft enthaltene Kohlenstoffdioxid zur Photosynthese und spalten dabei den Sauerstoff ab. Für fast alle Pflanzen ist dies die einzige Kohlenstoffquelle für vitale Prozesse und Körpersubstanz (Anabolismus). Bei diesem organischen Prozess wird fast der gesamte Luftsauerstoff der Luft regeneriert. Der Sauerstoffkreislauf ermöglicht die Aufrechterhaltung und Verteilung eines dauerhaften Vorrats an Ressourcen für Aerobier und photosynthetisch aktive Pflanzen.
Der gegenwärtige globale Luftsauerstoffgehalt bleibt mit einem Niveau von 20,946 ± 0,006 Vol. % bemerkenswert konstant, mit einem leichten Rückgang von 0,0004 Vol. %/Jahr (4 ppmv/a), der mit Kohlendioxid aus fossilen Brennstoffen und Biomasseverbrennung gegenkorreliert ist.[10][11]
Argon
Argon ist als Edelgas äußerst reaktionsträge und mit fast 1 % Gehalt relativ häufig. So ist es kostengünstig und wird als Inertgas etwa beim Metallschweißen und zur Füllung von Glühlampen eingesetzt. Dort und als Füllung von Mehrscheiben-Isolierglas nutzt man die relativ zu Luft etwas geringere Wärmeleitfähigkeit. (Teures, rares Krypton dient in Spezialfällen als noch besseres Wärme-Isoliergas.)
Argon entsteht langsam durch radioaktiven Zerfall von Kalium-40, ist stabil und dichter als Luft und verbleibt daher in der Atmosphäre.
Wasserdampf
Die Umgebungsluft ist nicht „trocken“, sondern enthält Wasser im gasförmigen Aggregatzustand (Wasserdampf), man spricht von Luftfeuchtigkeit. Der Wasserdampfgehalt schwankt zwischen einem zehntel Volumenprozent an den Polen und drei Volumenprozent in den Tropen, mit einem Mittelwert von 1,3 Vol.-% in Bodennähe. Da der Wasserdampfanteil die Dichte der Luft verringert, (62,5 % der Dichte „trockener“ Luft), wird feuchtere Luft nach oben gedrückt, wo dann in kühleren Schichten Kondensation auftritt, also der Wasserdampfgehalt im Gasgemisch sinkt. Oberhalb der Kondensationsschichten ist der Wasserdampfgehalt sehr gering, sodass über die gesamte Atmosphäre gemittelt nur 0,4 Vol.-% Wasserdampf in der Luft sind.
Spurengase
Größere Schwankungen über teils wenige Jahre und Jahrzehnte sind auch bei den Spurengasen zu verzeichnen. Deren niedrige Konzentrationen können durch vergleichsweise geringe Emissionen beeinflusst werden. Ebenso zeigen Vulkanausbrüche häufig einen kurzfristigen Einfluss.
Kohlenstoffdioxid
Nach seinem Anteil ist Kohlenstoffdioxid ein Spurengas, aber das – unter Berücksichtigung von Wasserdampf – fünfthäufigste Atmosphärengas. Wegen seiner Bedeutung für Klima und Lebewesen wird es oft zu den Hauptbestandteilen der Luft gerechnet.
Die biologische Hauptbedeutung des Kohlenstoffdioxids (umgangssprachlich oft als Kohlendioxid bezeichnet) liegt in seiner Rolle als Kohlenstofflieferant für die Photosynthese. Die atmosphärische Kohlenstoffdioxidkonzentration wirkt stark auf das Pflanzenwachstum. Durch den lichtabhängigen Stoffwechselzyklus der Pflanzen, also die Wechselbeziehung zwischen Atmung und Photosynthese, schwanken die bodennahen CO2-Konzentrationen im Tagesgang. Es zeigt sich bei ausreichender Pflanzendecke ein nächtliches Maximum und dementsprechend ein Minimum am Tag. Der gleiche Effekt ist im Jahresverlauf vorhanden, da die außertropische Vegetation ausgeprägte Vegetationsperioden besitzt. Auf der Nordhalbkugel besteht ein Maximum im Zeitraum März bis April und ein Minimum im Oktober oder November. Dazu trägt auch die Heizperiode durch erhöhten Verbrauch fossiler Brennstoffe bei.
Insgesamt hat der Kohlenstoffdioxidgehalt seit Beginn der Industrialisierung um über 40 % zugenommen. Dies ist im Zusammenhang mit dem anthropogenen Treibhauseffekt eine der Ursachen für die globale Erwärmung, für die ein Referenzwert im erdgeschichtlichen Klima von weniger als 100 Jahren gilt. 2013 überstieg die CO2-Konzentration an der Messstation Mauna Loa erstmals den Wert von 400 ppm.[12]
Edelgase
Während Argon mit rund 1 % zu den Hauptbestandteilen der Luft gehört (siehe oben), zählen die weiteren Edelgase Neon, Helium und Krypton mit Volumenanteilen von jeweils > 1 ppm zu den Spurengasen (vgl. Tabelle). Noch seltener ist Xenon (Volumenanteil < 0,1 ppm). Radon ist das seltenste Edelgas in der Luft (mittlerer Volumenanteil 1:1021), kann jedoch – isotopenabhängig – über seine Radioaktivität gut bestimmt werden.
Helium wird bei jedem radioaktiven Alpha-Zerfall frei. Helium ist viel leichter als Luft und entweicht in den Weltraum. Auch das zweitleichteste Edelgas Neon verflüchtigt sich dorthin, so dass von diesen beiden nur Spuren in der Atmosphäre vorkommen.
Aus manchem Gestein dringt als Glied radioaktiver Zerfallsreihen Radon, das sich in Kellern anreichern kann (siehe Radonbelastung) und strahlend weiterzerfällt.
Ozon
Für die Stratosphäre werden Ozonwerte oftmals nicht in Anteilen, sondern in der Dobson-Einheit angegeben. Da die Werte zudem von der Höhe (Ozonschicht, bodennahes Ozon) sowie von Wetterlage, Temperatur, Schadstoffbelastung und Uhrzeit abhängen und Ozon sich sowohl schnell bildet als auch wieder zerfällt, ist dieser Wert sehr variabel. Aufgrund der hohen Reaktivität von Ozon spielt es bei chemischen Reaktionen vielfältiger Art in der Atmosphäre eine zentrale Rolle. Ein Beispiel sind die ODEs (ozone depletion events), bei denen während des polaren Frühlings regelmäßig starke Einbrüche in der Ozonkonzentration von normalerweise 20–40 ppb auf < 5 ppb beobachtet werden können. Diese Erscheinungen werden beispielsweise durch die Freisetzung von Halogenen durch natürliche Prozesse oder durch Mischung von Luftmassen bewirkt. Typische Ozonkonzentrationen in gemäßigten Breiten und besiedeltem Gebiet sind 30–60 ppb auf der Nordhalbkugel und tendenziell ca. 10 ppb weniger auf der Südhalbkugel aufgrund der Rolle von Ozon in der Stickoxidchemie.
Kohlenstoffmonoxid
Kohlenstoffmonoxid (umgangssprachlich oft als Kohlenmonoxid bezeichnet) ist ein unsichtbares brennbares giftiges Gas, das bei der unvollständigen Verbrennung von kohlenstoffhaltigen Substanzen entsteht. Es blockiert den Sauerstofftransport im Blut (Kohlenstoffmonoxidintoxikation) und kann schon in geringen Dosen zum Tod führen. Auch schädigt es die Photosynthese der Pflanzen. Es bildet sich z. B. beim Tabakrauchen und im Verbrennungsmotor. Auto- und Flugabgase ohne Abgasnachbehandlung durch einen Fahrzeugkatalysator können bis zu 4 % CO enthalten, der Standardwert für Tabakrauch. Brände der Vegetation sind mit ca. 60 % der Emissionen weltweit Hauptquelle für Kohlenstoffmonoxid.
Weitere Spurengase (Auswahl)
- Methan
- Wasserstoff
- Distickstoffoxid und andere Stickoxide
- Hydroxyl-Radikal
- Peroxyacetylnitrat
- Chloroxide, Iodoxide und Bromoxide und molekulares Iod
- Schwefeldioxid, neben anthropogenen Quellen hauptsächlich aus Dimethylsulfid und Vulkanen.
- organische Verbindungen, die oftmals durch Oxidation oder Photolyse aus längerkettigen organischen Verbindungen entstehen (beispielsweise pflanzliche Pinene, Formaldehyd und Glyoxal)
- halogenierte Kohlenwasserstoffe biogener und anthropogener Natur
Physikalische Größen der Luft
| Temperatur [°C] |
Schall- geschwindigkeit [m/s] |
Schall- kennimpedanz [N·s/m3] |
Luftdichte [kg/m3] |
|---|---|---|---|
| −10 | 325,4 | 436,6 | 1,341 |
| −5 | 328,5 | 432,5 | 1,317 |
| 0 | 331,5 | 428,5 | 1,293 |
| +5 | 334,5 | 424,6 | 1,270 |
| +10 | 337,5 | 420,8 | 1,247 |
| +15 | 340,5 | 417,1 | 1,225 |
| +20 | 343,4 | 413,5 | 1,204 |
| +25 | 346,3 | 410,0 | 1,184 |
| +30 | 349,2 | 406,6 | 1,164 |
Mittlere Molmasse
Die mittlere Molmasse ergibt sich als Summe der Produkte der Molmassen und Stoffmengenanteile der Bestandteile, hauptsächlich Sauerstoff, Stickstoff und Argon. Für trockene Luft ist der exakte Wert 28,949 g/mol.[5] Enthält die Luft noch Feuchtigkeit, ist die mittlere Molmasse geringer, da die Molmasse von Wasserdampf nur ca. 18 g/mol beträgt.
Luftdichte
Unter Normalbedingungen ist die Luftdichte gleich 1,293 kg/m3.[13]
Luftdruck
Die Gewichtskraft der Luftsäule erzeugt einen statischen Druck. Dieser Druck hängt gemäß der barometrischen Höhenformel von der Höhe über dem Meeresspiegel ab. Zusätzlich ist der Luftdruck vom Wetter abhängig. Wind und allgemein Änderungen des Wetters bewirken Schwankungen des Luftdrucks. Ein Barometer zur Messung des Luftdrucks gehört daher zur Grundausstattung von Wetterstationen. Über einem Quadratmeter Bodenfläche beträgt die Luftmasse dem Luftdruck entsprechend etwa 10.000 kg.
Lufttemperatur
Als Lufttemperatur wird die Temperatur der bodennahen Luft bezeichnet, die weder von Sonnenstrahlung noch von Bodenwärme oder Wärmeleitung beeinflusst ist. Die genaue Definition in Wissenschaft und Technik ist unterschiedlich. In der Meteorologie wird die Lufttemperatur in einer Höhe von zwei Metern gemessen, wofür häufig weiß gestrichene Wetterhäuschen in freier Umgebung dienen.
Luftfeuchtigkeit
Bei der Luftfeuchtigkeit handelt es sich um den Anteil des Wasserdampfes an der Luft. Sie wird über verschiedene Feuchtemaße wie Dampfdruck und Taupunkt sowie relative, absolute und spezifische Luftfeuchte angegeben.
Weitere Werte
Unter Normalbedingungen ist die Schallgeschwindigkeit in Luft gleich 331,5 m/s.
Der Brechungsindex der Luft beträgt unter Normalbedingungen für sichtbares Licht ungefähr 1,00029. Der Wert hängt von Druck, Temperatur und Zusammensetzung der Luft ab, vor allem aber von der Luftfeuchtigkeit. Weil ungefähr proportional zum Luftdruck ist, lässt sich der Brechungsindex mit einem Michelson-Interferometer bestimmen, dessen einer Arm durch ein Gebiet mit variablem Luftdruck reicht. Aus der entstehenden optischen Weglängendifferenz bestimmt man mit bekanntem Druckunterschied den Brechungsindex.
Spezifische Wärmekapazität unter Normalbedingungen:
Die Wärmeleitfähigkeit von Luft ist unter Normalbedingungen .

Lichtstreuung
Die in Luft vorkommenden Gasmoleküle (Stickstoff, Sauerstoff usw.) streuen das einfallende Sonnenlicht, abhängig von seiner Wellenlänge, verschieden stark (Rayleigh-Streuung). Am stärksten wird das kurzwellige blaue Licht gestreut. Dieser Vorgang gibt der Luft ihre typischerweise natürliche blaue Farbe, ein teil-polarisiertes Muster. Ist der Weg des Lichtes durch die Luft länger, verschiebt sich die Streuung zu einem rötlichen Farbton hin. Dies hängt vom Sonnenlichteinfallswinkel ab. Steht die Sonne im Zenit (direkt über dem Betrachter −90° zum Boden), durchläuft das Licht die Erdatmosphäre auf einer Länge von 90 km. Während eines Sonnenaufgangs /-abgangs steht die Sonne am Horizont (in horizontaler Augenlinie des Betrachters −0° zum Boden) und durchquert die Atmosphäre mit einer ca. 12-fachen Länge (ca. 1075 km). Mit fortschreitender Strecke des Lichtes durch die Atmosphäre wird der blaue vom roten Lichtanteil überlagert, da der Blauanteil immer mehr gestreut wird und der rote Anteil wegen seiner größeren Wellenlänge weniger stark gestreut wird. Dieser atmosphärische Effekt ist bei überwiegend wolkenlosem Horizont morgens und abends zu beobachten. Er wird als Morgenröte bzw. Abendrot bezeichnet und reicht in den Farbabstufungen von leichtem Rosa bis Lila über Vollrot zu tiefem Orange.
Abgesehen von elastischer Streuung der Photonen ist in der Atmosphäre auch inelastische Streuung zu beobachten: Rotationsramanstreuung führt zu einer Umverteilung in den Energien der eintreffenden Strahlung innerhalb von einigen 10 cm−1 und führt somit zu einem „Auffüllen“ der Fraunhoferlinien,[14] den sogenannten Ring-Effekt.[15] Bei einer spektralen Auflösung von 0,5 nm führt dieser Effekt zu optischen Dicken von typischerweise bis zu 2 %, wenn Himmelsstreulicht verschiedener Sonnenstände verglichen wird. Dieser Effekt muss in verschiedenen DOAS Fernerkundungsmethoden zur Messung von Spurengasen korrigiert werden.
Weiterhin kann Vibrationsramanstreuung an Luftmolekülen die Wellenzahl der eintreffenden Photonen von 1550 cm−1(O2) und 2330 cm−1(N2) verschieben und somit ein wellenlängenverschobenes Abbild des Sonnenlichts über das beobachtete Sonnenlicht legen. Seine Intensität beträgt bis zu 0,04 % der ursprünglichen Intensität.[16]
Luftverunreinigung und Luftreinhaltung
Die Luftverschmutzung ist der auf die Luft bezogene Teilaspekt der Umweltverschmutzung. Gemäß dem Bundes-Immissionsschutzgesetz ist Luftverunreinigung eine Veränderung der natürlichen Zusammensetzung der Luft, insbesondere durch Rauch, Ruß, Staub, Aerosole, Dämpfe oder Geruchsstoffe. Von Bedeutung sind erhöhte Ozonwerte für den Smog und Schwefeldioxidkonzentrationen für den sauren Regen, aber auch Konzentrationen von Stickoxiden und flüchtigen organischen Verbindungen, die ihrerseits wiederum einen großen Einfluss auf die Chemie der Luft haben.
In den meisten Industrieländern ist die lokale Luftverschmutzung aufgrund von gesetzlichen Vorgaben zur Luftreinhaltung in den letzten Jahrzehnten stark zurückgegangen. Gleichzeitig hat der Ausstoß von Treibhausgasen wie Kohlenstoffdioxid weiter zugenommen. Die lokale und regionale Luftverschmutzung ist für Länder der Dritten Welt sowie Schwellenländer wie China noch ein erhebliches Problem.
Die Effekte von Spurengasen sind vielfältig und beeinflussen sich in großem Maße auch gegenseitig. Beispielsweise spielt Ozon durch seine Rolle in der Hydroxylradikalchemie in bodennahen Luftschichten nicht nur die Rolle eines Schadstoffs und Treibhausgases, es ist essentiell für die Selbstreinigungsmechanismen der Atmosphäre insgesamt.[17]
Besonders viel Mikroplastik wurde in der Luft von London nachgewiesen.[18] Auch Pestizide sind in der Luft nachweisbar und werden über weite Distanzen verweht.[19]
Kulturelle Bedeutung
Die griechischen Naturphilosophen hielten Luft für eines der vier Grundelemente, aus denen alles Sein besteht. Dem Element Luft wurde der Oktaeder als einer der fünf platonischen Körper zugeordnet. Der Asteroid des mittleren Hauptgürtels (369) Aëria ist nach Luft benannt.[20]
Literatur
- Horst Stöcker: Taschenbuch der Physik. Verlag Harri Deutsch, Frankfurt am Main 2007, ISBN 978-3-8171-1720-8.
- Robert Boyle: The general history of the air. Hrsg. und fertiggestellt von John Locke. Awnsham and John Churchill, London 1692.
Weblinks
Einzelnachweise
- Komprimierbarkeit von Luft als reales Gas: Perry's chemical engineers' handbook, 6. Auflage, McGraw-Hill, 1984, ISBN 0-07-049479-7, S. 3-162.
- Elizabeth Kay Berner, Robert A. Berner: Global Environment Water, Air, and Geochemical Cycles. Princeton University Press, 2012, ISBN 978-0-691-13678-3, S. 25 (eingeschränkte Vorschau in der Google-Buchsuche).
- World Meteorological Organization: Greenhouse gas concentrations in atmosphere reach yet another high | World Meteorological Organization, abgerufen am 26. November 2019
- Deutscher Wetterdienst: Wetter und Klima - Klimagase (CO2, CH4, N2O), abgerufen am 26. November 2019
- Detlev Möller: Luft: Chemie, Physik, Biologie, Reinhaltung, Recht. Walter de Gruyter, 2003, ISBN 3-11-016431-0, S. 173. (Vorschau bei Google Books) (abgerufen am 27. März 2012).
- Bullister, J.L. (2017). Atmospheric Histories (1765-2015) for CFC-11, CFC-12, CFC-113, CCl4, SF6 and N2O (NCEI Accession 0164584). NOAA National Centers for Environmental Information. Unpublished Dataset. doi: 10.3334/CDIAC/otg.CFC_ATM_Hist_2015., abgerufen am 26. November 2019
- Deutscher Wetterdienst: Wetter und Klima - Kohlenmonoxid (CO), abgerufen am 26. November 2019
- Pingyang Li, Jens Mühle u. a.: Atmospheric histories, growth rates and solubilities in seawater and other natural waters of the potential transient tracers HCFC-22, HCFC-141b, HCFC-142b, HFC-134a, HFC-125, HFC-23, PFC-14 and PFC-116. In: Ocean Science. 15, 2019, S. 33, doi:10.5194/os-15-33-2019.
- Martin K. Vollmer, Jens Mühle u. a.: Atmospheric histories and global emissions of halons H-1211 (CBrClF ), H-1301 (CBrF ), and H-2402 (CBrF CBrF ) . In: Journal of Geophysical Research: Atmospheres. 121, 2016, S. 3663, doi:10.1002/2015JD024488.
- Jianping Huang, Jiping Huang u. a.: The global oxygen budget and its future projection. In: Science Bulletin. 63, 2018, S. 1180, doi:10.1016/j.scib.2018.07.023.
- Duursma Ek, Boisson Mprm (1994). Global oceanic and atmospheric oxygen stability considered in relation to the carbon-cycle and to different time scales. Oceanologica Acta, 17(2), 117-141. Open Access version : https://archimer.ifremer.fr/doc/00099/21024/
- The Keeling Curve A daily record of atmospheric carbon dioxide
- Stöcker 2007, S. 714.
- M. Vountas, V. V. Rozanov, J. P. Burrows: Ring effect: Impact of rotational Raman scattering on radiative transfer in Earth’s atmosphere. In: Journal of Quantitative Spectroscopy and Radiative Transfer. 60.6, 1998, S. 943–961.
- J. F. Grainger, J. Ring: Anomalous Fraunhofer line profiles. In: Nature. 193, 1962, S. 762.
- Derek Albert Long: Raman spectroscopy. McGraw-Hill, New York 1977, ISBN 0-07-038675-7.
- John H. Seinfeld, Spyros N. Pandis: Atmospheric chemistry and physics: from air pollution to climate change. John Wiley & Sons, 2012.
- Damian Carrington: Revealed: microplastic pollution is raining down on city dwellers. In: theguardian.com. 27. Dezember 2019, abgerufen am 28. Dezember 2019 (englisch).
- Tina Berg: Pestizide: Gefahr in der Luft. In: beobachter.ch. 27. März 2019, abgerufen am 13. April 2019.
- Lutz D. Schmadel: Dictionary of Minor Planet Names. Fifth Revised and Enlarged Edition. Hrsg.: Lutz D. Schmadel. 5. Auflage. Springer Verlag, Berlin, Heidelberg 2003, ISBN 978-3-540-29925-7, S. 186 (englisch, 992 S., link.springer.com [ONLINE; abgerufen am 24. Oktober 2019] Originaltitel: Dictionary of Minor Planet Names. Erstausgabe: Springer Verlag, Berlin, Heidelberg 1992): “Discovered 1893 July 4 by A. Borrelly at Marseilles.”