Natriumcarbonat
Natriumcarbonat (fachsprachlich; standardsprachlich Natriumkarbonat) Na2CO3, wasserfrei auch calciniertes Soda, reines Soda[9] oder Waschsoda genannt, ist ein Salz der Kohlensäure. Als Lebensmittelzusatzstoff trägt es das Kürzel E 500i.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
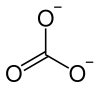 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Natriumcarbonat (wasserfrei) | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | Na2CO3 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses kristallines Pulver[4] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 105,99 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[4] | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
1600 °C (Zersetzung)[5] | |||||||||||||||||||||
| Löslichkeit |
gut in Wasser (217 g·l−1 bei 20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−1130,7 kJ/mol[8] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen
Es kommt als Mineral Natrit in Sodaseen in Ägypten, der Türkei (Van-See), Ostafrika (z. B. Lake Natron und andere Seen des Ostafrikanischen Grabens), Kalifornien, Mexiko und als Trona [Na(HCO3) · Na2CO3 · 2H2O] in Wyoming (USA), Mexiko, Ostafrika und in der südlichen Sahara vor.
Wasserfreies Natriumcarbonat kommt in Natrokarbonatit-Vulkanen (z. B. dem Ol Doinyo Lengai) als Mineral Gregoryit im Ergussgestein vor, wandelt sich aber bei Kontakt mit Regenwasser sehr schnell zu Soda um.
Geschichte der Sodaherstellung
Zunächst wurde natürliches Soda aus Mineralien zum Beispiel an Salzseen gewonnen, am bekanntesten schon vor 4000 Jahren in Ägypten das Natron als Mischung von Natriumcarbonat und Natriumhydrogencarbonat, das zur Glasgewinnung genutzt wurde. Später wurde Soda (genannt auch Aschensalz) auch durch Einäscherung von getrockneten Pflanzen aus Salzsteppen oder vom Meeresstrand (mit besonders hohem Natriumgehalt) besonders im Mittelmeerraum gewonnen. Das Verfahren war ähnlich wie bei Pottasche aus Landpflanzen, die im Fall von Pottasche aber überwiegend Kalium enthielten. Einige der besten Sorten kamen aus Alicante und wurden Barilla genannt, was sich später allgemein auf Pflanzensoda übertrug.
Die Entwicklung von künstlichem Soda insbesondere zur Seifenherstellung begann mit der analytischen Unterscheidung von Soda und Pottasche durch Henri Louis Duhamel du Monceau um 1730.[10] Außerdem zeigte er, dass man prinzipiell Soda aus Kochsalz herstellen konnte. Kochsalz war als Ausgangsmaterial jedoch zu teuer und zu hoch besteuert. Nach einem geeigneten Herstellungsverfahren wurde weiter geforscht. Duhamel stellte schon Glaubersalz (Natriumsulfat) her und zeigte, dass man daraus Soda herstellen kann. Die Methode wurde durch Andreas Sigismund Marggraf in Berlin verbessert. Karl Wilhelm Scheele gewann 1772 Soda durch Erhitzen von Sole mit Bleioxid in kleinen Mengen, was auch schon bei einigen Fabrikanten Anwendung fand. 1775 wurde ein Preis der französischen Akademie der Wissenschaften für die Sodaherstellung ausgelobt, der die Beschäftigung mit dem Problem beförderte (er wurde nie ausbezahlt). 1777 benutzte Joseph François Malherbe in Frankreich industriell Glaubersalz, um Soda herzustellen. Jean-Antoine Chaptal produzierte nach dem Verfahren in Montpellier (nach 1780) und P. L. Athénas in Javier bei Paris. 1789 schlug Jean-Claude Delamétherie vor, Glaubersalz mit Kohle zu glühen, das Ergebnis mit Essigsäure zu behandeln und daraus Soda zu glühen, was zwar nicht praktikabel war[11], aber anregend auf den Arzt Nicolas Leblanc wirkte, der sich schon mehrere Jahre damit befasst hatte. Diesem gelang 1789 der eigentliche Durchbruch mit dem Leblanc-Verfahren. 1791 eröffnete er im Auftrag des Herzogs von Orléans eine Fabrik, er wurde aber durch die Französische Revolution um die Früchte seiner Entdeckung gebracht (er beging 1806 verarmt Suizid). Da er sich mit dem Herzog von Orléans zusammengetan hatte, wurde das Verfahren mit diesem enteignet, die Fabrik 1794 geschlossen und das Verfahren unentgeltlich zur Verfügung gestellt. 1806 entstand bei Paris eine Sodafabrik nach dem Verfahren und im 19. Jahrhundert entstanden bald vielfach in Frankreich, Deutschland (Hermania in Schönebeck bei Magdeburg 1843 und bald darauf die Chemische Fabrik Rhenania in Aachen) und England weitere Fabriken nach dem Verfahren. Die Fabriken lieferten nicht nur Soda, sondern auch Salzsäure, Alkalimetalle und Chlor. In der zweiten Hälfte des 19. Jahrhunderts wurde es durch das 1860 entwickelte Solvay-Verfahren verdrängt.
Gewinnung und Herstellung
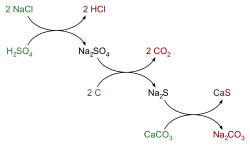
- Durch Abbau natürlich vorkommender natriumcarbonathaltiger Minerale (s. o.): Wegen ihrer vielfältigen Verunreinigungen werden die Ausgangsminerale vor dem Transport und der Weiterverwendung umkristallisiert und anschließend in gereinigtes, kristallwasserfreies Soda überführt (z. B. mit Hilfe des Trona-Verfahrens, benannt nach dem gleichnamigen Ausgangsmineral).
- Nach dem Leblanc-Verfahren (seit 1791): Technisches Natriumchlorid wird mit heißer Schwefelsäure zu Chlorwasserstoffgas und Natriumsulfat umgesetzt, das als „Salzkuchen“ zurückbleibt und im nächsten Schritt mit Calciumcarbonat und Kohle zu Natriumcarbonat, Kohlenstoffdioxid und Calciumsulfid reagiert. Nachdem dieses Verfahren zur Herstellung von Natriumcarbonat durch das Solvay-Verfahren abgelöst wurde, wird es heute nicht mehr eingesetzt, besitzt jedoch weiter große historische Bedeutung, da mit ihm die Entwicklung der chemischen Großindustrie begann.
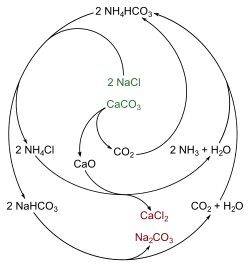
- Nach dem Solvay-Verfahren (auch Ammoniak-Soda-Verfahren, seit 1863): Einleiten von Ammoniak und Kohlendioxid in eine gesättigte Natriumchlorid-Lösung und Erhitzen des so entstandenen Natriumhydrogencarbonates im Drehrohrofen.
- Das entstandene Kohlenstoffdioxid sowie der Ammoniak aus der Reaktion des Ammoniumchlorides mit Calciumoxid oder Calciumhydroxid werden dabei wieder in den Prozess zurückgeführt, was diesen sehr wirtschaftlich (und so zu einem der ersten in großem Stil praktizierten chemischen Kreisprozesse) machte.
- Einleiten von Kohlenstoffdioxid in Natronlauge (technisch unbedeutend):
Eigenschaften
Modifikationen und Hydrate

Natriumcarbonat ist polymorph, kristallisiert also in Abhängigkeit von Druck und Temperatur bei gleicher chemischer Zusammensetzung in verschiedenen Kristallstrukturen. Es existieren auch Hydrate, die Kristallwasser enthalten.[12]
- Wasserfrei, Na2CO3
- Bekannt als Mineral Natrit oder unter der Bezeichnung reine oder calcinierte Soda, weiße Substanz mit einem Schmelzpunkt von 854 °C und einer Dichte von 2,51 g/cm3. Bildet sich bei Temperaturen größer 107 °C.
- Monohydrat, Na2CO3 · H2O
- Bekannt als Mineral Thermonatrit, bildet sich bei Temperaturen > 35,4 °C aus dem Heptahydrat.
- Heptahydrat, Na2CO3 · 7 H2O
- Bildet sich bei Temperaturen oberhalb 32,5 °C aus dem Decahydrat.
- Decahydrat, Na2CO3 · 10 H2O
- Bekannt als Mineral Soda oder unter der Bezeichnung Kristallsoda, kristallisiert bei unter 32,5 °C aus gesättigten Natriumcarbonat-Lösungen aus (Dichte 1,45 g/cm3).
Darüber hinaus findet sich Natriumcarbonat zusammen mit Natriumhydrogen- beziehungsweise Calciumcarbonat in der Natur in folgenden Mineralen:
Chemische Eigenschaften

Als Natriumsalz der schwachen Kohlensäure reagiert es mit stärkeren Säuren unter Bildung von Kohlenstoffdioxid (Aufschäumen). In Wasser löst Natriumcarbonat sich unter Wärmeentwicklung (Hydratationswärme). Eine stark alkalische Lösung entsteht, da das Carbonat-Anion als Base mit einem Proton aus dem Dissoziationsgleichgewicht des Lösungsmittels Wasser zum Hydrogencarbonation (HCO3−) reagiert und eine entsprechend hohe Hydroxidionenkonzentration entsteht:
- Dissoziationsgleichgewicht des Carbonations in Wasser.
Vor der Verfügbarkeit größerer Mengen von Natriumhydroxid war Natriumcarbonat damit die wichtigste Base, da es sich in Wasser gelöst verhält wie eine Mischung aus Natriumhydrogencarbonat und Natriumhydroxid: Eine Lösung von 50 g Natriumcarbonat pro Liter Wasser weist einen pH-Wert von 11,5 auf.[5]
- Reaktion von Natriumcarbonat und Wasser.
Die Standardbildungsenthalpie von Natriumcarbonat beträgt ΔfH0298 = −1131,7 kJ·mol−1,[13] die Freie Standardbildungsenthalpie ΔG0298 = −1048,4 kJ·mol−1,[13] und die molare Standardentropie S0298 = 136,1 J·K−1 ·mol−1.[13]
Lagerung
Kristallsoda muss gut verschlossen oder in feuchter Atmosphäre gelagert werden, da es an trockener Luft Kristallwasser abgibt und in ein weißes Pulver zerfällt.
Umgekehrt muss man calcinierte, d. h. wasserfreies Soda in trockener Atmosphäre aufbewahren, da sie – ohne dadurch sofort feucht auszusehen – leicht Feuchtigkeit aus der Luft aufnimmt und mit dieser in das Monohydrat Na2CO3 · H2O übergeht (Hygroskopie).
Verwendung
Natriumcarbonat wird seit langer Zeit durch den Menschen genutzt. Schon die alten Ägypter setzten es zum Mumifizieren ein („Nitron“).[14] Ebenso fand es seit dem Altertum Verwendung als Reinigungsmittel und bei der Glasherstellung. Heute wird Natriumcarbonat von fast allen Industriezweigen eingesetzt und ist damit eines der vielseitigsten chemischen Produkte.
Natriumcarbonat wird in der Lebensmitteltechnik als Säureregulator, Aufschlussmittel oder Trägerstoff eingesetzt. Zusammen mit Natriumhydrogencarbonat ist es in der EU als Lebensmittelzusatzstoff unter der Nummer E 500 ohne Höchstmengenbeschränkung (quantum satis) für alle Lebensmittel allgemein zugelassen und darf nach EG-Öko-Verordnung auch in ökologisch erzeugten Lebensmitteln zugesetzt werden.[1]
Weltweit wurden 1997 ca. 39 Millionen Tonnen Soda produziert. In Deutschland betrug das Marktvolumen 1999 ca. 2,4 Millionen Tonnen. Der größte Anteil an Soda wird dabei von den folgenden fünf Industriebranchen verbraucht:
- Die Glasindustrie verwendet Soda als Rohstoff für ihre Glasschmelzen und ist damit der größte Sodaverbraucher. Soda fungiert dabei als Flussmittel[15], das in der erstarrenden Glasschmelze deren Auskristallisieren verhindert und dadurch das Glas amorph hält. Der Anteil an Soda bestimmt dabei die Fließfähigkeit der Schmelze.
- Die chemische Industrie setzt Soda zur Herstellung von Bleichmitteln, Borax, Chromaten wie Natriumchromat und Natriumdichromat, Farben, Füllstoffen, Gerbereihilfen, Industriereinigern, Kryolith, Leim- und Klebstoffen, Metallcarbonaten, Natronsalpeter, Perborat, Natriumphosphaten wie zum Beispiel Pentanatriumtriphosphat, Silikaten (Wassergläser) wie zum Beispiel Natriummetasilikat-Pentahydrat und Natriumorthosilikat, Sulfit, Ultramarinfarben, Wasserglas u. a. Chemikalien ein.
- In der Eisenhüttenindustrie wird Soda zur Entschwefelung von Roheisen, Gusseisen und Stahl sowie als Flotations- und Flussmittel verwendet.
- In der Waschmittel- und Seifenindustrie werden mit Soda Grobwaschmittel und andere Reinigungsmittel hergestellt sowie Fette verseift. Früher wurde Soda zu diesem Zweck kaustifiziert, d. h. mit Calciumoxid oder -hydroxid zu Ätznatron umgesetzt.
- In der Papier- und Zellstoffindustrie dient Soda sowohl zum Aufschluss, zur Neutralisation, zum Reinigen und Bleichen als auch zur Aufarbeitung von Altpapier.
- Weitere Anwendungen:
- Lederindustrie
- Wasserreinigung
- Innere Speisewasseraufbereitung bei Dampfkesseln
- Keramik- und Emailleherstellung
- Textilindustrie
- Rauchgasentschwefelung
- Urtitersubstanz nach Arzneibuch
- Entgiftung von Nervenkampfstoffen
- pH-Wert-Anhebung von Trinkwasser[1] sowie in Schwimmbädern („pH-Plus Pulver“ und Granulat ist meist Natriumcarbonat)
- Zusatz zu Entwicklerlösungen
Weblinks
Einzelnachweise
- Natriumcarbonate, E 500, In: Lebensmittellexikon.de
- Eintrag zu E 500: Sodium carbonates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 11. August 2020.
- Eintrag zu SODIUM CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Eintrag zu Natriumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Natriumcarbonat (PDF) bei Merck, abgerufen am 18. März 2012.
- Ray E. Bolz: CRC Handbook of Tables for Applied Engineering Science. CRC Press, 1973, ISBN 978-0-8493-0252-7, S. 482 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Sodium carbonate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- Erläuterung der Unterschiede zwischen Soda und Natron, abgerufen im Juni 2016.
- Otto Krätz, Anfänge der technischen Chemie, in: Armin Hermann, Charlotte Schönbeck, Technik und Wissenschaft, VDI Verlag 1991, S. 308.
- Bernhard Neumann (Hrsg.), Lehrbuch der Chemischen Technologie und Metallurgie, Band 1, Springer 1939, S. 364.
- Arnold F. Holleman, Egon Wiberg: Lehrbuch der anorganischen Chemie. Walter de Gruyter, 1995, ISBN 978-3-11-012641-9, S. 1182 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. E. Dickerson, H. B. Gray, H.-W. Sichting, M. Y. Darensbourg: "Prinzipien der Chemie", Verlag Walter de Gruyter 1988, ISBN 9783110099690, S. 976. (eingeschränkte Vorschau in der Google-Buchsuche)
- Hermann Schelenz: Geschichte der Pharmazie. Springer-Verlag. Berlin, Heidelberg. 1904. S. 41. ISBN 978-3-642-52552-0.
- Eintrag zu Flußmittel. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. März 2011.
