Hall-Héroult-Prozess
Der Hall-Héroult-Prozess ist ein Verfahren zur Herstellung reinen Aluminiums aus Aluminiumoxid in einer Aluminiumhütte. Das aus dem Bayer-Verfahren gewonnene Ausgangsmaterial Aluminiumoxid wird in Kryolith gelöst und dann das reine Aluminium per Schmelzflusselektrolyse hergestellt.[1]
Geschichte
1886 haben Charles Martin Hall und Paul Héroult dieses Verfahren etwa gleichzeitig unabhängig voneinander erfunden. Dieses Verfahren wird – mit einigen Verbesserungen – noch heute industriell angewandt.
Verfahren
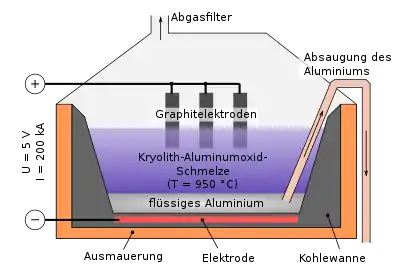

Vor dem Arbeitsschritt der eigentlichen Elektrolyse wird das Aluminiumoxid (Schmelztemperatur 2045 °C) mit Kryolith (Na3[AlF6]) vermischt, um die Schmelztemperatur zu senken. Das entstehende zu 80 bis 90 Prozent aus Kryolith bestehende Gemisch hat eine Schmelztemperatur von nur noch etwa 950 °C. Dadurch wird die erforderliche Arbeitstemperatur erheblich verringert, was die Schmelzflusselektrolyse überhaupt erst ermöglicht.[2]
Die Arbeitstemperaturen werden aufrechterhalten, weil aufgrund des elektrischen Widerstands der Schmelze diese gleichzeitig wie eine Widerstandsheizung arbeitet und die Nachschubwärme für das Aufschmelzen liefert.[3][4] Beim Prozess geht laufend Wärme verloren:
- durch die abkühlend wirkende endotherme Reaktion der Reduktion (Reaktionsenthalpie),
- durch Absaugen des flüssigen heißen Aluminiums (Abrinnen nach dem Saugheberprinzip),
- weil die entstehenden Reaktionsgase als heißes Abgas abziehen.
Die Reduktion von Aluminiumoxid erfolgt in der Schmelzflusselektrolyse (kurz auch Schmelzelektrolyse). Die Elektrolysezelle besteht aus einer Stahlwanne, die mit Kohlenstoffmaterial (Graphit / Anthrazit) ausgekleidet ist. In dieser Wanne befindet sich der flüssige Elektrolyt (Kryolith mit einem Überschuss an AlF3). In den Elektrolyten tauchen von oben die Anoden (aus Petrolkoks gebrannte Graphit-Blöcke) ein, die an den positiven Pol einer Spannungsquelle angeschlossen sind. Die Kathodenwanne dagegen ist mit dem negativen Pol verbunden.[5] In der Schmelze liegt das Aluminiumoxid in seine Ionen dissoziiert vor.
Durch eine Spannung von 4 bis 5 Volt und einer Stromstärke bis zu 330.000 Ampere (einer Stromdichte von 8.000 Ampere/Quadratmeter) wird das Aluminiumoxid (Al2O3) mit Hilfe der Gleichstromquelle zerlegt. Die hohe Stromstärke ist notwendig, um nennenswerte Mengen an Aluminium großtechnisch zu produzieren, denn gemäß den Faradayschen Gesetzen ist die Gewichtsmenge eines elektrolytisch gebildeten Stoffs proportional zu der geflossenen elektrischen Ladung. Zudem benötigt die Aufheizung gemäß dem Ohmschen Gesetz solch hohe Stromstärken.
Die in der Schmelze befindlichen positiv geladenen Aluminiumionen Al3+ wandern zur Kathode (Minuspol). Dort nehmen sie Elektronen auf und werden zu Aluminiumatomen reduziert.
Die negativen Sauerstoffionen O2− wandern zur Anode (Pluspol). Dort geben sie ihre überschüssigen Elektronen ab, wobei sie mit dem Kohlenstoff der Graphitanode zu Kohlenmonoxid und Kohlendioxid reagieren, die dann als Gase entweichen.[5]
Das entstehende flüssige Aluminium hat eine größere Dichte als das geschmolzene Aluminiumoxid-Kryolith-Gemisch und sammelt sich daher auf dem Boden der Kathodenwanne. Von dort wird es mit einem Saugrohr abgezogen. Das so entstandene Reinaluminium enthält noch etwa 0,1 bis 1 Prozent Verunreinigungen. Diese sind im Wesentlichen Eisen, Silicium und Titan.[6]
Bei diesem Vorgang können unerwünschte Nebenreaktionen auftreten, die zum Teil große Umweltprobleme darstellen.[1] So entstehen beispielsweise signifikante Mengen von Fluorwasserstoff, Kohlenstoffmonoxid und den Treibhauseffekt steigernden Fluoralkanen, insbesondere Tetrafluormethan.[1]
Einzelnachweise
- M. Binnewies et alii: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6. S. 404f.
- Energieeffizienz in der Aluminium-Gewinnung (PDF; 1,8 MB).
- Volkmar M. Schmidt: Elektrochemische Verfahrenstechnik, ISBN 978-3-527-62362-4
- Scriptum Elektrochemie (PDF; 1,3 MB) der Universität Siegen, Seite 184.
- Charles E. Mortimer, Ulrich Müller: Chemie. 9. Auflage. Thieme, 2007, ISBN 978-3-13-484309-5.
- European Aluminium Association: Kurzbericht (englisch).