Siliciumdioxid
Siliciumdioxid (häufig auch Siliziumdioxid) ist ein Oxid des Siliciums mit der Summenformel SiO2.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Grundlegendes Strukturelement der verschiedenen SiO2-Kristallstrukturen ist ein Tetraeder, bei dem ein Siliciumatom von vier Sauerstoffatomen umgeben ist. | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Siliciumdioxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | SiO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 60,1 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
je nach Modifikation zwischen 2,19 und 2,66 g·cm−3[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
> 2200 °C[5] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
| Durchbruchfeldstärke | 4–10 MV/cm (abhängig vom Herstellungsverfahren. z. B. bei nasser thermischer Oxidation 4–6 MV/cm bei trockener höher.) |
Im deutschen Sprachraum wird, vorwiegend in der Kautschuk-Industrie, für Siliciumdioxid statt der korrekten[9] Bezeichnung pyrogenes Siliciumdioxid oder gefälltes Siliciumdioxid die Bezeichnung Kieselsäure benutzt oder in letzter Zeit auch das aus dem Englischen übernommene Silica. Der Großteil der weltweiten Sandvorkommen besteht aus Siliciumdioxid (Quarz), denn dieses ist in der oberen kontinentalen Erdkruste nicht nur häufig, sondern aufgrund seiner Härte und seiner chemischen Widerständigkeit auch besonders verwitterungsbeständig. Siliciumdioxid ist der Hauptbestandteil aller Quarz-Gläser.
Mineralogie und Vorkommen
Amorphes SiO2
Nichtkristallines (amorphes) SiO2 kommt in der Natur als wesentlicher Bestandteil in folgenden Substanzen vor, die in ihrer Zusammensetzung sehr inhomogen und uneinheitlich sind:
- biogen: Skelette von Radiolarien, Diatomeen und Schwämmen aus Opal, diagenetisch zu Gestein verfestigt, zum Beispiel zu Kieselschiefer
- Geyserit: amorphe Sinterprodukte heißer Quellen
- Tachylit: vulkanisches Glas basaltischer Zusammensetzung, das neben SiO2 größere Gehalte an FeO, MgO, CaO und Al2O3 enthält
- Obsidian: vulkanisches Glas granitischer Zusammensetzung
- Tektit: Gesteinsgläser, entstanden durch Schmelzen von Gestein infolge von Meteoriteneinschlägen
- Lechatelierit: reines natürliches SiO2-Glas, wie es z. B. in Tektiten vorkommt oder bei Blitzeinschlägen in Quarzsande entsteht (Fulgurit)
- Opal
- SiO2-Schmelze: bei Temperaturen oberhalb von 1727 °C (bei 1 bar)
Kristallines SiO2
Im Gegensatz zum amorphen SiO2 haben die kristallinen Formen nur eine sehr geringe Toleranz gegenüber Verunreinigungen. Sie unterscheiden sich nur in ihrer Struktur.
- Mogánit (Chalcedon)
- α-Quarz (Tiefquarz): Bildungsbedingungen: Temperatur T < 573 °C, Druck p < 20 kbar
- β-Quarz (Hochquarz): 573 °C < T < 867 °C, p < 30 kbar
- Tridymit: 867 °C < T <1470 °C, p < 5 kbar
- Cristobalit: 1470 °C < T < 1727 °C
- Coesit: 20 kbar < p < 75 kbar
- Stishovit: 75 kbar < p < ? kbar
Siliciumdioxid bildet als Teil von Silicaten wie z. B. Feldspat, Tonmineralen oder in freier Form als Quarz den Hauptbestandteil der Erdkruste und somit auch die häufigste Siliciumverbindung.
Kieselsäureanhydrid
In der Natur kommen Stützgerüste aus Kieselsäureanhydrid in pflanzlichen und tierischen Lebewesen vor, etwa bei den im Meer weit verbreiteten Kieselalgen (Diatomeen) und Strahlentierchen (Radiolarien) und Glasschwämmen (Hexactinellida) sowie beim Schachtelhalm. Die Kieselsäureanhydrid-Skelette abgestorbener Kieselalgen und Strahlentierchen sinken auf den Meeresgrund, reichern sich dort an und bilden Ablagerungen aus Kieselgur (Diatomeenerde) bzw. Radiolarienschlamm. Ablagerungen aus dem Miozän enthalten 70–90 % SiO2, 3–12 % Wasser und Spuren von Metalloxiden.
Chemische Eigenschaften
Die Löslichkeit von Siliciumdioxid in Wasser ist stark von der Modifikation beziehungsweise dem Ordnungsgrad des Siliciumdioxids abhängig. Bei dem kristallinen, hochgeordneten Quarz liegt die Löslichkeit je nach Quelle bei 25 °C bei etwa 2,9[10] oder 6–11 mg SiO2 pro Liter Wasser.[11] Dabei ist allerdings zu bedenken, dass sich das Lösungsgleichgewicht kinetisch unter Umständen nur sehr langsam einstellt. Die ungeordneten amorphen Kieselsäuren sind bei der gleichen Temperatur mit ca. 120 mg/l Wasser deutlich besser löslich.[6] Mit zunehmender Temperatur steigt die Löslichkeit an. Für Quarz liegt sie bei 100 °C dann bei ca. 60 mg/l Wasser.[12] Bei amorpher Kieselsäure werden bei 75 °C bereits 330 ppm Siliciumdioxid in Wasser gelöst. Mit zunehmendem pH-Wert steigt die Löslichkeit ebenfalls an.[13][14] Die Löslichkeit von Chalcedon liegt bei 22–34 mg/l,[11] die von Cristobalit bei 6 mg/l,[10] die von Tridymit bei 4,5 mg/l,[10] die von Stishovit bei 11 mg/l[10] und die von amorphem Quarzglas bei 39 mg/l[10] bzw. 120 mg/l.[11]
Säuren vermögen SiO2 praktisch nicht aufzulösen, ausgenommen Flusssäure (HF), von der es unter Bildung von gasförmigem Siliciumtetrafluorid (SiF4) angegriffen wird. Alkalischmelzen und – in schwächerem Ausmaß – auch wässrige Alkalilaugen lösen besonders amorphes Siliciumdioxid.
Einige natürliche Wässer enthalten neben Kieselsäure kolloidales Siliciumdioxid (SiO2), das bei normalen Temperaturen im Wasser nicht zu Kieselsäure hydratisiert. Dieses kolloidale SiO2 – hierzu gehören auch diverse kieselsäurehaltige Verbindungen – reagiert mit Ammoniumheptamolybdat nicht zu der gelbgefärbten Heteropolysäure.[15]
Technische Herstellung
Synthetisches SiO2, das meist amorph vorliegt, wird großtechnisch in unterschiedlichen Prozessen in großen Mengen erzeugt. Als Sammelbegriff wird neudeutsch auch „Silica“ verwendet.
Die großtechnische Herstellung von synthetischem SiO2 erfolgt hauptsächlich über Fällungsprozesse, ausgehend von Wasserglas, das durch Aufschließen von Quarzsand mit Natriumcarbonat oder Kaliumcarbonat erhältlich ist. So erzeugtes SiO2 nennt man je nach Prozessbedingungen gefälltes Siliciumdioxid (historisch: Fällungskieselsäuren), Kieselsolen oder Kieselgele. Eine weitere wichtige Herstellungsvariante ist die Erzeugung von so genanntem pyrogenem SiO2 in einer Knallgasflamme, ausgehend von flüssigen Chlorsilanen wie Siliciumtetrachlorid (SiCl4).
Pyrogenes Siliciumdioxid
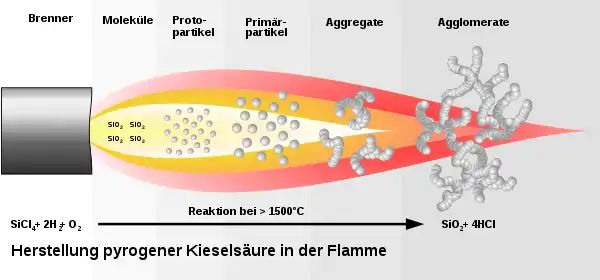
Pyrogenes Siliciumdioxid ist amorphes SiO2-Pulver von 5–50 nm Durchmesser und mit einer spezifischen Oberfläche von 50 bis 600 m2/g. Der Name verweist auf das häufig angewandte Herstellungsverfahren durch Flammenhydrolyse: der bei der Verbrennung von Knallgas entstehende Wasserdampf zersetzt Silane zu SiO2, eine andere Methode nutzt SiCl4 als Si-Quelle. In wartungsfreien Blei-Säure-Akkumulatoren wird pyrogenes Siliciumdioxid als Ausgangsstoff für den Gelelektrolyten verwendet, worin der Massenanteil an SiO2 aber nur wenige Prozente ausmacht.
Technische Anwendung
Synthetisches SiO2 spielt im Alltag meist unbemerkt eine große Rolle. In Farben und Lacken, Kunst- und Klebstoffen ist es ebenso wichtig wie in modernen Fertigungsprozessen in der Halbleitertechnik oder als Pigment in Inkjetpapier-Beschichtungen. Als ungiftige Substanz ist es in pharmazeutischen Artikeln genauso vertreten wie in kosmetischen Produkten, wird in Lebensmittelprozessen (z. B. Bierklärung) und als Putzhilfe in Zahnpasta verwendet. Auch findet Siliciumdioxid Anwendung in der biologischen Landwirtschaft: es wird dort in Form eines feinen Pulvers zur Vorbeugung gegen Kornkäferbefall mit Getreide vermischt. Mengenmäßig zu den Hauptanwendungen zählen der Einsatz als Füllstoff für Kunststoffe und Dichtmassen, insbesondere in Gummiartikeln. Autoreifen profitieren von der Verstärkung durch ein spezielles SiO2-System.
Die mengenmäßig größte Bedeutung kommt Siliciumdioxid in Form von Glas zu. Meistens wird es mit Stoffen wie Aluminiumoxid, Bortrioxid, Calcium- und Natriumoxid vermischt, um die Schmelztemperatur zu senken, die Verarbeitung zu erleichtern oder die Eigenschaften des Endprodukts zu verbessern. Reines Siliciumdioxid ist schwer schmelzbares Quarzglas, das besonders temperatur- und temperaturwechselbeständig ist.
Quarzglas wird in der Optik in Form von Linsen, Prismen etc. verwendet. Im chemischen Labor wird Quarzglas als Geräteglas eingesetzt, sobald besonders hohe UV-Durchlässigkeit oder Temperaturfestigkeit gefordert wird. Einen glühenden Quarztiegel kann man in kaltes Wasser tauchen, ohne dass er springt. Dennoch wird im Labor üblicherweise das ebenfalls temperaturwechselbeständige Borosilicatglas verwendet, da es billiger in der Herstellung und Verarbeitung ist.
Ein weiteres Anwendungsgebiet von Siliciumdioxid ist die Betonherstellung. So ist dieser Stoff Hauptbestandteil von Microsilica, einem Zusatzstoff bei der Produktion von Hochleistungsbeton und Ultrahochleistungsbetonen (C100…). Der Silicastaub reagiert mit dem Calciumhydroxid (Ca(OH)2), das bei der Zementhydratation freigesetzt wird, und formt so genannte Calciumsilicathydrat-Phasen. Weiter führen die Partikel in der Größenordnung von 0,1 µm zu einer mechanischen Erhöhung der Festigkeit, indem der Kapillarporenanteil im Zementstein verringert wird.
Auch wird SiO2 in der Lebensmittelindustrie als Lebensmittelzusatzstoff (E 551) eingesetzt. So findet man es beispielsweise in Form von Kieselsäure als Rieselhilfe für Speisesalz, in Gewürzen und Gewürzmischungen. Wegen Bedenken in Bezug auf die enthaltenen Nanopartikel hat Bio Suisse die Zulassung von E 551 ab Anfang 2019 beendet.[16]
In der pharmazeutischen Technologie wird feindisperses Siliciumdioxid als pharmazeutischer Hilfsstoff bei der Herstellung von Tabletten verwendet.
Eine weitere Verwendungsmöglichkeit für Siliciumdioxid findet sich in der Pyrotechnik. Dort wird es unter anderem für die Herstellung von Brandgelen verwendet.
Siliciumdioxid in der Halbleitertechnik
Siliciumdioxid ist ein wichtiges Material in der Halbleiter- und Mikrosystemtechnik. Hauptsächlich wird es als Isolations- und Passivierungsmaterial eingesetzt, beispielsweise als Gate-Dielektrikum der eingesetzten Transistoren oder als Zwischenmetalldielektrikum in der Verdrahtungsebene von integrierten Schaltkreisen. Diese Schichten werden beispielsweise durch thermische Oxidation von Silicium oder durch chemische Gasphasenabscheidung hergestellt und sind meist amorph. Da die elektrischen Eigenschaften für aktuelle mikroelektronische Produkte nicht mehr ausreichend sind, wird Siliciumdioxid seit Mitte der 2000er Jahre nach und nach von sogenannten Low-k- und High-k-Dielektrika verdrängt. Ein weiterer Anwendungsbereich von Siliciumdioxid (sowohl Quarz als auch spezielle Gläser) ist die Fotolithografie, wo es als Trägermaterial für Masken eingesetzt wird.
Dünne Schichten aus Siliciumoxid können durch verschiedene Beschichtungsverfahren hergestellt werden. Die einfachste Art der Herstellung von Siliciumoxidschichten auf kristallinem Silicium ist die Oxidation des Siliciums durch Sauerstoff (siehe Thermische Oxidation von Silicium). Dieser Prozess findet in Rohröfen, im industriellen Bereich heutzutage meist Vertikalöfen, statt.
Die trockene Oxidation findet bei Temperaturen von 850–1200 °C statt und verläuft relativ langsam, aber mit sehr guter Gleichmäßigkeit. Bei der nassen Oxidation wird die Abscheidung des Oxids stark beschleunigt. Die Feuchtigkeit wird entweder direkt in Form von Wasserdampf oder über einen Knallgasbrenner eingebracht, d. h. Wasserstoff und Sauerstoff werden unmittelbar vor Einbringung in den Ofen zur Reaktion gebracht, wobei sich das gewünschte Wasser in sehr großer Reinheit bildet.
Soll Siliciumoxid auf einem anderen Substrat als Silicium gebildet werden, ist die thermische Oxidation nicht mehr nutzbar und es müssen andere Verfahren verwendet werden. Hauptsächlich werden hier Verfahren der chemischen Gasphasenabscheidung (CVD) eingesetzt, bei denen beide Elemente durch eine Reaktion von Gasen, die Silicium enthalten, wie Silan oder Tetraethylorthosilicat (TEOS, auch Tetraethoxysilan), gebildet werden.[17]
Die Oxidabscheideverfahren, die auf der Reaktion von Silan basieren, finden meist bei reduziertem Druck (engl. low preassure cvd, LPCVD) statt. Es gibt mehrere gängige Methoden. Im LTO-Verfahren (engl. low temperature oxid) wird bei ca. 430 °C verdünntes Silan direkt mit Sauerstoff umgesetzt:
Bei höheren Temperaturen (900 °C) lässt sich SiO2 im sogenannten HTO-Verfahren (engl. high temperature oxid), aber auch aus einer Kombination von Dichlorsilan und Lachgas bilden:
In der Halbleitertechnik sind weiterhin sogenannte TEOS-Verfahren wichtig – dabei wird Tetraethylorthosilicat (TEOS) thermisch zersetzt:
Die so hergestellten SiO2-Schichten haben in der Regel bessere Eigenschaften und können mit höherer Schichtkonformität abgeschieden werden, der Herstellungsprozess ist jedoch etwas teurer als beispielsweise beim HTO-Verfahren.
Toxikologie
Die Auswirkungen von Siliciumdioxid auf die menschliche Gesundheit und die Umwelt werden unter REACH seit dem Jahr 2012 im Rahmen der Stoffbewertung von den Niederlanden geprüft. Die Bewertung ist noch nicht abgeschlossen. Insbesondere bestehen begründete Bedenken, sofern die Stoffe eingeatmet werden, sowie bei oberflächenbehandeltem Siliciumdioxid im Allgemeinen. Daher fordert die Behörde weitere Daten der Hersteller. Mehrere Hersteller legten Widerspruch ein.[18]
Amorphes synthetisches Siliciumdioxid mit einer Primärteilchengröße < 25 nm wurde zum 1. November 2015 als Insektizid-Wirkstoff zugelassen.[19]
Siehe auch
Weblinks
- Forscher pressen Oxid des Halbleiters in bisher unbekannte Kristallform www.wissenschaft.de: Unter dem enormen Druck von 268 Gigapascal bildet Silicium Kristalle, die auf der Erde sonst nirgends vorkommen.
- Umfangreiche Infos zu amorphen SiO2 (Opal)
- Photos aller SiO2-Modifikationen
Einzelnachweise
- Eintrag zu SILICA in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. November 2021.
- Eintrag zu SILICA in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu E 551: Silicon dioxide in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 11. August 2020.
- Eintrag zu Siliciumdioxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Mai 2014.
- Datenblatt Siliciumdioxid (PDF) bei Merck, abgerufen am 6. Dezember 2021.
- W. Hummel, U. Berner, E. Curti, F. J. Pearson, T. Thoenen: Nagra/Psi Chemical Thermodynamic Data Base 01/01. Verlag Universal-Publishers, 2002, ISBN 1-58112-620-4, S. 311–313. eingeschränkte Vorschau in der Google-Buchsuche.
- refractiveindex.info: Refractive index of SiO2 (Silicon dioxide, Silica, Quartz)
- Edward Palik (Hrsg.): Handbook of Optical Constants of Solids: 1. Academic Press Inc, 1985, ISBN 0-12-544420-6, S. 760.
- Beschichtungsstoffe: Begriffe aus DIN-Normen. 1. Auflage. Vincentz [u. a.], Hannover 2001, ISBN 3-87870-721-5, S. 157 (eingeschränkte Vorschau in der Google-Buchsuche).
- A.F. Holleman, Egon Wiberg: Lehrbuch der anorganischen Chemie. Walter de Gruyter Verlag, Berlin, New York, 1985, ISBN 3-11-007511-3
- Rudolf Rykart: Quarz-Monographie - Die Eigenheiten von Bergkristall, Rauchquarz, Amethyst, Chalcedon, Achat, Opal und anderen Varietäten. Ott Verlag Thun, 2nd. Edition,1995. ISBN 3-7225-6204-X.
- D. C. Ford, P. W. Williams: Karst hydrogeology and geomorphology. John Wiley and Sons, 2007, ISBN 0-470-84997-5, S. 45 eingeschränkte Vorschau in der Google-Buchsuche.
- J. Schlomach: Feststoffbildung bei technischen Fällprozessen. Dissertation, Universität Fridericiana Karlsruhe, 2006, ISBN 3-86644-024-3, S. 9.
- Z. Amjad: Water soluble polymers: solution properties and applications. Verlag Springer, 1998, ISBN 0-306-45931-0 eingeschränkte Vorschau in der Google-Buchsuche.
- L. Braunstein, K. Hochmüller, K. Sprengler: Die Bestimmung kolloidaler Kieselsäure im Wasser. In: VGB Kraftwerkstechnik. Jg. 62, Nr. 9, 1982, S. 789.
- Das gilt neu im Biolandbau 2019. (PDF; 277 kB) In: shop.fibl.org. Bio Suisse, 2018, abgerufen am 27. Januar 2019.
- Herstellung von Siliciumdioxidschichten in der Halbleitertechnologie. Crystec Technology Trading GmbH, abgerufen am 25. April 2009.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Silicon dioxide, abgerufen am 5. Juli 2017.
- Active Substances. Abgerufen am 28. März 2019.