Elektrochemische Spannungsreihe
Die elektrochemische Spannungsreihe ist eine Auflistung von Redox-Paaren nach ihrem Standardelektrodenpotential (Redoxpotential unter Standardbedingungen). Vor allem bei Metallen wird sie auch Redoxreihe genannt.
Aus der elektrochemischen Spannungsreihe lässt sich das Redoxverhalten eines Stoffes ableiten.
Jede Redoxreaktion kann man so durch zwei Paare beschreiben und aus der elektrochemischen Spannungsreihe die Richtung von Reaktionen voraussagen.
Interpretation und Bedeutung
Metalle
Bei Metallen bilden das Metall als Element und sein zugehöriges Kation ein Redox-Paar (Red… …ox + z e−).
Im folgenden Beispiel ist damit Cu die reduzierte Form („Red…“) und Cu2+ die oxidierte Form („…ox“).:
Das Redoxpotential ist ein Maß für die Bereitschaft der Ionen, die Elektronen aufzunehmen. Die Ionen der Edelmetalle nehmen bereitwilliger Elektronen auf als die Ionen unedler Metalle, weshalb unter Standardbedingungen das Redoxpotential des Cu/Cu2+-Paares mit +0,35 V deutlich positiver ist als das des Zn/Zn2+-Paares mit −0,76 V. Und das heißt wiederum, dass Zn zu den unedleren Metallen gehört und ein stärkeres Reduktionsmittel ist, also seinen Reaktionsteilnehmer reduziert und selbst oxidiert wird und Elektronen abgibt.
(„Unter Standardbedingungen“ bedeutet, dass die Konzentration – genauer: Aktivität – der Ionen 1 mol/l betragen muss, damit das Redoxpotential die tabellierten Werte annimmt. Diese Einschränkung ist notwendig, weil es sich um Gleichgewichtsreaktionen handelt. Nach dem Le Chatelierschen Prinzip hat eine größere Konzentration Metallionen auch eine größere Bereitschaft, zum Metall reduziert zu werden und daher ein höheres Redoxpotential. Die Nernst-Gleichung beschreibt diesen Zusammenhang mathematisch.)
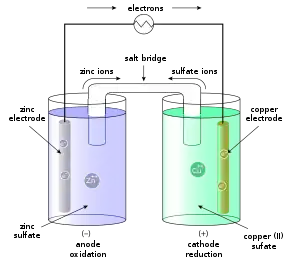
Redoxpotentiale selbst sind nicht messbar. Messbar ist dagegen die Differenz von zwei Elektrodenpotentialen. Eine Elektrode unter Standardbedingungen wird einfach durch das Eintauchen eines Metalls in eine Lösung realisiert, die seine Ionen in einer Konzentration von 1 mol/l enthält. Werden zwei solche Elektroden elektrisch leitend verbunden (Ionenbrücke), entsteht eine galvanische Zelle und man kann zwischen den Metallen eine Spannung messen. Diese Spannung ist gleich der Differenz der Standardelektrodenpotentiale, die zu den Redoxpaaren in den Elektrodenräumen gehören und in der elektrochemischen Spannungsreihe tabelliert sind. Für das Beispiel der Kombination der Redox-Paare Cu/Cu2+ und Zn/Zn2+ entsteht ein Daniell-Element mit der Spannung 1,11 V.
Ion-/Gas-Elektroden (Normal-Wasserstoffelektrode)
Gasförmiger Wasserstoff und dessen zwei Protonen sind ebenfalls ein Redoxpaar:
Elektroden für Redox-Paare mit gasförmigen Stoffen werden realisiert, indem ein inertes Metall (Pt) in eine 1 mol/l Lösung der Ionen (H+) getaucht und vom zugehörigen Gas (H2) bei einem Druck von 1 bar umspült wird. Im speziellen Fall entsteht eine Normal-Wasserstoffelektrode. Diese Elektrode ist leicht aufzubauen und liefert ein konstantes, reproduzierbares Potential. Da das Redox-Paar H2/H+ außerdem die Wirkung von Säuren beschreibt (es taucht immer bei der Auflösung von Metallen in Säuren auf: z. B. Mg + 2 H+ → Mg2+ + H2), wurde das Standardpotential der Normal-Wasserstoffelektrode aus praktischen Gründen als null definiert.
Alle anderen Standardpotentiale sind daher die Spannungen, die man in einer galvanischen Zelle misst, wenn links die Normal-Wasserstoffelektrode und rechts die Elektrode des Redox-Paares zusammengeschlossen sind. (Jeweils unter Standardbedingungen!)
Anwendungen
Die elektrochemische Spannungsreihe erlaubt die Berechnung der Spannungen, die Batterien und Akkumulatoren maximal liefern können. Im Umkehrschluss sind das die Spannungen, die mindestens für das Antreiben von Elektrolysen bzw. Laden der Akkumulatoren angelegt werden müssen.
Weiterhin sind die Berechnung von Reaktionsrichtung und -stärke möglich. Mischt man zwei Redox-Paare in einer Reaktionslösung, so wird für das Paar mit dem höheren Redoxpotential die Reduktion ablaufen, für das Paar mit dem niedrigeren Redoxpotential die Oxidation. Taucht man z. B. ein Zink-Blech in eine CuSO4-Lösung, so wird Zink aufgrund seines niedrigeren Redoxpotentials (−0,76 V) oxidiert und geht als Zink-Ionen in Lösung, wohingegen gleichzeitig Kupfer-Ionen (+0,35 V) reduziert werden und sich als Kupfer-Überzug auf dem Zink-Blech abscheiden. (Dieses gern zitierte Beispiel missachtet die Forderung nach Standardbedingungen. So wird sich auch ein Kupfer-Blech, das in eine ZnSO4-Lösung eintaucht, ein wenig mit Zink überziehen, weil zunächst kein Zink vorhanden und die Cu2+-Konzentration null ist. Der Effekt kann mit der Nernst-Gleichung berechnet werden, ist aber unmessbar klein, sodass das Beispiel eine gewisse Berechtigung hat.) Ein Maß für die Stärke der Reaktion ist die Gibbs-Energie (freie Enthalpie) der zugehörigen Reaktion, die nach
berechnet werden kann. Darin sind die Zahl der ausgetauschten Elektronen, = 96.485 C mol−1 die Faraday-Konstante und ΔE° die Differenz der Standardpotentiale .
Die reduzierte Form eines Redox-Paares mit sehr negativem Standardpotential stellt ein sehr starkes Reduktionsmittel dar, weil es zur Elektronenabgabe bestrebt ist (z. B. Natrium). Dagegen ist die oxidierte Form eines Redox-Paares mit sehr positivem Standardpotential ein starkes Oxidationsmittel (z. B. Fluor als stärkstes bekanntes Oxidationsmittel, d. h. mit höchstem Standardpotential), weil es nach Elektronenaufnahme strebt. Bei Kontakt von Metallen mit unterschiedlichem Standardelektrodenpotential kann es deswegen zu Kontaktkorrosion kommen. Die elektrochemische Spannungsreihe ist damit eine Auflistung von Oxidationsmitteln nach Oxidationsstärke bzw. gleichzeitig eine umgekehrte Auflistung von Reduktionsmitteln nach Reduktionsstärke.
Außerdem enthält die elektrochemische Spannungsreihe eine Abstufung der Metalle („sehr edles Metall“, „edles Metall“, „weniger edles Metall“, „unedles Metall“, „sehr unedles Metall“) nach ihrem Bestreben, sich in Säuren oxidieren zu lassen. Die Standardpotentiale der edlen Metalle haben ein positives Vorzeichen, die der unedlen dagegen ein negatives. Unedle Metalle lösen sich daher in Säuren auf, weil Säuren H+ enthalten. (Die Argumente zum Beispiel Zn/Cu gelten analog.)
Edle Metalle lösen sich hingegen nur in oxidierenden Säuren auf.
Elektrochemische Spannungsreihe
(Standardpotentiale bei 25 °C; 101,3 kPa; pH = 0; Ionenaktivitäten 1 mol/l)
| Element im Redox- Paar, dessen Oxida- tionsstufe sich ändert |
oxidierte Form | + z e− ⇌ | reduzierte Form | Standard- potential E° |
|---|---|---|---|---|
| Fluor (F) | F2 | + 2 e− ⇌ | 2 F− | +2,87 V |
| Sauerstoff (O) | S2O82− | + 2 e− ⇌ | 2 SO42− | +2,00 V |
| Sauerstoff (O) | H2O2 + 2 H3O+ | + 2 e− ⇌ | 4 H2O | +1,78 V |
| Gold (Au) | Au+ | + e− ⇌ | Au | +1,69 V[1] |
| Gold (Au) | Au3+ | + 3 e− ⇌ | Au | +1,50 V[1] |
| Gold (Au) | Au3+ | + 2 e− ⇌ | Au+ | +1,40 V[1] |
| Chlor (Cl) | Cl2 | + 2 e− ⇌ | 2 Cl− | +1,36 V |
| Chrom (Cr) | Cr6+ | + 3 e− ⇌ | Cr3+ | +1,33 V |
| Sauerstoff (O) | O2 + 4 H+ | + 4 e− ⇌ | 2 H2O | +1,23 V |
| Platin (Pt) | Pt2+ | + 2 e− ⇌ | Pt | +1,20 V |
| Iridium (Ir) | Ir3+ | + 3 e− ⇌ | Ir | +1,156 V[1] |
| Brom (Br) | Br2 | + 2 e− ⇌ | 2 Br− | +1,07 V |
| Nickel (Ni) | NiO2 + 2 H2O | + 2 e− ⇌ | Ni (OH)2 + 2 OH− | +0,98 V[2] |
| Silicium (Si) | SiO2 + 4 H+ | + 4 e− ⇌ | Si + 2 H2O | +0,857 V[1] |
| Palladium (Pd) | Pd2+ | + 2 e− ⇌ | Pd | +0,85 V |
| Quecksilber (Hg) | Hg2+ | + 2 e− ⇌ | Hg | +0,85 V |
| Silber (Ag) | Ag+ | + e− ⇌ | Ag | +0,80 V |
| Eisen (Fe) | Fe3+ | + e− ⇌ | Fe2+ | +0,77 V |
| Tellur (Te) | Te4+ | + 4 e− ⇌ | Te | +0,568 V[1] |
| Iod (I) | I2 | + 2 e− ⇌ | 2 I− | +0,53 V |
| Kupfer (Cu) | Cu+ | + e− ⇌ | Cu | +0,52 V |
| Sauerstoff (O) | O2 + 2 H2O | + 4 e− ⇌ | 4 OH− | +0,40 V |
| Eisen (Fe) | [Fe (CN)6]3− | + e− ⇌ | [Fe (CN)6]4− | +0,36 V |
| Kupfer (Cu) | Cu2+ | + 2 e− ⇌ | Cu | +0,35 V |
| Bismut (Bi) | Bi3+ | + 3 e− ⇌ | Bi | +0,308 V[1] |
| Kupfer (Cu) | Cu2+ | + e− ⇌ | Cu+ | +0,16 V |
| Zinn (Sn) | Sn4+ | + 2 e− ⇌ | Sn2+ | +0,15 V |
| Wasserstoff (H) | 2 H+ | + 2 e− ⇌ | H2 | 0 V |
| Eisen (Fe) | Fe3+ | + 3 e− ⇌ | Fe | −0,04 V |
| Wolfram (W) | WO2 + 4 H+ | + 4 e− ⇌ | W + 2 H2O | −0,119 V |
| Blei (Pb) | Pb2+ | + 2 e− ⇌ | Pb | −0,13 V |
| Zinn (Sn) | Sn2+ | + 2 e− ⇌ | Sn | −0,14 V |
| Molybdän (Mo) | Mo3+ | + 3 e− ⇌ | Mo | −0,20 V |
| Nickel (Ni) | Ni2+ | + 2 e− ⇌ | Ni | −0,23 V |
| Cobalt (Co) | Co2+ | + 2 e− ⇌ | Co | −0,28 V |
| Thallium (Tl) | Tl+ | + e− ⇌ | Tl | −0,34 V |
| Indium (In) | In3+ | + 3 e− ⇌ | In | −0,34 V |
| Cadmium (Cd) | Cd2+ | + 2 e− ⇌ | Cd | −0,40 V |
| Eisen (Fe) | Fe2+ | + 2 e− ⇌ | Fe | −0,44 V[3] |
| Schwefel (S) | S | + 2 e− ⇌ | S2− | −0,48 V |
| Gallium (Ga) | Ga3+ | + 3 e− ⇌ | Ga | −0,549 V[1] |
| Chrom (Cr) | Cr3+ | + 3 e− ⇌ | Cr | −0,76 V[4] |
| Zink (Zn) | Zn2+ | + 2 e− ⇌ | Zn | −0,76 V |
| Wasser | 2 H2O | + 2 e− ⇌ | H2 + 2 OH− | −0,83 V |
| Bor (B) | B (OH)3 + 3 H3O+ | + 3 e− ⇌ | B + 6 H2O | −0,89 V |
| Chrom (Cr) | Cr2+ | + 2 e− ⇌ | Cr | −0,91 V |
| Niob (Nb) | Nb3+ | + 3 e− ⇌ | Nb | −1,099 V |
| Vanadium (V) | V2+ | + 2 e− ⇌ | V | −1,17 V |
| Mangan (Mn) | Mn2+ | + 2 e− ⇌ | Mn | −1,18 V |
| Titan (Ti) | Ti3+ | + 3 e− ⇌ | Ti | −1,21 V |
| Uran (U) | UO22+ + 4 H+ | + 6 e− ⇌ | U + 2 H2O | −1,444 V[1] |
| Zirconium (Zr) | Zr4+ | + 4 e− ⇌ | Zr | −1,45 V[1] |
| Hafnium (Hf) | Hf4+ | + 4 e− ⇌ | Hf | −1,55 V[1] |
| Aluminium (Al) | Al3+ | + 3 e− ⇌ | Al | −1,66 V |
| Uran (U) | U3+ | + 3 e− ⇌ | U | −1,66 V[1] |
| Titan (Ti) | Ti2+ | + 2 e− ⇌ | Ti | −1,77 V |
| Beryllium (Be) | Be2+ | + 2 e− ⇌ | Be | −1,85 V |
| Scandium (Sc) | Sc3+ | + 3 e− ⇌ | Sc | −2,077 V[1] |
| Neodym (Nd) | Nd3+ | + 3 e− ⇌ | Nd | −2,323 V[1] |
| Magnesium (Mg) | Mg2+ | + 2 e− ⇌ | Mg | −2,362 V[1] |
| Yttrium (Y) | Y3+ | + 3 e− ⇌ | Y | −2,372 V[1] |
| Cer (Ce) | Ce3+ | + 3 e− ⇌ | Ce | −2,483 V |
| Lanthan (La) | La3+ | + 3 e− ⇌ | La | −2,522 V |
| Natrium (Na) | Na+ | + e− ⇌ | Na | −2,71 V |
| Calcium (Ca) | Ca2+ | + 2 e− ⇌ | Ca | −2,87 V |
| Strontium (Sr) | Sr2+ | + 2 e− ⇌ | Sr | −2,89 V |
| Barium (Ba) | Ba2+ | + 2 e− ⇌ | Ba | −2,92 V |
| Kalium (K) | K+ | + e− ⇌ | K | −2,92 V |
| Caesium (Cs) | Cs+ | + e− ⇌ | Cs | −2,92 V |
| Rubidium (Rb) | Rb+ | + e− ⇌ | Rb | −2,98 V |
| Lithium (Li) | Li+ | + e− ⇌ | Li | −3,04 V |
Historisches
Die ersten Spannungsreihen waren qualitativer Natur und wurden 1793 von zwei Forschern erstellt, von Alessandro Volta und unabhängig davon vom Physiker Christoph Heinrich Pfaff. Zur Aufstellung seiner Reihe nutzte Volta die Empfindungen, die zwei verschiedene, einander berührende Metalle auf seiner feuchten Zunge auslösten,[5] während Pfaff seine Reihen nach den unterschiedlich starken Zuckungen von Froschschenkeln aufstellte.[6] Pfaff erhielt, wenn er von verschiedenen Metallen ausging, verschiedene Spannungsreihen. Die Spannungsreihen von Volta und Pfaff wurden für den Fall verdünnter Schwefelsäure als Elektrolyt später vereinfacht so zusammengefasst:[7]
Schon ein Jahr später, 1794, hatte Volta 28 Elemente und Verbindungen in seine Spannungsreihe aufgenommen.[5]
Der Physikochemiker Gilbert Newton Lewis, der sich schon in seiner 1899 abgeschlossenen Doktorarbeit mit elektrochemischen Potentialen befasst hatte,[8] bestimmte viele Standardpotentiale mit zuvor unerreichter Genauigkeit oder zum ersten Mal, nämlich die von Natrium, Kalium, Rubidium, Chlor, Brom, Iod, Sauerstoff, Quecksilber, Silber, Thallium, Blei und Eisen.[9] 1938 veröffentlichte Wendell M. Latimer ein umfangreiches Werk zu den Redoxpotentialen in wässrigen Lösungen; nach ihm ist das Latimer-Diagramm benannt, das für ein gegebenes Element die Potentiale verschiedener Oxidationsstufen beschreibt. Noch übersichtlicher werden diese Potentialangaben für ein Element, wenn sie nach der 1951 von Arthur A. Frost vorgeschlagenen Weise aufgetragen werden: siehe Frost-Diagramm.[10]
Literatur
- Anorganische Chemie. Buchners Verlag, 1972.
- Elemente Chemie II. Klett Verlag, 2000.
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press/Taylor and Francis, Boca Raton, FL, Thermochemistry, Electrochemistry, and Solution Chemistry, S. 5-78 – 5-84.
- Kurspraktikum der allgemeinen und anorganischen Chemie (in Google Books). Abgerufen am 15. Januar 2017.
- Ulrich Müller-Farina: Chemie : das Basiswissen der Chemie ; ... 128 Tabellen. 10., überarb. Auflage. Thieme, Stuttgart 2010, ISBN 978-3-13-484310-1, S. Anhang A auf S. 688.
- Trevor Pearson, Stacey Handy, Rainer Lakner Forst: Elektrochemische Untersuchungen zum Korrosionsmechanismus dekorativer Chromoberflächen durch Calciumchlorid. In: Galvanotechnik, Ausgabe 08/2009, S. 1736
- Detlef Wienecke-Janz (Hrsg.): Neuordnung Europas und Restauration. 1793–1849 (= Die große Chronik-Weltgeschichte. Band 12). wissenmedia Verlag/Chronik-Verlag, Gütersloh/München 2008, ISBN 978-3-577-09072-8, Technischer Fortschritt und Ingenieurleistungen – Volta untersucht Elektrizität, S. 30 (google.de [abgerufen am 27. Juni 2015]).
- Spannungsreihe – Deutschland, 1793. In: Geschichte der Elektrizitätslehre und Elektrochemie. Universität Ulm, abgerufen am 18. November 2015.
- Wilhelm Philipp Hauck: Die galvanischen Batterien, Accumulatoren und Thermosäulen. Eine Beschreibung der hydro- und thermoelektrischen Stromquellen … A. Hartleben, Wien / Pest / Leipzig 1883, Einleitung, S. 13 (Textarchiv – Internet Archive).
- R. E. Kohler: Lewis, Gilbert Newton. In: Complete Dictionary of Scientific Biography. Encyclopedia.com Cengage Learning, 2015, abgerufen am 21. November 2015.
- Joel H. Hildebrand: Gilbert Newton Lewis. (PDF) In: Biographical Memoirs of the National Academy of Sciences. National Academy of Sciences, abgerufen am 21. November 2015.
- Arthur A. Frost: Oxidation Potential-Free Energy Diagrams. In: Journal of the American Chemical Society (JACS). Band 73, Nr. 6. ACS, Juni 1951, ISSN 1520-5126, S. 2680–2682, doi:10.1021/ja01150a074.