Spektrallinie
Als Spektrallinien oder Resonanzlinien bezeichnet man voneinander scharf getrennte Linien eines Spektrums emittierter (Emissionslinien) oder absorbierter (Absorptionslinien) elektromagnetischer Wellen, im engeren Sinne innerhalb des Wellenlängenbereichs des sichtbaren Lichts (Lichtspektrum). Spektrallinien werden durch Wellenlänge, Linienintensität und Linienbreite charakterisiert. Die Ursache der Spektrallinien sind die durch Licht angeregten elektronischen Übergänge in Atomen oder Molekülen.
Die Namensgebung Spektrallinie geht historisch darauf zurück, dass in üblichen Spektrometern ein Eingangsspalt vorhanden ist, dessen Form sich auf dem Schirm oder im Auge des Betrachters abbildet. Der Name wurde später auch auf die Peaks (d. h. Maxima) in einem als Intensitätskurve aufgezeichneten Spektrum übertragen.
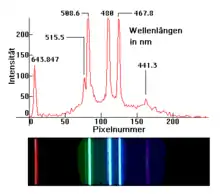
Spektrallinien treten bei der instrumentellen Atomspektroskopie (wie beispielsweise Kernresonanzspektroskopie) oder der Flammenfärbung auf. Sie werden unter anderem in der Astronomie zur Analyse der molekularen Struktur von Sternen, Planeten und interstellarer Materie verwendet, die sonst unmöglich wäre. Sie wurden bei der Brechung des Lichts der Sonne durch ein Prisma im 19. Jahrhundert entdeckt, woraus sich dann Spektroskope entwickelten, mit denen ein weites Feld von Anwendungsmöglichkeiten für die Spektralanalyse entstand.
Grundlagen
Eine Spektrallinie ist das Licht einer genau definierten Frequenz, das von einem Atom oder Molekül aufgrund eines Übergangs aus einem Energieniveau auf ein anderes abgegeben (emittiert) oder aufgenommen (absorbiert) wird. Die Frequenz wird durch die Energie des emittierten oder absorbierten Photons bestimmt; diese ist gleich dem Unterschied zwischen den Energien der beiden quantenmechanischen Zustände. Die Frequenz ist charakteristisch für diesen bestimmten Übergang in der gegebenen Atomsorte. Daher kann man durch Beobachtung von Spektrallinien Atomsorten unterscheiden.
Emissionslinie
Eine Emissionslinie zeigt sich im Spektrum als helle Linie. Sie entsteht beim Übergang von einem höheren auf ein tieferes Energieniveau, beispielsweise wenn ein Elektron von einem angeregten Zustand in den Grundzustand übergeht. Hierbei wird ein Photon ausgesendet. Dies kann entweder spontan geschehen (spontane Emission) oder, wie z. B. beim Laser, durch Licht passender Frequenz angeregt werden (stimulierte Emission).
Absorptionslinie

Bei Einstrahlung von Licht mit einem kontinuierlichen Spektrum (also einem Frequenzgemisch) ergibt sich durch Resonanzabsorption von Photonen passender Frequenz eine Absorptionslinie, indem ein Übergang von einem niedrigeren in ein höheres Energieniveau induziert wird – beispielsweise, wenn ein Elektron durch das Photon aus dem Valenzband in das Leitungsband „gehoben“ wird (vgl. photoelektrischer Effekt).
Beim Rückfall in das niedrigere Energieniveau werden Photonen isotrop, d. h. in beliebige Richtungen, emittiert.
Beides führt dazu, dass das Licht vom durchstrahlten Stoff bei dieser Frequenz diffus gestreut wird. Sofern ausreichend viele absorbierende Atome vorhanden sind, kommt es dadurch zu
- einer dunklen Linie im kontinuierlichen Spektrum des durchscheinenden Lichts (Fraunhoferlinie); dies ist meistens mit dem Begriff Absorptionslinie gemeint
- einer hellen Linie vor dunklem Hintergrund, wenn das vom Gas seitlich austretende gestreute Licht analysiert wird; diese Art von heller Linie nennt man aufgrund historisch entstandener Terminologie nicht Emissionslinie; als solche werden Linien nämlich nur dann bezeichnet, wenn die Anregung nicht durch Licht der gleichen Frequenz erfolgte.
Emissionsprofile
Das Licht einer Spektrallinie enthält nicht eine einzelne, scharf bestimmte Frequenz, sondern umfasst einen (schmalen) Frequenzbereich. Die Halbwertsbreite dieses Bereiches nennt man Linienbreite. Die Linienbreite einer Emissionslinie setzt sich aus mehreren Beiträgen zusammen:
- Lorentz-Profil
- Die natürliche Linienbreite ergibt sich aus der Lebensdauer des Ausgangszustands durch die heisenbergsche Unschärferelation. Diese hat die Form einer Lorentz-Kurve. Es ist nicht möglich, diese zu verringern.
- Gauß-Profil
- Aufgrund der thermischen Bewegung der Atome entsteht ein Doppler-Effekt, der das Licht eines einzelnen Atoms oder Moleküls je nach Bewegungsrichtung rot- oder blauverschiebt. Aufgrund der statistischen Bewegung ergibt sich insgesamt eine breitere Frequenzverteilung. Diesen Effekt nennt man Doppler-Verbreiterung. Sie hat die Form einer Gauß-Kurve und ist abhängig von der Temperatur. Meist dominiert die Dopplerbreite deutlich über die natürliche Linienbreite. Der Mechanismus ist auch unter dem Begriff inhomogene Linienverbreiterung bekannt.
- Voigt-Profil
- Eine Lorentz-Kurve endlicher Breite erscheint bei einer Messung gegenüber ihrer bekannten Form verändert, wenn die Apparatefunktion der Messanordnung eine Halbwertsbreite in der Größenordnung der betrachteten Lorentz-Kurve aufweist. Die Linienform lässt sich dann durch die Faltung aus Lorentz-Kurve und Apparatefunktion beschreiben. Ist die Apparatefunktion eine Gauß-Kurve, spricht man bei dem Ergebnis der Faltung von einem Voigt-Profil.
Geschichte
Erstmals entdeckt wurden Absorptionslinien 1802 durch William Hyde Wollaston und 1814, unabhängig von ihm, durch Joseph von Fraunhofer im Spektrum der Sonne. Diese dunklen Linien im Sonnenspektrum werden auch Fraunhofersche Linien genannt.
Die Spektrallinien trugen neben anderen Effekten zur Entwicklung der Quantenmechanik bei. Ein in einem Atom gebundenes Elektron könnte nach der klassischen Elektrodynamik elektromagnetische Wellen beliebiger Frequenzen abstrahlen; die Existenz von diskreten Linien war klassisch nicht erklärbar. Die Entdeckung, dass die Frequenzen der Spektrallinien des Wasserstoffatoms proportional zu einem Ausdruck der Form mit ganzen Zahlen und sind, führte zum Konzept der Quantenzahl und brachte Niels Bohr schließlich auf sein Bohrsches Atommodell, das erste – heute überholte – quantenmechanische Atommodell. Die moderne Quantenmechanik kann die Spektrallinien der Atome mit sehr hoher Genauigkeit vorhersagen.
Literatur
- Heinz Haferkorn: Optik. Physikalisch-technische Grundlagen und Anwendungen. 4. Auflage, Wiley-VCH 2003, ISBN 3-527-40372-8
- Ingolf Volker Hertel, Claus-Peter Schulz: Atome, Moleküle und optische Physik 1. Springer 2008, ISBN 978-3-540-30617-7
- Peter M. Skrabal: Spektroskopie, vdf Verlag, 2009, ISBN 978-3-8252-8355-1