Phosphate
Phosphate sind die Salze und Ester der Orthophosphorsäure (H3PO4).[1] Im weiteren Sinn werden auch die Kondensate (Polymere) der Orthophosphorsäure und ihre Ester Phosphate genannt.[1] Die Ester werden unter Phosphorsäureester beschrieben. Phosphor liegt bei allen diesen Verbindungen in der Oxidationsstufe (V) vor. Sauerstoffverbindungen des Phosphors mit anderen Oxidationsstufen sind unter Phosphor aufgelistet.
| Phosphate |
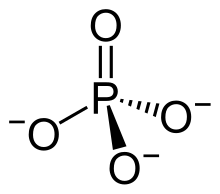 Das Anion PO43− |
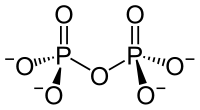 Ein Kondensat: Diphosphat |
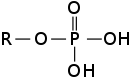 Ein Ester: Phosphorsäureester |
Varianten
Primäre, sekundäre und tertiäre Phosphate
Die Salze der dreibasigen ortho-Phosphorsäure (H3PO4) lassen sich in primäre, sekundäre und tertiäre Phosphate einteilen. Bei einwertigen Kationen M′ gelten die Summenformeln entsprechend M′H2PO4, M′2H1PO4 und M′3PO4. Durch die teilweise Neutralisation der Phosphorsäure erhält man Hydrogen- oder Dihydrogenphosphate. Diese können sowohl mit Säuren als auch mit Basen reagieren. Wegen dieser Eigenschaft enthalten viele Pufferlösungen Hydrogenphosphate.
| primäre Phosphate (Dihydrogenphosphate) | sekundäre Phosphate (Hydrogenphosphate) | tertiäre Phosphate |
|---|---|---|
| Natriumdihydrogenphosphat, NaH2PO4 | Dinatriumhydrogenphosphat, Na2HPO4 | Natriumphosphat, Na3PO4 |
| Kaliumdihydrogenphosphat, KH2PO4 | Dikaliumhydrogenphosphat, K2HPO4 | Kaliumphosphat, K3PO4 |
| Calciumdihydrogenphosphat, Ca(H2PO4)2 | Calciumhydrogenphosphat, CaHPO4 | Calciumphosphat, Ca3(PO4)2 |
| Weitere Beispiele siehe Kategorie:Phosphat | ||
Kondensate
Phosphorsäure kann in einer Kondensationsreaktion (Wasserabspaltung) Diphosphorsäure (H4P2O7) bilden. Analog gibt es entsprechende Salze, die Diphosphate (Pyrophosphate) M'4P2O7. Bei einer fortgesetzten Reaktion bilden sich auch poly- oder cyclo-Phosphate. cyclo-Phosphate werden oft Metaphosphate genannt. Polyphosphate und Metaphosphate sind also Polymere der Salze der Phosphorsäure.
| di-, poly- und cyclo-Phosphate | ||
|---|---|---|
| Name | Reaktion | Struktur des Anions |
| di-Phosphat (auch: Pyrophosphat) |
 | |
| tri-Phosphat (allg.: poly-Phosphat) |
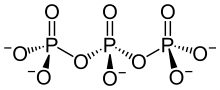 | |
| meta-Phosphat (allg.: cyclo-Phosphat) |
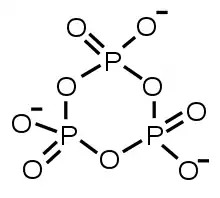 | |
Pentanatriumtriphosphat (Na5P3O10) und Metaphosphate wurden zur Wasserenthärtung in Waschmitteln verwendet. Als Lebensmittelzusatzstoffe finden z. B. Pentanatriumtriphosphat und Diphosphate Anwendung.
Gewinnung
Phosphate werden aus Mineralen wie zum Beispiel Apatit, Ca5[(PO4)3(OH,F,Cl)], gewonnen. Die Hauptvorkommen liegen im nördlichen Afrika (Marokko, Westsahara), Jordanien, Vereinigte Staaten (Florida), Russland (Kola-Halbinsel), Südafrika, Togo und China. Früher fanden sich die Phosphatvorkommen mit der höchsten Konzentration (Nauruit, welches aus Guano entstand) auf der Pazifikinsel Nauru. Die ursprünglichen Vorkommen sind seit 2003 erschöpft. 2004 wurden neue Vorkommen auf Nauru erschlossen. Saudi-Arabien ist seit 2006 einer der größten Produzenten weltweit.[2]
Die Ressourcen von Phosphaten sind begrenzt. Die meisten sind belastet mit Cadmium und/oder radioaktiven Schwermetallen. Manche Phosphatlagerstätten dienten bislang als Quelle für Uran. Man geht davon aus, dass die zur Düngerproduktion nutzbaren Phosphatlagerstätten früher erschöpft sein werden als die weltweiten Erdölvorkommen. Der Cadmiumgehalt der Phosphatlagerstätten ist sehr unterschiedlich. Viele Industrieländer haben bereits einen Grenzwert für Cadmium in Düngemitteln eingeführt. So ist weltweit nur noch eine Lagerstätte bekannt, die den Grenzwert der EU unterschreitet (Kola). In Entwicklungsländern dagegen wird Düngung mit billigeren cadmiumverunreinigten Phosphatdüngern durchgeführt.
Die früher in den Industrieländern praktizierte Nutzung von Thomasmehl (einem Nebenprodukt der Eisenerz-Verhüttung) ist auf Grund der hohen Chrombelastung aus Gesundheitsgründen ausgeschlossen. Eine weitere Möglichkeit ist, die im Klärschlamm vorhandenen gefällten oder biologisch angereicherten Phosphate zu nutzen oder zurückzugewinnen[3]. In Deutschland und anderen Ländern wird Klärschlamm bisher meist verbrannt, da er häufig zahlreiche Schwermetalle und endokrine Disruptoren enthält.
Da 85 % des in Deutschland verwendeten importierten Phosphats in die Landwirtschaft gehen, könnte ein Teil durch Klärschlamm ersetzt werden[3]. Im Wirtschaftsjahr 2003/2004 lag der Düngemittelabsatz laut den Erhebungen des Statistischen Bundesamtes bei 112.000 Tonnen Phosphor.[4] Dem sollte mit der Novellierung der Klärschlammverordnung 2017 Rechnung getragen werden, wonach „eine Rückgewinnung von Phosphor und eine Rückführung des gewonnenen Phosphors oder der phosphorhaltigen Klärschlammverbrennungsasche in den Wirtschaftskreislauf anzustreben“ ist.[5] Auch in der Schweiz wurden entsprechende Überlegungen angestellt.[6] Die Schweizer Dünger-Verordnung wurde 2001 entsprechend angepasst und es wurde ein Netzwerk für das Phosphorrecycling aufgebaut, an dem andere europäische Länder ebenfalls beteiligt sind. Inzwischen gibt es sieben entsprechende Pilotanlagen.[7]
Eigenschaften
Anionen und pH-Werte
In wässriger Lösung existieren Phosphat-Anionen in drei Formen. Unter stark basischen Bedingungen liegt das Phosphat-Anion hauptsächlich als (PO43−) vor, während unter schwach basischen Bedingungen das Hydrogenphosphat-Anion (HPO42−) dominiert. Unter schwach sauren Bedingungen liegt hauptsächlich das Dihydrogenphosphat-Anion (H2PO4−) vor. In stark saurer wässriger Lösung ist Phosphorsäure (H3PO4) die Hauptform.
Es liegen also drei pH-abhängige Gleichgewichtsreaktionen vor:
| Gleichgewichtsreaktionen | Gleichgewichtskonstante bei 25 °C | |
|---|---|---|
| (1) | ||
| (2) | ||
| (3) | ||
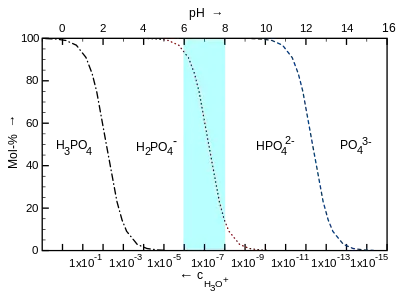 Diagramm | ||
Unter stark alkalischen Bedingungen, wie z. B. bei pH = 13 liegt im Wesentlichen PO43− und HPO42− vor. Ist die Lösung neutral (pH = 7.0) liegen H2PO4− (62 %) und HPO42− (38 %) vor. Bei pH = 7.4 dreht sich das Verhältnis der beiden Komponenten etwa um: 39 % H2PO4− und 61 % HPO42−. Unter stark sauren Bedingungen (pH=1) ist H3PO4 dominierend im Vergleich zu H2PO4−. HPO42− und PO43− sind praktisch abwesend.
Allgemeines
Mit Ausnahme der Alkali- und Ammonium-Verbindungen sind die meisten Phosphate schlecht wasserlöslich.
Phosphate können Verbindungen mit Schwermetallen eingehen. Diese Eigenschaft macht die Verwendung von Phosphaten problematisch, da die Phosphate aus dem Klärschlamm Schwermetalle mobilisieren können.
Zum überwiegenden Teil enthalten Lagerstätten von Phosphatverbindungen auch Schwermetalle, wie z. B. Cadmium und Uran.
Bedeutung für die Ernährung
In der menschlichen Ernährung spielt Phosphat eine wesentliche Rolle im Energiestoffwechsel und im Knochenumbau. Es verbindet sich mit Calcium zum festen Calciumapatit. Der Phosphatspiegel steht im engen Zusammenhang mit dem Calciumspiegel. Die Bedeutung von Phosphat für das Auftreten von Hyperaktivität bei Kindern gilt als widerlegt.[8]
Verwendung
Dünger
Die Hauptmenge der Phosphate kommt als Dünger zum Einsatz (siehe Phosphatdünger, Superphosphat, Doppelsuperphosphat).[9] Die Eignung von Phosphaten für die Düngung wurde durch Zufall entdeckt: bei der Eisen- und Stahlerzeugung nach dem Thomas-Verfahren fiel als Nebenprodukt das phosphatreiche Thomasmehl an, das sich als hervorragender Dünger erwies.
Durch Erosion von landwirtschaftlichen Flächen gelangen Phosphate an Tonminerale gebunden in Flüsse und Seen und von dort weiter in die Meere. In limnischen als auch marinen Ökosystemen tragen sie erheblich zur Eutrophierung bei. Phosphate sind unter anderem ein Auslöser von Blaualgenblüten (Cyanobakterien) in der Ostsee.
Waschmittelzusatz
Zur Enthärtung von Wasser kann Pentanatriumtriphosphat verwendet werden. Auf den Einsatz von Phosphaten in Waschmitteln wird in Teilen Europas inzwischen verzichtet, da sie zu einer Überdüngung und schließlich zum Umkippen von Gewässern geführt haben. Als Ersatz wird hierzu Zeolith A eingesetzt. In Maschinengeschirrspülmitteln werden allerdings immer noch Tripolyphosphate als Enthärter verwendet.[10] Tests der Stiftung Warentest im Jahr 2015 und 2016 haben gezeigt, dass einige phosphatfreie Spülmaschinentabs bereits eine vergleichbar gute Reinigungswirkung erzielen wie phosphathaltige Mittel.[11][12] Die Detergenzienverordnung (EG) Nr. 648/2004 schreibt durch die Änderungsverordnung (EU) Nr. 259/2012 im Anhang VIa vor, dass ab dem 1. Januar 2017 nur noch Maschinengeschirrspülmittel für Privatverbraucher in den Verkehr gebracht werden dürfen, die weniger als 0,3 Gramm Phosphor pro Standarddosierung enthalten.[13][14]
Lebensmittelzusatzstoff
Natriumphosphat (E 339), Kaliumphosphat (E 340), Calciumphosphat (E 341), Magnesiumphosphate (E 343) und die Salze der ortho-Phosphorsäure Diphosphat (E 450), Triphosphat (E 451) und Polyphosphat (E 452) sind als Lebensmittelzusatzstoffe zugelassen und werden als Konservierungsmittel, Säuerungsmittel, Säureregulator, als Trennmittel und Emulgator eingesetzt. Phosphat wird für nichtalkoholische, aromatisierte Getränke (Colagetränke; in diesen auch als Phosphorsäure (E 338)), sterilisierte und ultrahocherhitzte Milch, eingedickte Milch, Milch- und Magermilchpulver und als technischer Hilfsstoff (verhindert das Zusammenklumpen von rieselfähigen Lebensmitteln) verwendet. Phosphate spielen auch bei der Lebensmittelherstellung (vor allem in der Fleischindustrie) eine sehr große Rolle und sind Komponenten des Schmelzsalzes für Schmelzkäse.
Eine erhöhte Phosphatzufuhr über die Nahrung steigert den Blutdruck und die Pulsrate auch bei gesunden jungen Erwachsenen.[15][16]
Sonstige Verwendungen
Futtermittel, Korrosionsschutzmittel (siehe Phosphatierung); Flammschutzmittel; Puffersubstanz für neutralen pH-Bereich (s. o.), Akkumulatoren (Lithium-Eisenphosphat-Akkumulator).
32P, ein radioaktives Isotop des Phosphors, wird in Form von Dihydrogenphosphat (oder Natriumphosphat) vielseitig in der Forschung und in der nuklearmedizinischen Therapie speziell bei Polycythaemia vera eingesetzt (Radiophosphortherapie).
Nachweis
Nachweisreaktionen von Phosphaten werden unter Phosphor beschrieben.
Weblinks
Phosphorama - Ohne Phosphor kein Leben Artikelserie mit Hintergrund-Recherchen rund um die lebenswichtige Ressource Phosphor bei RiffReporter.de (2021)
Einzelnachweise
- Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie. Spektrum Akademischer Verlag, Heidelberg, 2001.
- Ma’aden Phosphate Development (Saudi Arabian Mining Company). Worley Parsons.
- Der letzte Dreck? Phosphor-Recycling aus Klärschlamm. In: RiffReporter. 9. März 2021, abgerufen am 4. November 2021.
- Forschungsbericht zu Phosphorgewinnung aus Klärschlamm im Auftrag des Umweltbundesamtes, Seite 37
- siehe Klärschlammverordnung § 3 Absatz 1 Satz 2
- Bundesamt für Umwelt, BAFU 2009: Rückgewinnung von Phosphor aus der Abwasserreinigung
- Aktuelles aus dem Phosphornetzwerk Schweiz
- Manfred Döpfner: Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS). Hogrefe Verlag, 2013, ISBN 978-3-840-91939-8 (eingeschränkte Vorschau in der Google-Buchsuche).
- Phosphorverbrauch in Deutschland und Europa. In: RiffReporter. 12. Februar 2021, abgerufen am 4. November 2021.
- Phosphate in Geschirrspülmitteln. IDW-Online, 26. Januar 2012.
- Spülmaschinen-Tabs im Test der Stiftung Warentest In: test, 5/2015, S. 62–66 und test.de vom 23. April 2015.
- Geschirrspülmittel: Die Phosphatfreien können‘s jetzt auch! In: test, 8/2016, S. 71–75 und test.de vom 5. Oktober 2016.
- EU: Bericht der Kommission an das Europäische Parlament und den Rat gemäß Artikel 16 der Verordnung (EG) Nr. 648/2004 des Europäischen Parlaments und des Rates vom 31. März 2004 über Detergenzien betreffend die Verwendung von Phosphaten in für den Verbraucher bestimmten Maschinengeschirrspülmitteln, 29. Mai 2015.
- EU: Verordnung (EU) Nr. 259/2012 des europäischen Parlaments und des Rates vom 14. März 2012 zur Änderung der Verordnung (EG) Nr. 648/2004 in Bezug auf die Verwendung von Phosphaten und anderen Phosphorverbindungen in für den Verbraucher bestimmten Waschmitteln und Maschinengeschirrspülmitteln, 30. März 2012.
- Erhöhte Phosphatzufuhr steigert den Blutdruck bei gesunden Erwachsenen. In: unibas.ch. 23. August 2018, abgerufen am 30. März 2019.
- Jaber Mohammad, Roberto Scanni, Lukas Bestmann, Henry N. Hulter, Reto Krapf: A Controlled Increase in Dietary Phosphate Elevates BP in Healthy Human Subjects. In: Journal of the American Society of Nephrology. 29, 2018, S. 2089, doi:10.1681/ASN.2017121254.