Bimetallkorrosion
Bimetallkorrosion (auch Kontaktkorrosion, galvanische Korrosion) nach DIN EN ISO 8044 ist eine Korrosion durch elektrochemische Reaktion zweier verschiedener metallischer Werkstoffe oder anderer elektronenleitender Festkörper. Voraussetzung ist eine unterschiedliche Position in der elektrochemischen Spannungsreihe, unterschiedliche Korrosionsbeständigkeit der Werkstoffe, ihr unmittelbarer Kontakt und die gemeinsame Benetzung durch ein wässriges Korrosionsmedium. So bildet sich ein galvanisches Korrosionselement, vergleichbar mit einer kurzgeschlossenen Batterie: Infolge des erzeugten Stroms wird der weniger edle (d. h. weniger korrosionsbeständige) Werkstoff durch elektrochemischen Abtrag zerstört.


Im Alltag macht sich diese Korrosionsart beispielsweise bemerkbar
- beim Einsatz von Schrauben, Muttern, Nägeln oder Nieten aus weniger edlen metallischen Werkstoffen auf Bauteilen aus rostfreiem Stahl, Messing oder Kupfer
- wenn Kupferdrähte mit Aluminiumdrähten zusammengeklemmt wurden, um elektrischen Strom zu leiten. Auch intermetallische Verbindungen,[1] die durch die Berührung der Metalle entstehen, haben einen Einfluss auf die Korrosion.[2]
- Wenn in einem Wasserleitungs- oder Heizungssystem unterschiedliche Metallwerkstoffe verbaut sind (etwa bei Wärmetauscherrohren im Heizkessel, Zuleitungen, Heizkörpern und Solarkollektoren).
- Kupferblech auf Dächern wird deshalb immer mit Kupfernägeln befestigt.
Obwohl die Ursachen seit Beginn des 19. Jahrhunderts bekannt sind, hat die Bimetallkorrosion immer wieder zu Schäden und Unfällen geführt.
Reaktion
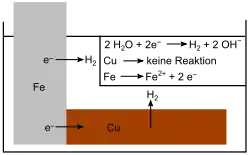
Zwei unterschiedliche Metalle in elektrischem Kontakt werden in einem flüssigen Medium, das als Elektrolyt wirken kann, wie normalerweise Wasser mit darin gelösten Salzen, zu Elektroden. Aufgrund unterschiedlicher Elektrodenpotentiale baut sich eine elektrische Spannung zwischen ihnen auf, sodass Elektronen der Atome des weniger edlen Metalls in das edlere Metall wandern und von dort aus zu einer Reaktion mit dem Elektrolyten führen. Im Gegenzug reagieren die Ionen des weniger edlen Metalls mit dem Elektrolyten. Durch den Kurzschluss zwischen den Metallen und den Ionenstrom im Elektrolyten entsteht ein geschlossener Stromkreis, der das Ausmaß der Redoxreaktion bestimmt: Die Anode wird oxidiert und dadurch allmählich zerstört, die Kathode dagegen reduziert und dadurch geschützt.
Die elektrische Spannung zwischen den Werkstoffen hängt vor allem von der Differenz ihrer Standardpotentiale ab, die aus der elektrochemischen Spannungsreihe ersichtlich sind, außerdem auch von den Konzentrationen der Lösungsbestandteile (Nernstsche Gleichung). Die Korrosion hängt vom tatsächlich fließenden Strom ab, auf die Flächen bezogen also von der Stromdichte. Ein Gleichstrom aus einer externen Quelle kann diesen Strom verstärken, was in der Mikroelektronik von Bedeutung ist.
Für Bimetallkorrosion müssen drei Voraussetzungen erfüllt sein: ein elektrischer Kontakt, eine elektrolytische Verbindung und eine Potentialdifferenz der beiden Metalle. Großflächige Anoden sind gegenüber kleinflächigen Kathoden weniger korrosionsgefährdet als umgekehrt. Eine größere Potentialdifferenz, ein zunehmendes Flächenverhältnis von edlem zu unedlem Werkstoff, höhere Temperaturen und zunehmende Aggressivität des Elektrolyten (siehe pH-Wert) vergrößern die Korrosionswirkung.[3]
Weitere Erscheinungsformen
Bimetallkorrosion kann auch zwischen den Bestandteilen einer Legierung auftreten, wenn Ausscheidungen an den Korngrenzen der Kristalle an der Oberfläche ein Lokalelement oder Mikroelement bilden. Ein Beispiel ist Graphit und Eisen in Gusseisen: Graphit wirkt gegenüber Eisen wie ein edleres Metall und kann zu Spongiose führen.[4]
Wenn Zerspanungswerkzeuge abwechselnd für edle und für unedle Werkstoffe verwendet werden, können die unedlen durch zurückgebliebene oder eingepresste Partikel, wie etwa Schleifstaub, korrodieren.
Ein „Verschleppen“ von Material liegt auch der Korrosion zugrunde, die mit der sogenannten Fließregel nach DIN 1988-7 für Rohrleitungen verhindert werden soll: Wenn Leitungen aus unterschiedlichen Werkstoffen verbunden werden und genügend Sauerstoff im Rohr vorhanden ist wie bei Trinkwasser, können sich zum Beispiel gelöste Kupferionen auf verzinktem Stahl ablagern und dadurch Bimetallkorrosion verursachen. Um dies zu verhindern, sollten die weniger edlen Metalle in der Fließrichtung gesehen vor den edleren angeordnet werden.[5]
Schutz
Zum Schutz vor Bimetallkorrosion gibt es zwei Strategien: Entweder wird versucht, die Elektrolyse zu unterbinden (passiver Korrosionsschutz), oder sie wird gesteuert eingesetzt (aktiver Korrosionsschutz).
Verhinderung der Elektrolyse

Elektrolyse kann nicht auftreten, wenn eine elektrisch leitende Verbindung zwischen den Werkstoffen durch Isolation oder ein Kontakt des Metalls mit Elektrolyten durch Dichtung verhindert werden.
Der direkte Kontakt von aus verschiedenen Materialien bestehenden Rohrleitungen wird beispielsweise durch sogenannte Trenn- oder Isolationsfittings oder Trennverschraubung verhindert. Analog dazu gibt es für die Elektroinstallation Aluminium-Kupfer-Verbinder. Sie verhindern die Zersetzung des Aluminiums, die zur Erhöhung des elektrischen Widerstands führt.
Der Schutz vor elektrisch leitenden Flüssigkeiten (Elektrolyten) kann durch eine Beschichtung erfolgen. Alternativ kann die Wirksamkeit der Elektrolyten durch Chemikalien (Korrosionsinhibitoren) verringert werden.
Bildet sich der Elektrolyt durch die Einwirkung von Luftfeuchtigkeit, so können Maßnahmen zur Entfeuchtung der Luft oder zur Verhinderung von Kondensation getroffen werden.
Durch eine entsprechende Werkstoffwahl können die vorliegenden Potentialdifferenzen von vorneherein vermindert werden(vergl. Fließregel Rohrleitungsbau).
Die Beschichtung mit einer edleren Metallschicht ist nur solange wirksam, wie diese Schicht intakt bleibt; bei geringfügigen Beschädigungen setzt die Korrosion verstärkt ein. Dies ist zum Beispiel ein Problem beim Weißblech von Lebensmittelbehältern oder bei Vergoldungen in der Zahntechnik.[6] Beim aktiven Schutz von Stahl durch das unedlere Zink (siehe folgenden Abschnitt) wird demgegenüber der blanke Stahl auch bei geringfügiger Verletzung der Zinkschicht vor Korrosion geschützt.
Aktiver Korrosionsschutz

Ein kontrollierter Einsatz der Elektrolyse erfolgt bei „aktiven“ Schutzmaßnahmen:
- Durch Einsatz einer Opferanode, etwa aus Zink oder Magnesium, wird die Bimetallkorrosion auf diese beschränkt. Der zu schützende Werkstoff wird damit zur Kathode gemacht (kathodischer Schutz). Opferanoden werden typischerweise an der Außenhaut von Schiffen sowie an den Innenwänden von Pipelines und Flüssigkeitsbehältern eingesetzt.
- Auch infolge einer aktiven Beschichtung mit einem weniger edlen Metall (wie dem Verzinken von Stahl) wird das beschichtete Metall erst dann angegriffen, wenn die Beschichtung vollständig korrodiert ist.
- Fremdstromanoden werden mit einer permanent anliegenden elektrischen Spannung versorgt, um die werkstoffbedingten Potentialdifferenzen auszugleichen. Sie werden häufig in größeren Flüssigkeitsbehältern eingesetzt.
Passivierung
Eine Mischung beider Strategien ist die Passivierung: Die Korrosion wird zugelassen oder gefördert, wenn sich dadurch eine schützende Oxidschicht auf dem weniger edlen Metall bildet. Der zu schützende Werkstoff wird zur Anode gemacht und bildet eine Oxidschicht, die korrosionsbeständiger sein kann als viele edlere Metalle. Zur Berechnung dieser Schutzwirkung dient das Pilling-Bedworth-Verhältnis. Chromstahl wird geschützt, indem sein Legierungsbestandteil Chrom eine Oxidschicht bildet. Passivierung kann auch gezielt erzeugt werden: Vor allem bei Leichtmetallen wie Aluminium und seinen Legierungen ist das Anodisieren ein gebräuchlicher Korrosionsschutz.[7] Wegen seiner stabileren Oxidschicht kommt bei hoher Beanspruchung Titan zum Einsatz.
Geeignete Werkstoff-Kombinationen
Befestigungsmittel im Bauwesen
Wenn ein metallisches Bauteil unedler ist und zugleich eine kleinere Oberfläche hat als ein benachbartes Bauteil, ist es in der Regel korrosionsgefährdet.
Im Bauwesen kann man eher als in anderen Bereichen der Technik von Faustregeln ausgehen. Die nachfolgend genannten Empfehlungen gelten unter folgenden Bedingungen:[8]
- Der jeweils zuerst genannte Werkstoff bezieht sich auf Schrauben und andere Befestigungsmittel sowie Beschlagteile, die eine wenigstens 10 bis 40 mal kleinere Oberfläche haben, als das aufnehmende Bauteil
- Ein mäßig aggressives Korrosionsmedium (Kondenswasser, Regenwasser u. ä.). In der Nähe von Meerwasser sind eventuell zusätzliche Schutzmaßnahmen erforderlich.
- Gemäßigte Umgebungs- und Materialtemperaturen
Rostfreier Stahl kann gut mit größeren Bauteilen aus Kupfer, Messing und Stahl, sowie sehr gut mit größeren Bauteilen aus Aluminium kombiniert werden.
Aluminium kann gut mit größeren Bauteilen aus rostfreiem Stahl, Kupfer und Messing kombiniert werden. Dies gilt im Allgemeinen auch für größere Bauteile aus blankem Stahl.
Kupfer kann gut mit größeren Bauteilen aus Messing kombiniert werden. Dies gilt im Allgemeinen auch für größere Bauteile aus rostfreiem Stahl, Aluminium und Stahl.
Messing kann gut mit größeren Bauteilen aus Kupfer kombiniert werden. Dies gilt im Allgemeinen auch für größere Bauteile aus rostfreiem Stahl, Aluminium und Stahl.
Verzinkter und anschließend schwarz passivierter Stahl kann gut mit blau und gelb passiviertem, verzinkten Stahl kombiniert werden. Dies gilt im Allgemeinen auch für größere Bauteile aus blankem Stahl. Die Kombination mit größeren Bauteilen aus Kupfer, Messing, Aluminium und rostfreiem Stahl ist wenig empfehlenswert.
Verzinkter und anschließend gelb passivierter Stahl kann gut mit größeren Bauteilen aus blau passiviertem, verzinkten Stahl kombiniert werden. Dies gilt im Allgemeinen auch für größere Bauteile aus blankem Stahl und schwarz passiviertem, verzinkten Stahl. Die Kombination mit größeren Bauteilen aus Kupfer, Messing, Aluminium und rostfreiem Stahl ist nicht empfehlenswert.
Verzinkter und anschließend blau passivierter Stahl kann im Allgemeinen mit größeren Bauteilen aus blankem Stahl, sowie mit schwarz und gelb passiviertem, verzinkten Stahl kombiniert werden. Die Kombination mit größeren Bauteilen aus Kupfer, Messing, Aluminium und rostfreiem Stahl ist nicht empfehlenswert.
Die Kombination von blankem Stahl mit größeren Bauteilen aus verzinktem Stahl ist nicht empfehlenswert und die Kombination mit größeren Bauteilen aus Kupfer, Messing, Aluminium und rostfreiem Stahl sollte unbedingt vermieden werden.
Fließregel für Trinkwasserinstallationen
In Rohrleitungen, die sauerstoffreiches Wasser wie Trinkwasser führen, können zum Beispiel aus Kupferrohren gelöste Kupferionen vom Wasser transportiert und sich im weiteren Verlauf auf verzinktem Stahl ablagern und zu Lochfraßkorrosion führen.
Die sogenannte Fließregel nach DIN 1988-7 besagt, dass in Fließrichtung des Mediums immer edlere Metalle verwendet werden müssen.[9]
Insbesondere ist darauf zu achten, dass kein Stahl oder verzinkte Stahlrohre in Fließrichtung hinter Kupferleitungen installiert werden (emaillierte Warmwasserspeicher!). Kupferleitungen hinter verzinkten Rohren stellen demgegenüber im Allgemeinen kein Problem dar. Wenn Rückströmungen aufgrund von Druckschwankungen nicht ausgeschlossen sind, sollten beide Werkstoffe jedoch nicht direkt verbunden, sondern durch ein Zwischenstück aus Rotguss oder Messing oder besser Trennverschraubung getrennt werden.
Heizkreisläufe
In geschlossenen Heizkreisläufen ist die Sauerstoffsättigung im Wasser gering. Bei der Verwendung von geeigneten Materialien tritt kaum noch elektrochemische Korrosion auf, wenn der im Wasser enthaltene Sauerstoff verbraucht ist. In den früher verwendeten offenen Heizsystemen sowie durch nicht sauerstoffdichte Kunststoffleitungen konnte demgegenüber immer wieder Sauerstoff in den Kreislauf gelangen.
Auf die Verwendung von innen verzinkten Stahlrohren sollte in Heizkreisläufen verzichtet werden, da sich die entstehenden Reaktionsprodukte als Schlamm im Heizsystem ablagern. Die Kombination von Rohren aus blankem Stahl und Kupfer hat sich demgegenüber bewährt. Auch die Verwendung von Bauteilen aus Messing, Rotguss, Edelstahl und Aluminium ist im Heizkreislauf meist problemlos möglich. Der Einsatz von Aluminium erfordert jedoch die Kontrolle und Steuerung des pH-Werts.
Geschichte

Bimetallkorrosion ist so alt wie die Metallverarbeitung, konnte aber erst systematisch bekämpft werden, als man den Mechanismus ihrer Entstehung verstand. Römische Holzschiffe waren ab etwa 500 v. Chr. (siehe Schiffe der Antike) mit einer Bleihaut überzogen, die mit Kupfernägeln befestigt wurde. Dadurch entwickelte sich im stark elektrolytischen Meerwasser Bimetallkorrosion zwischen dem halbedlen Kupfer und dem unedlen Blei. Es gibt Funde von mit Blei beschichteten Kupfernägeln, die dieses Problem offenbar verringerten.[10]
Die erste Studie zur Bimetallkorrosion wurde von der Royal Navy im Jahr 1763 in Auftrag gegeben, weil Eisennägel zur Sicherung von Kupferplatten am Rumpf der Fregatte HMS Alarm ungewöhnlich schnell korrodierten.[11] Die Ursachen konnten allerdings nicht vor der Begründung der Elektrizitätslehre durch Alessandro Volta und der Elektrolyse durch Alexander von Humboldt 1795 verstanden werden. Johann Wilhelm Ritter bemerkte 1798, dass die Spannungsreihe der Metalle identisch mit der Reihe ihrer Korrosionsbeständigkeit ist. Erst der britische Chemiker Humphry Davy konnte seine Versuche auf theoretische Überlegungen stützen und entdeckte 1824, dass Kupfer am Rumpf von Kriegsschiffen durch das Anbringen von Zink- und Gusseisenplatten als Opferanoden geschützt werden konnte. Sein Schüler Michael Faraday fand 1833 eine Berechnungsgrundlage zur Verbesserung dieses Korrosionsschutzes, indem er feststellte, dass die Masse der korrodierten Materie proportional zur elektrischen Ladung ist (siehe Faradaysche Gesetze). Fremdstromanoden, die eine Elektrizitätsversorgung voraussetzen, setzten sich erst seit Beginn des 20. Jahrhunderts allmählich durch.[10]
Anlässlich der Renovierung der Freiheitsstatue zum 100-Jahr-Jubiläum Mitte der 1980er Jahre wurde entdeckt, dass eine Beschichtung aus Schellack und Asbest, die das Eisengerüst elektrisch von seiner Kupferverkleidung isolieren sollte, porös geworden war und Elektrolyten Platz bot, sodass die Bimetallkorrosion weit fortgeschritten war.[12]
Beim NATO-Hubschrauber NH90 wurde festgestellt, dass sich die graphitähnlichen Kohlenstofffasern in kohlenstofffaserverstärktem Kunststoff wie edles Metall verhalten und beim Kontakt mit Metallen zu Bimetallkorrosion führen.[13]
Literatur
- DIN EN ISO 8044:2015-12 Korrosion von Metallen und Legierungen – Grundbegriffe und Definitionen.
- Helmut Kaesche: Die Korrosion der Metalle: Physikalisch-chemische Prinzipien und aktuelle Probleme. 3. Auflage, Springer, Berlin 2011, ISBN 978-3642184284.
- Elsbeth Wendler-Kalsch, Hubert Gräfen: Korrosionsschadenkunde. Springer, Berlin 2012, ISBN 978-3642304316.
Weblinks
- Harald Schreckenberger: Risiko der Kontaktkorrosion bei CFK-Bauteilen, Stuttgart 2013, PDF aufgerufen am 4. Juni 2016
Einzelnachweise
- Vgl. R. Schneider et al.: Langzeitverhalten von Aluminium-Kupfer-Verbindungen in der Elektroenergietechnik, in: Metall, 63:2009, H. 11, S. 591–594, URL: https://www.kupferinstitut.de/fileadmin/user_upload/kupferinstitut.de/de/Documents/techUnterstuetzung/KS/Artikel/2009/591_Cu_Schneider.pdf, abgerufen am 2. Sep. 2018.
- Friedrich Ostermann: Anwendungstechnologie Aluminium, 3. Auflage, Springer, Wiesbaden 2014, S. 233. ISBN 978-3-662-43806-0
- Klaus Mörbe, Wolfgang Morenz, Hans-Werner Pohlmann, Helmut Werner: Praktischer Korrosionsschutz: Korrosionsschutz wasserführender Anlagen. Springer, Berlin 2013, S. 25. ISBN 978-3709188941
- Herbert Beneke: Lexikon der Korrosion und des Korrosionsschutzes. 2. Auflage, Vulkan, Essen 2000, S. 251. ISBN 3-8027-2918-8
- Franz-Josef Heinrichs, Bernd Rickmann: Technische Regeln für Trinkwasser-Installationen: Installation. Kommentar zu DIN EN 806-4. Beuth, Berlin 2012, S. 64. ISBN 978-3410224891
- Heinrich F. Kappert, Karl Eichner: Zahnärztliche Werkstoffe und ihre Verarbeitung. 1. Grundlagen und Verarbeitung. Thieme, Stuttgart 2005, S. 168. ISBN 978-3131271488
- Andreas Kalweit, Christof Paul, Sascha Peters, Reiner Wallbaum: Handbuch für technisches Produktdesign: Material und Fertigung. Springer, Berlin 2006, S. 532. ISBN 978-3540214168
- Aufstellung empfohlener Werkstoffpaarungen des Baustoffherstellers Würth: https://wueko.wuerth.com/medien/produktinfo0000/pdfNEW/07570.pdf, abgerufen am 14. April 2018.
- Erläuterung der Fließregel auf bosy-online.de . Abgerufen am 13. Mai 2019.
- Walter von Baeckmann, W. Schwenk: Handbuch des kathodischen Korrosionsschutzes: Theorie und Praxis der elektrochemischen Schutzverfahren. 4. Auflage, Wiley, Weinheim 1999, S. 2–4. ISBN 978-3527625734
- K. R. Trethewey, J. Chamberlain: Corrosion: for Students of Science and Engineering. Longman, Harlow 1992, S. 4–5. ISBN 978-0582450899
- Robert Baboian, E. Blaine Cliver, E. Lawrence Bellante: The Statue of Liberty Restoration: Proceedings of The Statue of Liberty, Today for Tomorrow Conference, October 20-22, 1986. National Association of Corrosion Engineers, New York 1990, S. 94. ISBN 978-1877914126
- http://augengeradeaus.net/2014/07/korrosion-beim-niederlaendischen-marine-nh90-der-bericht-zum-nachlesen/comment-page-1/ aufgerufen am 4. Juni 2016