Anode
Eine Anode (von griechisch ἄνοδος ánodos „Aufstieg“, wörtlich „Weg nach oben“)[1] ist eine Elektrode, die beispielsweise aus einem Vakuum freie Elektronen aufnimmt oder aus einem Elektrolyten unter Elektronenaufnahme Anionen entlädt oder Kationen erzeugt, also Oxidationsreaktionen stattfinden lässt. Eine Anode entspricht somit einem Elektronenakzeptor bzw. verhält sich formal wie ein Oxidationsmittel.
Die Gegenelektrode der Anode ist die Kathode, an der reduzierende Prozesse ablaufen. Anionen wandern zur Anode und Kationen zur Kathode. Die Polarität einer Anode kann positiv oder negativ sein, wenn elektrochemische Vorgänge ablaufen, siehe unten. In früheren Jahren wurde die Anode einer Röntgenröhre auch als Antikathode bezeichnet.
Bei der Galvanik wird durch ein elektrolytisches Bad Strom geschickt. Am Pluspol (Anode) befindet sich das Metall, das aufgebracht werden soll (z. B. Kupfer oder Nickel), am Minuspol (Kathode) der zu beschichtende Gegenstand.
Chemie
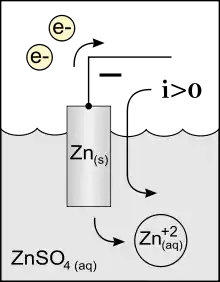
In der Chemie, insbesondere der Elektrochemie, ist eine Anode die Elektrode, an der eine Oxidationsreaktion stattfindet. Es werden Elektronen aus der chemischen Reaktion aufgenommen und über den elektrischen Anschluss abgegeben. Eine elektrochemische Reaktion findet immer an der Phasengrenze zwischen einer Elektrode und einer Elektrolytlösung, einem ionenleitenden Feststoff oder Schmelze statt. Daher ist bei Elektrolysen die Anode die positive Elektrode. (Elektrolysen benötigen elektrische Energie.)
Bei elektrochemischen Elementen, die elektrische Energie erzeugen, finden an der Anode Oxidationsvorgänge statt, d. h., die aus dem Elektrolyten kommenden Anionen werden entladen bzw. neutrale Atome werden zu Kationen. Werden die Anode und Kathode nun zu einem Stromkreis verbunden, fließen über diese äußere Verbindung Elektronen zur Kathode, in diesem äußeren Stromkreis wirkt die Anode dann als Minuspol (z. B. bei Batterien und Brennstoffzellen).
Bei wiederaufladbaren Batterien (Sekundärelement, Akkumulator) kann dieselbe Elektrode abwechselnd als Anode oder Kathode arbeiten, je nachdem ob die Batterie geladen oder entladen wird.
Sogenannte Opferanoden aus einem relativ unedlen Metall dienen als Korrosionsschutz, wobei sie selbst aufgelöst werden.
Elektrotechnik

In der Elektrotechnik ist die Anode eine Elektrode einer Elektronenstrahlröhre, Leuchtstofflampe, Diode, Brennstoffzelle, Bleiakkumulator und so weiter. Dabei ist die Anode die Elektrode, an der Elektronen vom umgebenden Medium (Elektrolyt, Vakuum, Silizium) auf die Elektrode übergehen und dann durch den außen liegenden elektrischen Stromkreis zur Kathode fließen.[2] Da sich die Bezugsrichtung für den Stromfluss auf positive Ladungsträger bezieht, und damit der Bewegungsrichtung von Elektronen entgegengerichtet ist, fließt also der Strom im äußeren Stromkreis von der Kathode zur Anode. Innerhalb des betrachteten Bauteils fließt der Strom von der Anode zur Kathode; der Stromkreis ist geschlossen.
Diese Aussage hat nichts damit zu tun, ob das Potential der Anode höher oder niedriger als das Potential der Kathode ist (mit anderen Worten: ob die Spannung von Anode zu Kathode positiv oder negativ ist). Dafür gibt es die Begriffe Pluspol und Minuspol; dabei ist das Potential des Pluspols immer größer als das Potential des Minuspols. Daher ist die Spannung vom Pluspol zum Minuspol immer größer als null. Damit geben Pluspol und Minuspol die Spannungsrichtung an, während Anode und Kathode mit der Stromrichtung einhergehen.
Bei Bauteilen, bei denen die Anode positive Spannung gegenüber der Kathode aufweist, wird elektrische Energie in eine andere Energieform (Wärme, chemische Energie, …) gewandelt, z. B. bei einer Röhrendiode, einer Kathodenstrahlröhre oder einem Akkumulator, der geladen wird. Bei Bauteilen, bei denen die Anode negative Spannung gegenüber der Kathode aufweist, wird elektrische Energie auf Kosten einer anderen Energieform (z. B. chemischer Energie) an den äußeren elektrischen Stromkreis abgegeben, z. B. bei einer Brennstoffzelle oder einem Akkumulator, der entladen wird.
Geschichte
Zur Namensgebung durch Michael Faraday siehe faradaysche Gesetze.
Weblinks
Einzelnachweise
- Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. 9. Auflage. Freytag, München u. a. 1965.
- Elektrischer Pol der positiver Pol (Pluspol, kurz Plus, Zeichen + oder Anode) wird zumeist der Farbkodierung „Rot“ zugeordnet