Schmelzflusselektrolyse
Die Schmelzflusselektrolyse ist ein Elektrolyseverfahren, bei dem kein wässriges Medium, sondern eine heiße Salzschmelze als Elektrolyt dient. Sie dient zur Herstellung bzw. Gewinnung von Aluminium, aller Alkalimetalle und der meisten Erdalkalimetalle, außerdem auch von einigen Kunststoffen. Auch liefert das Verfahren Fluor und Chlor.
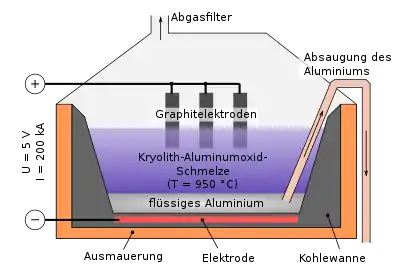
Da die sogenannten „unedlen“ Metalle Kalium, Natrium, Magnesium und Aluminium in der elektrochemischen Spannungsreihe unter dem Wasser (H2O) stehen, können sie nicht durch Elektrolyse aus wässrigen Lösungen abgeschieden werden, da somit eher Wasser zu H2 + 2 OH− reduziert werden würde. Um die Salze zu schmelzen benötigt man sehr hohe Temperaturen: für die Aluminiumherstellung mit Kryolith benötigt man 960 °C, für Natrium aus Natriumchlorid ca. 620 °C, für Magnesium aus MgCl2 und Zusätzen ca. 670 °C. Auch Fluor kann nicht aus wässrigen Lösungen von Fluoriden mittels Elektrolyse abgeschieden werden, da statt Fluor Sauerstoff entsteht.
Zur Herstellung u. a. dieser Stoffe wendet man deshalb die Elektrolyse aus einer Schmelze ihrer Salze an, was dem Verfahren seinen Namen gab. Beispielhaft ist die Schmelzflusselektrolyse im Hall-Héroult-Prozess beschrieben.
Labormaßstab
Im Labormaßstab werden Salzschmelzen mitunter im gebogenen V-Rohr aus hochschmelzenden Pyrex, Jenaer Glas oder Porzellan im elektrischen Ofen durchgeführt. Als Kathodenmaterial kann ein Eisenstab dienen, als Anode wird häufig ebenfalls ein Eisen- oder ein Kohlestab (Acheson-Graphit) verwendet. Kohleanoden können durch Einwirkung von Sauerstoff oder Fluor bei der Schmelzflusselektrolyse angegriffen werden, wobei CO und CO2 bzw. Fluorverbindungen entstehen, wobei die Elektrode nach und nach abgetragen wird.
Produktion
In der Produktion nutzt man häufig Elektrolysezellen, bei denen die eine Elektrode (meist Kathode) im Boden eingelassen ist, die andere Elektrode (Anode) taucht parallel zur ersteren in die Salzschmelze. Als Zellmaterialien eignen sich Beton, Steinzeug, Schamott, Porzellan oder Glas. Als Elektrodenmaterialien können Kohle oder Eisen dienen.
Beachtenswertes bei der Schmelzflusselektrolyse
- Zur Herabsetzung der oft hohen Schmelztemperatur werden vielfach Salzgemische statt der reinen Salze verwendet (Bildung eines Eutektikums). Besonders beliebte Salzzusätze sind Kaliumchlorid und Calciumfluorid.
- Der elektrische Widerstand der Schmelze bewirkt, dass die Schmelze gleichzeitig wie eine Widerstandsheizung arbeitet, diese und sonstige Stromverluste die Schmelztemperaturen aufrechterhalten und zusätzlich Wärme für die endotherme Reaktion der Reduktion liefern[1][2]. Die gespeicherte Energie (Reaktionsenthalpie) wird bei der exothermen Gegenreaktion (Oxidation) freigesetzt und beispielsweise bei Aluminium enthaltenden Thermit-Mischungen praktisch angewandt und genutzt.
- Die Stromdichte bei der Schmelzflusselektrolyse sollte möglichst hoch sein. Bei zu geringen Stromstärken nimmt der Faradaysche Umsatz stark ab.
- Falls der Elektrodenabstand sehr gering ist (Abstand kleiner als 1 cm) kann das Metall als „Metallnebel“ durch Diffusion oder Wirbel zur Anode wandern und den Umsatz verringern. Metallnebel lassen sich oft durch Einkapselungen (Ummantelung der Kathode mit Pyrexglas oder Porzellan) verringern.
- Sie funktioniert nur bei Gleichstrom und nicht bei Wechselstrom.
Reaktionsgleichungen
Am Beispiel einer Natriumchlorid-Schmelze:
An der positiv geladenen Anode spielt sich folgende Reaktion ab:
- Zwei Chloridionen werden zu elementarem Chlor oxidiert.
An der negativ geladenen Kathode findet folgende Reaktion statt:
- Zwei Natriumionen werden zu elementarem Natrium reduziert.
Die gesamte Redoxreaktion sieht wie folgt aus:
Das Chloridion gibt Elektronen ab und das Natriumion nimmt diese auf. Dabei kommt es also zu einem Elektronenübergang, der sich in der Redoxreaktion widerspiegelt.
| Metall | Ausgangssalze | Temperatur (°C) | Spannung (V) |
|---|---|---|---|
| Natrium | Natriumchlorid mit CaCl2 und BaCl2 | 600 | 7 |
| Kalium | Kaliumchlorid | 360–380 | 4–7 |
| Magnesium | MgCl2, KCl, 1 % CaF2 | 670–730 | 12 |
| Calcium | CaCl2, CaF2 | 680–800 | 25–40 |
| Beryllium | 5 BeF2, 2 BeO | 600 | 55 |
| Seltene Erden (Ce, La, Nd) | Entsprechende Chloride, NaCl | 800–900 | 8–15 |
| Aluminium | Kryolith, Tonerde | 935 | 5,5–7 |
Einzelnachweise
- Volkmar M. Schmidt: Elektrochemische Verfahrenstechnik, ISBN 978-3-527-62362-4
- Scriptum Elektrochemie (PDF; 1,3 MB) der Universität Siegen, Seite 184