Aluminiumnitrid
Aluminiumnitrid, Summenformel AlN, ist eine chemische Verbindung von Aluminium und Stickstoff. Es gehört zur Stoffklasse der Nitride und ist ein III-V-Verbindungshalbleiter mit breiter Bandlücke.[4] Die Bandlücke beträgt bei Raumtemperatur .[5]
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Al3+ _ N3− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aluminiumnitrid | ||||||||||||||||||
| Verhältnisformel | AlN | ||||||||||||||||||
| Kurzbeschreibung |
weißer pulverförmiger Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 40,99 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
3,26 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
bei Kontakt mit Wasser allmähliche Hydrolyse unter Ammoniakbildung[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−318,0 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften

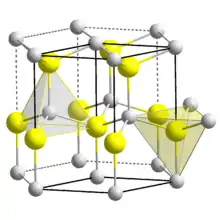
Aluminiumnitrid ist ein weißer, brennbarer, aber schwer entzündbarer pulverförmiger Feststoff mit ammoniakartigem Geruch, der sich in Wasser zersetzt.[1] Er kristallisiert in der Wurtzit-Struktur mit der hexagonalen Raumgruppe P63mc (Raumgruppen-Nr. 186). Die Aluminiumatome bilden eine Dichteste Kugelpackung auf einem hexagonalen Gitter, die N-Atome besetzen die Hälfte der tetraedrischen Lücken dieses Gitters. Die Gitterkonstanten betragen a = 311,14 pm und c = 497,92 pm. Die Röntgendichte von AlN liegt bei 3,26 g/cm³. Aluminium und Stickstoff sind überwiegend kovalent gebunden, der Anteil der ionischen Bindung beträgt 45 %. Die relative Molekülmasse Mr beträgt 40,99 u. Unter Stickstoffatmosphäre besitzt es einen Schmelzpunkt von über 2200 °C und eine Härte nach Mohs von 9. Ab 2400 °C zersetzt sich die Verbindung[1].
Aluminiumnitridkeramik
Aluminiumnitridkeramik wird üblicherweise bei Temperaturen von ca. 1800 °C drucklos gesintert. Mit Hilfe geeigneter Sinteradditive kommt es hierbei zum Flüssigphasensintern. In der Praxis hat sich die Dotierung mit Calcium- und Yttriumoxid als Standardverfahren weitgehend durchgesetzt.
AlN-Keramik besitzt eine sehr hohe Wärmeleitfähigkeit von 180 W/(m·K). Der Einsatz von AlN-Keramik ist somit dort interessant, wo viel Wärme abgeführt werden muss, der Werkstoff jedoch nicht elektrisch leitend sein darf. AlN-Keramik wird vor allem in der Leistungselektronik als Substratwerkstoff verwendet.
In industriellem Maßstab wird Aluminiumnitrid durch physikalische Abscheideverfahren (PVD), Sputtern oder durch metallorganische chemische Gasphasenabscheidung (MOCVD) als Dünnschicht gewonnen.
Synthese
Aluminiumnitridpulver lässt sich aus Aluminiumoxid, Stickstoff bzw. Ammoniak und Kohlenstoff im Überschuss bei einer Temperatur ab 1600 °C in einer carbothermischen Reaktion darstellen:
Ein weiterer Weg ist die Direktnitridierung. Bei dieser Syntheseart wird metallisches Aluminium- bzw. Aluminiumoxidpulver bei Temperaturen ab 900 °C mit N2 oder NH3 zu AlN umgesetzt:
Reaktionsverhalten
Aluminiumnitridpulver weist eine hohe Hydrolyseempfindlichkeit auf. Im Wasser ist eine unvollständige Spaltung von Aluminiumnitrid in Aluminiumhydroxid und Ammoniak zu beobachten. Gesinterte Keramik ist nicht hydrolyseempfindlich. In Natronlauge zersetzt sich Aluminiumnitrid sowohl als Pulver als auch als gesinterte Keramik zu Ammoniak und Aluminatlösung gemäß:
Weblinks
Einzelnachweise
- Eintrag zu Aluminiumnitrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Aluminum nitride bei Sigma-Aldrich, abgerufen am 25. Januar 2020 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-5.
- J. Li, K. B. Nam, M. L. Nakarmi, J. Y. Lin, and H. X. Jiang: Band structure and fundamental optical transitions in wurtzite AlN. In: Applied Physics Letters. Band 83, Nr. 25, 2003, S. 5163–5165, doi:10.1063/1.1633965.
- Martin Feneberg, Robert A. R. Leute, Benjamin Neuschl, Klaus Thonke, and Matthias Bickermann: High-excitation and high-resolution photoluminescence spectra of bulk AlN. In: Physical Review B. Band 82, Nr. 7, 2010, S. 075208, doi:10.1103/PhysRevB.82.075208.

