Calciumaluminatsulfat
Calciumaluminatsulfat ist eine chemische Verbindung aus der Gruppe der Calciumaluminate mit der Verhältnisformel Ca6Al2O6(SO4)3. Sie kommt vor allem als Hydrat vor.
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
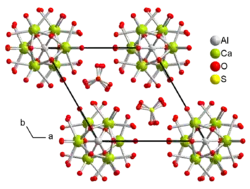 | |||||||||||||
| Kristallstruktur von Calciumaluminiumsulfathydrat in einer Projektion entlang c | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Calciumaluminatsulfat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | Ca6Al2O6(SO4)3 | ||||||||||||
| Kurzbeschreibung |
nicht brennbarer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | |||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Calciumaluminatsulfat-Slurry, auch Casul oder Calciumsulfoaluminat genannt, ist ein Calciumaluminat-Sulfat in suspendierter Form. Die Summenformel der dazu gehörigen festen Verbindung ist Ca6Al2[(OH)12(SO4)3]·24 H2O[4] oder Ca6Al2[(OH)12(SO4)3]·26 H2O.[5] In der Bauchemie wird üblicherweise stattdessen als Schreibweise die oxidische Summenformel verwendet: 3CaO·Al2O3·3CaSO4·32 H2O.
Bei der Verbindung mit 26 Mol Kristallwasser und einer Molmasse von 1255,11 können beim Erhitzen durch die zusätzliche Zersetzung der Hydroxidionen 32 Mol Wasser bzw. 46 Gewichtsprozent abgegeben werden. Die Wasser-Löslichkeit von Calciumaluminatsulfathydrat beträgt etwa 1 g/Liter und ist somit etwa halb so groß wie die Löslichkeit von Calciumsulfat.
Vorkommen
Das kristallwasserhaltige Salz kommt auch als mineralisches Ettringit in der Natur vor, besonders in vulkanischen Lagerstätten, beispielsweise in der Vulkan-Eifel.
Synthetische Herstellung
Bei der Herstellung von Calciumaluminatsulfat-Slurry kommt es darauf an, bei kurzer Reaktionszeit besonders feinteilige Ettringit-Kristalle zu erzeugen, denn nur die sind für die industrielle Anwendung relevant. Natürlich "gewachsenes" Ettringit ist für die industrielle Vermarktung nicht geeignet.
Für die Synthese sind heute zwei Verfahren bekannt:
- Die Fällung aus Aluminiumsulfat-Lösung durch Zugabe von Calciumhydroxid-Lösung (Kalkmilch) zur Herstellung von Satinweiß, die bereits im 19. Jahrhundert in der Papierindustrie praktiziert wurde:
Nach diesem Verfahren entsteht ein feinkristallines, hochweißes Präzipitat, das mit geeigneten Dispergiermitteln wie Polyacrylate oder Casein zu Slurries mit 30 % bis 50 % Feststoff suspendiert wird.[6]
- Die thermodynamische Herstellung aus Calciumaluminathydrat (Katoit) und Gips zur Herstellung von Casul.
Nach diesem patentierten Verfahren[7] kann eine besonders hochkonzentrierte Slurry mit bis zu 70 % Feststoff hergestellt werden. Diese Reaktion spielt auch eine wichtige Rolle bei der Zementverfestigung.[8]
- Unreiner Ettringit entsteht aus sulfathaltigen Abwässern durch Zugabe von Aluminaten und Kalk.[9]
Besondere Eigenschaften

Calciumaluminatsulfat ist ein besonders weißes Produkt. Es entsteht nur bei einem pH-Wert von über 12 und zerfällt bei einem pH-Wert von unter 9 in die Bestandteile Calciumaluminat und Calciumsulfat. Aufgrund seines nadeligen Kristallhabitus neigt es zu einer Verfilzung von Anstrichen, was sich durch einen starken Klebeeffekt zeigt, den man früher als nachteilig empfand, so dass Satinweiß in der Papierindustrie auch "Teufelsweiß" oder "Satansweiß" genannt wurde. Der Klebeeffekt wird heute als eine positive Eigenschaft vor allem in Anstrichmitteln wie Dispersionsfarben und Flüssigputzen genutzt.
Obwohl der Brechungsindex mit nD=1,49 für ein Weißpigment sehr niedrig und die Nassopazität entsprechend schwach ist (ähnlich wie Alabaster), ist die Trockenopazität in Beschichtungen, die Calciumaluminatsulfat enthalten, aufgrund der Reflexion und des dichtebezogenen Lichtabsorptionskoeffizienten (nach Kubelka-Munk), sehr gut. Feinteiliges Calciumaluminatsulfat (mittlere Teilchengröße <0,5 µm) ist deshalb vor allem als glanzgebender Bestandteil von Streichfarben zur Papierbeschichtung geeignet. Die so gestrichenen, und zusätzlich satinierten Papiere zeichnen sich vor allem durch hohe Weiße, Opazität, Glätte und Glanz aus und verleiht dem Papier eine angenehme Haptik. Sie werden als Kunstdruckpapiere mit exzellentem Druckbild und für hochwertige Lebensmittelverpackungs-Papiere eingesetzt.
Wegen des hohen pH-Wertes und geringfügig gelöster Aluminium-Ionen wirkt Calciumaluminiumsulfat antibakteriell, so dass Streich- und Wandfarben auch ohne Konservierungsmittel gegen Bakterien und Schimmel geschützt sind.
Anwendung
- Als Weißmineral zur Herstellung von Anstrichmitteln.
- Als Weißpigment in Streichfarben zur Beschichtung von Papier.
- Als mineralischer Binder in Flüssig-Putzen
Einzelnachweise
- Eintrag zu Hexacalciumhexaoxotris[sulfato(2-)]dialuminat(12-) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Februar 2017. (JavaScript erforderlich)
- Sicherheitsdatenblatt Remondis Lippewerk
- siehe unter Ettringit
- G: RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999 Band 2: Cm - G. Georg Thieme Verlag, 2014, ISBN 3-13-199971-3, S. 1245 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. E. Moore, H. F. W. Taylor: Crystal structure of ettringite. In: Acta Crystallographica, Section B. 26, 1970, S. 386–393. doi:10.1107/S0567740870002443.
- Papierlexikon; Gernsbach 1999; ISBN 3-88640-080-8
- Patent EPA 98 963 436.5; Remondis Lippewerk
- siehe unter Ettringit
- Umwandlung von gelösten Sulfaten aus Prozess- und Abwässern zu Sekundärrohstoffen; WLB 6/1996.