Endozytose
Die Endozytose ist ein zellulärer Vorgang, bei dem durch Einstülpung von Bereichen der Zellmembran aus der Umgebung der Zelle Flüssigkeit und Partikel aufgenommen werden. Weiterhin wird dadurch die Zusammensetzung der Zellmembran reguliert und der Transport von Rezeptoren von der Zellmembran vermittelt. Sie kommt bei allen Eukaryoten vor.[1]
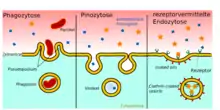
Eigenschaften
Die Endozytose erfolgt bei Eukaryoten über vier Mechanismen,[2] via Clathrin, via Caveolae, via Phagozytose oder via Makropinozytose. Dabei wird auf der Innenseite der Zellmembran ein Vesikel ins Zellinnere abgeschnürt. Die Vesikel verschmelzen anschließend mit Endosomen und Lysosomen im Endomembransystem. Bei Hefen beginnt die Endozytose an bestimmten Bereichen der Zellmembran (an einem der 50 bis 100 Eisosomen auf der Zelloberfläche),[3] welche die Proteine Pil1, Lsp1, Sur7, Eis1, Seg1 und Ygr130C enthalten. Der entgegengerichtete Vorgang der Verschmelzung von Vesikeln mit der Zellmembran wird als Exozytose bezeichnet. Endo- und Exozytose sind Regulationsmechanismen der Homöostase der Zellmembran, d. h. über beide Vorgänge wird die Zusammensetzung und Ausdehnung der Zellmembran gesteuert.[4]
Clathrin
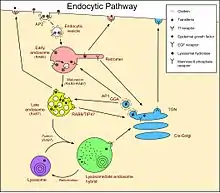
Clathrin befindet sich in den Clathrin-coated pits (clathrinbeschichtete Vertiefungen) der Zellmembran. Dieser Mechanismus ist der hauptsächliche Mechanismus der Endozytose in den meisten Zellen.[5][6] Daran sind über 50 Proteine beteiligt.[7][8]
Caveolae
Caveolae sind Membranbereiche von etwa 50 nm, die nicht auf allen Zellen in einem Organismus vorkommen. Sie kommen verstärkt auf Zellmembranen der glatten Muskulatur, Typ-I-Pneumozyten, Fibroblasten, Adipozyten und Endothelzellen und können bis zu einem Drittel der Zellmembran einnehmen. Sie sind eine Form der Lipid Rafts.[9] Sie enthalten gehäuft Caveoline, Cavine sowie Cholesterin und Sphingolipide.[10][11][12] Vermutlich haben die Caveolae eine zusätzliche Rolle als Sensor für mechanischen Stress.[13][14][15]
Phagozytose
Bei der Phagozytose werden Vesikel von 750 nm Durchmesser abgeschnürt, die Partikel aus der Umgebung enthalten, z. B. Staubpartikel, Zelltrümmer aus Apoptose und Nekrose und Pathogene. Der Transport erfolgt entlang des Aktin-Zytoskeletts.[16] Die Phagozytose lässt sich in vier Phasen einteilen: eine Ruhephase, die Ausbildung einer Vertiefung in der Zellmembran, die Ausbildung von Pseudopodien und der aktive Transport entlang des Aktin-Zytoskeletts einschließlich Reorganisation, und die Wiederherstellung des Aktin-Zytoskeletts.[16] Die Phagozytose wird durch Aktivierung von PAMP-Rezeptoren eingeleitet.[17] Phosphoinositide sind als sekundäre Botenstoffe an der Signalweiterleitung bei der Phagozytose beteiligt.[18] Die Signaltransduktion mündet in den Calcineurin-NFAT-Signalweg.[19] Die Phagozytose ist ein wichtiger Mechanismus der Immunreaktion, z. B. stülpen Makrophagen und andere professionelle antigenpräsentierende Zellen Pathogene ein und verstärken dann eine Immunantwort.[20][21] Pro Tag sterben etwa 200 bis 300 Milliarden Zellen im erwachsenen menschlichen Körper, deren Bruchstücke per Phagozytose und Abbau umgesetzt werden.[22]
Makropinozytose
Bei der Makropinozytose werden gefältelte Membranbereiche eingestülpt, wodurch deutlich größere Vesikel-Durchmesser entstehen (Makropinosomen), die unspezifisch größere Volumina der umgebenden Flüssigkeit aufnehmen.
Literatur
- L. Fan, R. Li, J. Pan, Z. Ding, J. Lin: Endocytosis and its regulation in plants. In: Trends in plant science. Band 20, Nummer 6, Juni 2015, S. 388–397, doi:10.1016/j.tplants.2015.03.014, PMID 25914086.
Einzelnachweise
- Pierre J. Courtoy: Endocytosis. Springer Science & Business Media, 2013, ISBN 978-3-642-84295-5. Vorwort.
- Marsh, Mark: Endocytosis. Oxford University Press, 2001, ISBN 978-0-19-963851-2.
- C. Deng, X. Xiong, A. N. Krutchinsky: Unifying fluorescence microscopy and mass spectrometry for studying protein complexes in cells. In: Molecular & cellular proteomics : MCP. Band 8, Nummer 6, Juni 2009, S. 1413–1423, doi:10.1074/mcp.M800397-MCP200, PMID 19269952, PMC 2690482 (freier Volltext).
- A. Gauthier-Kemper, M. Kahms, J. Klingauf: Restoring synaptic vesicles during compensatory endocytosis. In: Essays in biochemistry. Band 57, 2015, S. 121–134, doi:10.1042/bse0570121, PMID 25658349.
- V. Bitsikas, I. R. Corrêa, B. J. Nichols: Clathrin-independent pathways do not contribute significantly to endocytic flux. In: eLife. Band 3, 2014, S. e03970, doi:10.7554/eLife.03970, PMID 25232658, PMC 4185422 (freier Volltext).
- T. Kirchhausen, D. Owen, S. C. Harrison: Molecular Structure, Function, and Dynamics of Clathrin-Mediated Membrane Traffic. In: Cold Spring Harbor Perspectives in Biology. 6, 2014, S. a016725, doi:10.1101/cshperspect.a016725.
- B. L. Goode, J. A. Eskin, B. Wendland: Actin and endocytosis in budding yeast. In: Genetics. Band 199, Nummer 2, Februar 2015, S. 315–358, doi:10.1534/genetics.112.145540, PMID 25657349, PMC 4317646 (freier Volltext).
- C. J. Merrifield, M. Kaksonen: Endocytic accessory factors and regulation of clathrin-mediated endocytosis. In: Cold Spring Harbor perspectives in biology. Band 6, Nummer 11, November 2014, S. a016733, doi:10.1101/cshperspect.a016733, PMID 25280766.
- U. E. Martinez-Outschoorn, F. Sotgia, M. P. Lisanti: Caveolae and signalling in cancer. In: Nature Reviews Cancer. Band 15, Nummer 4, April 2015, S. 225–237, doi:10.1038/nrc3915, PMID 25801618.
- R. G. Parton, K. Simons: The multiple faces of caveolae. In: Nature reviews. Molecular cell biology. Band 8, Nummer 3, März 2007, S. 185–194, doi:10.1038/nrm2122, PMID 17318224 (Review).
- V. L. Reeves, C. M. Thomas, E. J. Smart: Lipid rafts, caveolae and GPI-linked proteins. In: Advances in Experimental Medicine and Biology. Band 729, 2012, S. 3–13, doi:10.1007/978-1-4614-1222-9_1, PMID 22411310.
- O. Kovtun, V. A. Tillu, N. Ariotti, R. G. Parton, B. M. Collins: Cavin family proteins and the assembly of caveolae. In: Journal of cell science. Band 128, Nummer 7, April 2015, S. 1269–1278, doi:10.1242/jcs.167866, PMID 25829513, PMC 4379724 (freier Volltext).
- P. Nassoy, C. Lamaze: Stressing caveolae new role in cell mechanics. In: Trends in cell biology. Band 22, Nummer 7, Juli 2012, S. 381–389, doi:10.1016/j.tcb.2012.04.007, PMID 22613354.
- R. G. Parton, M. A. del Pozo: Caveolae as plasma membrane sensors, protectors and organizers. In: Nature reviews. Molecular cell biology. Band 14, Nummer 2, Februar 2013, S. 98–112, doi:10.1038/nrm3512, PMID 23340574.
- A. Echarri, M. A. Del Pozo: Caveolae - mechanosensitive membrane invaginations linked to actin filaments. In: Journal of cell science. Band 128, Nummer 15, August 2015, S. 2747–2758, doi:10.1242/jcs.153940, PMID 26159735.
- S. A. Freeman, S. Grinstein: Phagocytosis: receptors, signal integration, and the cytoskeleton. In: Immunological reviews. Band 262, Nummer 1, November 2014, S. 193–215, doi:10.1111/imr.12212, PMID 25319336.
- J. Moretti, J. M. Blander: Insights into phagocytosis-coupled activation of pattern recognition receptors and inflammasomes. In: Current opinion in immunology. Band 26, Februar 2014, S. 100–110, doi:10.1016/j.coi.2013.11.003, PMID 24556406, PMC 3932007 (freier Volltext).
- R. Levin, S. Grinstein, D. Schlam: Phosphoinositides in phagocytosis and macropinocytosis. In: Biochimica et Biophysica Acta. Band 1851, Nummer 6, Juni 2015, S. 805–823, doi:10.1016/j.bbalip.2014.09.005, PMID 25238964.
- J. Fric, T. Zelante, P. Ricciardi-Castagnoli: Phagocytosis of Particulate Antigens - All Roads Lead to Calcineurin/NFAT Signaling Pathway. In: Frontiers in immunology. Band 4, 2014, S. 513, doi:10.3389/fimmu.2013.00513, PMID 24409187, PMC 3885923 (freier Volltext).
- S. Gordon: Phagocytosis: An Immunobiologic Process. In: Immunity. Band 44, Nummer 3, März 2016, S. 463–475, doi:10.1016/j.immuni.2016.02.026, PMID 26982354.
- V. Heinrich: Controlled One-on-One Encounters between Immune Cells and Microbes Reveal Mechanisms of Phagocytosis. In: Biophysical Journal. Band 109, Nummer 3, August 2015, S. 469–476, doi:10.1016/j.bpj.2015.06.042, PMID 26244729, PMC 4572503 (freier Volltext).
- S. Arandjelovic, K. S. Ravichandran: Phagocytosis of apoptotic cells in homeostasis. In: Nature immunology. Band 16, Nummer 9, September 2015, S. 907–917, doi:10.1038/ni.3253, PMID 26287597.