Trimethylaluminium
Trimethylaluminium (TMA oder TMAl) ist eine pyrophore farblose Flüssigkeit und gehört zu den Aluminiumalkylen. TMA besitzt einen Siedepunkt von 127 °C und einen sehr hohen Dampfdruck. An der Luft bildet sie weißen Rauch, entzündet sich spontan und reagiert explosionsartig mit Wasser. Darum muss diese Verbindung unter Argon oder Stickstoff gelagert und gehandhabt werden. Als Reagens wird oft eine Lösung in Toluol, Hexan oder Heptan verwendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
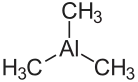 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trimethylaluminium | |||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung |
pyrophore, farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse |
| |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,75 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−136,4 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Chemische Eigenschaften
Das Aluminiumatom ist nur von drei Methylgruppen umgeben, es besitzt nur sechs Valenzelektronen. Um die Oktettregel zu erfüllen und eine Edelgaskonfiguration zu erreichen, bildet sich das Dimer des TMA, in dem die beiden Aluminiumkerne durch zwei Methylgruppen verbrückt sind. Die Struktur ähnelt der des Diboran-Moleküls, wobei die Aluminiumatome den Boratomen und die Methylgruppen den Wasserstoffatomen entsprechen. Wie die Wasserstoffkerne im Diboran bilden die verbrückenden Methylgruppen eine 2-Elektronen-3-Zentren-Bindung, zu der jede Methylgruppe zwei Elektronen zur Verfügung stellt. Obwohl die Kohlenstoffatome der verbrückenden Methylgruppen jeweils von fünf Nachbarn umgeben sind, haben sie nur acht Elektronen in der äußersten Schale. Diese Situation verursacht ein Elektronendefizit, welches TMA äußerst reaktiv macht. TMA ist eine Lewis-Säure und reagiert mit einer Vielzahl von Substanzen. Es tauscht sehr rasch Methylgruppen gegen andere Gruppen oder Atome (beispielsweise Halogene) aus, die mehr Elektronen enthalten. Diese Eigenschaft macht TMA zu einem hervorragenden Methylierungsmittel.
Verwendung
TMA wird für die Herstellung von Methylaluminoxan, einem Cokatalysator für Ziegler-Natta-Polymerisationen, als Aktivator und als Methylierungsmittel verwendet. In der Halbleiterindustrie wird es u. a. im MOVPE-Verfahren zur Herstellung von aluminiumhaltigen Verbindungshalbleitern wie AlGaAs und AlN verwendet.
Aus TMA wird auch das Tebbe-Reagenz hergestellt, das bei der Methylenierung von Estern und Ketonen zum Einsatz kommt. Mit Titantetrachlorid reagiert TMA zum Reetz-Reagenz (nach Manfred T. Reetz), mit dem es gelingt, den α-Kohlenstoff einer Ketogruppe selbst mit sterisch anspruchsvollen Resten zu einem tertiären Kohlenstoff zu alkylieren.[6]
Sicherheitshinweise
TMA ist stark ätzend. Die Verbindung entzündet sich an der Luft spontan und reagiert explosionsartig mit Wasser. Daher muss stets in einer trockenen Schutzgasatmosphäre gearbeitet werden.
Unfall
Am frühen Morgen des 17. Oktober 2016 verunglückte ein mit Trimethylaluminium beladener LKW bei Bornstedt auf der BAB 2. Es kam zu einem Brand und die Autobahn musste stundenlang für Löscharbeiten und Bergung voll gesperrt werden.[7]
Einzelnachweise
- Datenblatt Trimethylaluminum (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- Datenblatt Trimethylaluminum bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- Eintrag zu Trimethylaluminium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag aluminium alkyls im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- Manfred T. Reetz, Wilhelm F. Maier: "tert-Alkylierung von Ketonen und Aldehyden", in: Angew. Chem., 1978, 90, S. 50; doi:10.1002/ange.19780900110.
- Schwerer Unfall auf der A2 in Volksstimme, 17. Oktober 2016, abgerufen am 17. Oktober 2016.

