Korrosion
Korrosion (von lateinisch corrodere ‚zersetzen‘, ‚zerfressen‘, ‚zernagen‘) ist aus technischer Sicht die Reaktion eines Werkstoffs mit seiner Umgebung, die eine messbare Veränderung des Werkstoffs bewirkt. Korrosion kann zu einer Beeinträchtigung der Funktion eines Bauteils oder Systems führen. Eine durch Lebewesen verursachte Korrosion wird als Biokorrosion bezeichnet.

In der Geologie versteht man unter Korrosion die Zersetzung von Gesteinen durch Einwirkung von Wasser und etwa Kohlenstoffdioxid aus der Luft. Solche Verwitterungsprozesse insbesondere unter Mitwirkung von Schwefeldioxid und Frost spielen auch bei Gebäuden eine Rolle. In der Medizin bezeichnet die Korrosion die Zersetzung von Geweben, mit Absicht angewandt um Schauobjekte zu präparieren.
Die Korrosion bei Metallen ist eine von der Oberfläche ausgehende chemische Zerstörung, die auf einer ablaufenden Redoxreaktion unter Bildung von Eisenoxid mit Sauerstoff als Oxidationsmittel beruht. (DIN EN ISO 8044; ehemals DIN 50900). Vor allem die Korrosion von Eisen ist von großer Bedeutung. Sie läuft nur in Gegenwart von Wasser und Sauerstoff ab und wird gefördert durch die Anwesenheit von anderen, edleren Metallen und durch die Anwesenheit von Salzen als Ladungsträgern. Unbeschichtetes Eisen wird durch Korrosion rostig und rau wenn es nass wird und dann Luftsauerstoff dazu kommt und weitere Oxidation bewirkt.[1] Die unedlere Schicht einer Verzinkung von Eisen wird durch Regen langsam aufgelöst bis flächenhaft das Grundmetall freigelegt wird. Mit den edleren Metallen Kupfer, Nickel und Chrom galvanisiertes Eisen wird nach Lochfraß punktweise angegriffen. Die Kupferschicht einer Leiterplatte wird an nichtmaskierten Stellen mit Eisen-III-Chlorid vollständig weggeätzt.
Naturgummi wird von UV-Licht, Sauerstoff und Ölen und Fetten angegriffen, matt (gefüllter Luftballon), hart und brüchig (Gummiring) oder flüssig-klebrig. Auch Polyäthylen wird matt unter UV und Sauerstoff.
Aber auch an sich wenig korrosionsgefährdete anorganische nichtmetallische Werkstoffe wie Glas oder Emaille können gefährdet sein, beispielsweise historische Gläser bestimmter Zusammensetzung, welche aufgrund kombinierter Feuchte- und Luftschadstoffwirkungen durch Glaskorrosion degradieren.
Chemie
In der Chemie bezeichnet Korrosion die chemische Reaktion oder eine elektrochemische Reaktion eines meist metallischen Werkstoffes mit Stoffen aus seiner Umgebung in einem Korrosionselement, wobei eine messbare Veränderung am Werkstoff eintritt, meist eine Änderung der Farbe sowie oft eine negative Veränderung der sonstigen Oberflächeneigenschaften. In bestimmten Fällen kommt es zu einer Massenzunahme am Metall.
Hauptarten der chemischen Korrosion sind dabei:
- Anlaufen von Silber unter Bildung von Silbersulfid
- Bakterielle anaerobe Korrosion
- Glaskorrosion
- Patinabildung bei Kupfer
- Rostbildung bei Eisen bzw. allgemeiner Sauerstoffkorrosion
- Wasserstoffkorrosion (Säurekorrosion)
- Wasserstoffversprödung
Die wichtigste elektrochemische Korrosion ist die Bimetallkorrosion beim Kontakt unterschiedlicher Metalle.
Korrosion (Beispiele)
 Unpoliertes Tafelsilber mit Silbersulfidbelegung
Unpoliertes Tafelsilber mit Silbersulfidbelegung Korrosion von Kupfer
Korrosion von Kupfer Ein stark angerosteter Träger einer genieteten Stahlbrücke
Ein stark angerosteter Träger einer genieteten Stahlbrücke Angerostete Verriegelung eines Containers
Angerostete Verriegelung eines Containers Korrodierter Stahlträger
Korrodierter Stahlträger
Technik
Definition
Der Begriff der Korrosion ist in der DIN EN ISO 8044 (früher DIN 50900) wie folgt definiert: „Korrosion ist die Reaktion eines metallischen Werkstoffs mit seiner Umgebung, die eine messbare Veränderung des Werkstoffs bewirkt (Korrosionserscheinung) und zur Beeinträchtigung der Funktion eines Bauteiles oder eines ganzen Systems (Korrosionsschaden) führen kann. In den meisten Fällen ist diese Reaktion elektrochemischer Natur, in einigen Fällen kann sie jedoch auch chemischer oder metallphysikalischer Natur sein.“
Korrosionsrate
Die Korrosionsrate oder Abtragsrate gibt die Geschwindigkeit der Materialveränderung bzw. des Materialabtrags an. Sie wird in Millimeter je Jahr (mm/a), im angelsächsischen Bereich in mils/year (tausendstel Inch je Jahr) angegeben. Unter standardisierten Bedingungen charakterisiert sie bei metallischen Werkstoffen die Anfälligkeit für Korrosion. Die Korrosionsrate hängt von den Konzentrationen der beteiligten Stoffe (beispielsweise Sauerstoff, Wasser, Chlor), dem pH-Wert, der Temperatur und weiteren Parametern ab. Je nach Bedingungen treten zudem unterschiedliche Formen der Korrosion auf. Die Korrosionsrate ist daher stark vom Standort abhängig[2] und kann im Bereich von zwei Größenordnungen schwanken. Daher sind die folgenden Zahlen nur als grobe Richtwerte zu sehen. Für rostfreie Stähle liegt die Rate bei unter 0,001 mm/Jahr, bei Aluminium im einstelligen Tausendstel Bereich und bei niedrig legierten Stählen im Bereich von mehreren Zehntel Millimetern pro Jahr.[3]
Korrosive Mittel
Sind die Stoffe, die das Bauteil umgeben, auf den Werkstoff einwirken und die Korrosion verursachen, z. B. die Raumluft, Freiluftatmosphäre mit oder ohne Industrieverschmutzung, Meeres-Atmosphäre, Süß- und Salzwasser, Erdboden oder Chemikalien.
Arten der Korrosion
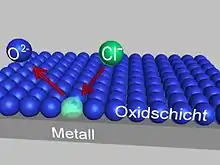

Korrosionsarten werden nach Material, Ursache und Erscheinungsbild unterschieden. Die Norm definiert 37 verschiedene Korrosionsarten.
In der Technik werden neben werkstoffbasierter Korrosion weitere Arten der Korrosion anhand des Ortes ihres Auftretens unterschieden:
- Kontaktkorrosion kann auftreten, wenn zwei Metalle mit unterschiedlichen Potentialen leitend miteinander verbunden werden.
- Lochfraßkorrosion
- Muldenkorrosion
- Flächenkorrosion
- Spannungsrisskorrosion
- Schwingungsrisskorrosion
- Spaltkorrosion
- Interkristalline Korrosion
- Messerlinienkorrosion
- Erosionskorrosion
- Unterwanderungskorrosion
- Streustromkorrosion
Andere Arten der Korrosion:
Korrosionsschutz
Ein passiver Korrosionsschutz verhindert den Kontakt des zu schützenden Materials mit dem Korrosionsmedium durch Abschirmung, während bei einem aktiven Schutz die vollständige Trennung von Material und korrosivem Medium nicht erforderlich ist.
Aktiver Schutz
- Opferanode
- Fremdstromanode
- Thermisches Spritzen
- Feuerverzinken
- Sherardisieren
- Zinklamellenüberzug
- kathodischer Korrosionsschutz
- Polarisation
- Schwachstrom
- Inhibitoren
- Verringerung des Sauerstoffgehaltes
- Förderung der Passivschichtbildung
- Homogenisierung des Gefüges
- Optimierung der Oberfläche
Passiver Schutz

- Feuerverzinken
- Schutzanstrich bzw. Schutzbeschichtung mit entsprechender Vorbehandlung oder unter Verwendung von Haftvermittlern
- Sonstiger organischer Transportschutz: Fette, Wachse, fluoriertes Polyurethan (FPU)
- Anorganischer nichtmetallischer Schutz: Passivierung, Oxide, Glas, insbesondere Borosilikatglas
- Anorganischer metallischer Schutz: Hämatit (Eisenglimmer), Zink, Aluminium
- Konstruktive Maßnahmen: durchgehend schweißen etc.
- Unterschiedliche Metalle nicht in direktem Kontakt verbauen, z. B. keine Chrom- oder Aluminiumzierteile direkt auf Stahl; Kfz-Nummernschilder mit Kunststoffzwischenlage montieren
- An gefährdeten Stellen Wasserabläufe vorsehen (z. B. in Autotüren)
- Hohlraumversiegelung
- Relais mit Schutzgas-Füllung, Reed-Relais
- Elektrolytisches Vergolden, z. B. in der Zahntechnik[4]
- Luftfilterung und Überdruckbelüftung von Gehäusen und Schaltschränken, z. B. durch chemisorptive Filter, zur Elimination korrosiver Gase wie H2S
Hinweis: Durch Feuerverzinken entsteht sowohl ein passiver als auch ein aktiver Korrosionsschutz.
Bauten: Korrosion von Gestein
In der Geologie ist Korrosion die zersetzende chemische Verwitterung von Gesteinen durch verschiedene in Wasser gelöste Agentien (siehe auch → Mischungskorrosion). Auch bei Bauten tritt eine solche Korrosion auf, dort oft Steinfraß genannt. Wie das Wort Verwitterung andeutet, spielt dabei die Witterung oder vielmehr das regionale Klima eine große Rolle. Durch konstruktive Maßnahmen kann Korrosion an steinernen Bauteilen verringert werden, z. B. durch
- Verwendung solider Materialien,
- Tropfkanten,
- überstehende Dachkanten zum Schutz der Fassaden,
- Pflege,
- Vermeidung von Bewuchs,
- Vorbeugung von Hochwasser- und Grundwasserschäden,
- Vermeidung von Baumbepflanzung oberhalb von Abwasserleitungen.
Medizin: Korrosion von Gewebe
In der Medizin versteht man unter „Korrosion“ die Zerstörung von tierischem Gewebe, die durch eine Entzündung oder ätzende Mittel hervorgerufen wird.
Andererseits spielt auch die Korrosion von Metallen in der Implantologie und der Zahnmedizin eine Rolle. Korrosionsprodukte als Verbindungen oder Ionen können bioaktive (z. B. Magnesium oder Calcium) aber auch allergene (z. B. Nickel) oder pathologische Effekte haben. Das vielseitige klinische Erscheinungsbild wird als Metallose bezeichnet und ist in den Anfängen meist symptomlos.[5]
Schaupräparate zum Studium der Anatomie werden mitunter durch Korrosion hergestellt.
Siehe auch
- Korrosionsmedium
- Schwingungsrisskorrosion
- Spannungsrisskorrosion
- Kesternichtest (Korrosionsprüfung mit Schwefeldioxid)
Literatur
- Helmut Kaesche: Die Korrosion der Metalle – Physikalisch-chemische Prinzipien und aktuelle Probleme. Springer-Verlag, Berlin/ Heidelberg/ New York 1979, ISBN 3-540-08881-4.
- Fonds der Chemischen Industrie: Korrosion / Korrosionsschutz. Folienserie und Textheft Nr. 8, Frankfurt am Main 1994.
Weblinks
Einzelnachweise
- Theodore L. Brown, H. Eugene LeMay: Chemie. Ein Lehrbuch für alle Naturwissenschaftler. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26241-5, S. 595 ff.
- Corrosion Rate Website der American Galvanizers Association. Abgerufen am 2. Januar 2016.
- Metals for Corrosion Resistance: Part II – Catherine Houska Website des Nickel Institute. Abgerufen am 2. Januar 2016.
- Klaus Müller: Vier Jahre Erfahrungen mit EF-NE-NEM-Legierungen. In: Zahnärztliche Praxis. 36. Jahr, Heft 4, 12. April 1984, S. 130–132.
- Klaus Müller: Kleines Handbuch der oralen Implantologie. Kap. 16: Zur klinischen Relevanz der Metallose. 1978, ISBN 3-9800176-2-1, S. 137–143.