Eutektikum
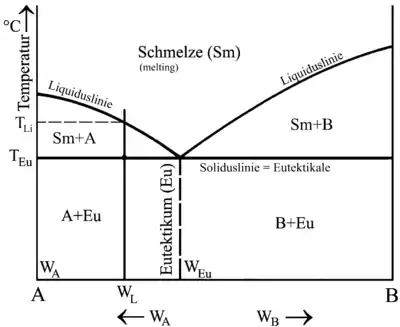
Eutektikum (altgriechisch εὐ eu- gut, τήκω teko schmelzen) ist ein Phasengleichgewicht, das sich dadurch auszeichnet, dass sich die Umgebungsbedingungen (Freiheitsgrade) nur in einem sehr kleinen Bereich frei wählen lassen. Häufigste Darstellung eines Eutektikums ist in einem Phasendiagramm mit nur zwei Freiheitsgraden, nämlich Temperatur und Konzentration der beteiligten Komponenten, siehe Abbildung.

Eine ähnliche Erscheinungsform, bei der allerdings alle beteiligten Phasen bereits im festen Aggregatzustand vorliegen, nennt man Eutektoid.
Eutektische Legierungen
Eigenschaften
Bei eutektischen Legierungen wechseln alle Stoffe gleichzeitig die Phase von fest auf flüssig. Das bedeutet, sie haben einen eindeutig bestimmbaren Schmelzpunkt, den sogenannten eutektischen Punkt, an dem sich Solidus- und Liquiduslinie berühren. Auch die Konzentration ist durch die Konzentration der Stoffe am eutektischen Punkt eindeutig bestimmt. Am eutektischen Punkt sind alle drei Phasen des Systems – Schmelze, Phase A und B – im Gleichgewicht. Die Erstarrungstemperatur ist zudem die niedrigste aller Mischungen aus den gleichen Bestandteilen.[1] Mischungen mit anderen Anteilen der Legierungselemente hingegen haben einen Schmelz- oder Erstarrungsbereich, in dem außer der Schmelze auch eine feste Phase vorliegt.
Die Gibbssche Phasenregel für Feststoffe bei konstantem Druck lautet . Daraus erhält man für eutektische Legierungen mit zwei Komponenten und drei Phasen (Schmelze, Phase A und Phase B) den Wert , das heißt, die vollkommene Erstarrung des Eutektikums ist nur in einem Punkt möglich.
Weil bei Eutektika alle Bestandteile gleichzeitig erstarren und dies bei einer viel niedrigeren Temperatur geschieht, als es bei den reinen Komponenten der Fall wäre, entsteht ein feines und gleichmäßiges Gefüge, das eine in der Regel charakteristische lamellare Struktur aufweist. Ursache dafür ist die bei dieser Temperatur niedrige Bewegungsenergie der Atome, die nur kurze Wege und damit nur die Bildung sehr kleiner Kristalle (auch Kristallite genannt) zulässt.
Verwendung
Ein technisch häufig genutztes Eutektikum ist z. B. der Ledeburit des Fe-C Systems (4,3 % C/1147 °C), das zum Gießen von Grauguss genutzt wird. Auch bei der Herstellung von Aluminium mittels Schmelzflusselektrolyse wird ein eutektisches Gemisch verwendet. Hier wird aus 10,5 % (Massenprozent) Aluminiumoxid (Al2O3, Schmelzpunkt 2058 °C) und 89,5 % Kryolith (Na3[AlF6], Schmelzpunkt ~1000 °C) ein Gemisch mit dem Schmelzpunkt 950 °C hergestellt.[2]
Da der Schmelzpunkt einer eutektischen Legierung deutlich unter dem der reinen Metalle liegt, werden solche Legierungen bevorzugt zum Löten verwendet. Dies hat den Vorteil, dass man relativ wenig Wärme einbringen muss und bei der Wahl des Lotes die Materialverwandtschaft von Lot und Fügepartner nutzen kann. Weiterhin nutzt man den herabgesetzten Schmelzpunkt zum Erstellen von Legierungen, bei denen die Schmelzpunkte der beiden Komponenten weit auseinanderliegen. Dies ist zum Beispiel bei Aluminium (Schmelzpunkt 660 °C) und Wolfram (Schmelzpunkt 3422 °C) der Fall. Versuchte man, eine Aluminium-Wolfram-Legierung direkt herzustellen, indem man beide Bestandteile einfach „in einen Topf wirft“ und erhitzt, so wäre das Aluminium bereits verdampft (Siedepunkt 2467 °C), ehe das Wolfram geschmolzen ist. Fertigt man jedoch erst eine Vorlegierung (mit niedrigerem Schmelzpunkt) aus Wolfram und einem Metall mit einem hohen Schmelzpunkt an, ist die Herstellung möglich. Bedingt durch die Vorbehandlung entstehen so natürlich keine reinen Legierungen.
Bekannte Beispiele für eutektische Legierungen sind
- das als „Lötzinn“ bzw. „Sickerlot“ bekannte System aus Zinn (Sn) und Blei (Pb) mit einer Zusammensetzung von 63 % Sn und 37 % Pb mit einer Schmelztemperatur von 183 °C.
- verschiedene Silberlote, die neben Silber (Ag) und Kupfer (Cu) noch Zink (Zn), Zinn und Cadmium (Cd) enthalten können. So enthält z. B. das Silberlot „L-Ag44“ 44 % Ag, 30 % Cu und 26 % Zn.
- Roses Metall, eine Legierung aus Bismut (Bi), Blei und Zinn mit einem Schmelzpunkt von ca. 94 °C
- Fieldsches Metall ist ein Eutektikum aus Indium (In), Bismut und Zinn und schmilzt bei etwa 62 °C
- Woodsches Metall (auch Wood’sche Legierung) besteht aus einer eutektischen Legierung im System Bismut-Blei-Cadmium-Zinn, die bei etwa 60 °C schmilzt.
- Eine Natrium-Kalium-Legierung ist bei Raumtemperatur flüssig.
Neben ihrer hauptsächlichen Verwendung als Lötmetalle kommen solche gut schmelzenden Legierungen unter anderem noch in Sprinkleranlagen oder in Scherzartikeln zum Einsatz. Ebenso stellen bestimmte Quarzporphyre oder eine Lösung von 30,9 g Kochsalz auf 100 g Wasser (Kryohydrat, Schmelzpunkt −21,3 °C) Eutektika dar.
Einen besonders niedrigen Schmelzpunkt weist die als Galinstan bekannte eutektische Legierung aus 68 bis 69 % Gallium, 21 bis 22 % Indium und 9,5 bis 10,5 % Zinn auf, die erst bei −19,5 °C kristallisiert und in quecksilberfreien, analogen Fieberthermometern verwendet wird.
Im chemischen Labor macht man sich die Bildung niedrigschmelzender Eutektika zunutze, um Kältemischungen herzustellen.
Siehe auch
Literatur
Weblinks
Einzelnachweise
- Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag Leipzig 1965, S. 384.
- Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag Leipzig 1965, S. 52–56.