Kovalente Bindung
Kovalente Bindung (ältere Begriffe: Atombindung, Elektronenpaarbindung oder homöopolare Bindung) ist eine Form der chemischen Bindungen und als solche für den festen Zusammenhalt von Atomen in molekular aufgebauten chemischen Verbindungen ursächlich. Kovalente Bindungen bilden sich besonders zwischen den Atomen von Nichtmetallen aus.[1][2] In Ionenkristallen wirken dagegen vorwiegend ionische und in Metallen metallische Bindungen.
Bei kovalenten Bindungen spielt eine Wechselwirkung der Außenelektronen (Valenzelektronen) mit den Außenelektronen der beteiligten Atome die tragende Rolle. Die Atome bilden zwischen sich mindestens ein Elektronenpaar aus. Dieses Elektronenpaar hält zwei (Zweizentrenbindung) oder mehr (Mehrzentrenbindung) Atome zusammen, ist also bindend und wird daher bindendes Elektronenpaar genannt. Neben einem bindenden Elektronenpaar (Einfachbindung, eine σ-Bindung) können auch zwei (Doppelbindung, σ-Bindung plus eine π-Bindung), drei (Dreifachbindung, plus eine weitere π-Bindung) und sogar mehr Elektronenpaare (δ-Bindung bei Bindungen zwischen Elementen der Nebengruppen) wirken. Eine kovalente Bindung hat eine bestimmte Wirkungsrichtung, ist also eine gerichtete Bindung und bestimmt damit die geometrische Struktur einer Verbindung. Die Festigkeit einer Bindung wird durch die Bindungsenergie beschrieben. Bei der chemischen Reaktion entsprechender Stoffe miteinander findet das Knüpfen oder Trennen einer oder mehrerer kovalenter Bindungen statt.
Grundlagen
Aus Erfahrung ist bekannt, dass sich Moleküle bei chemischen Reaktionen nicht in beliebigen Kombinationen von Atomsorten und Atomanzahlen bilden. Die Elektronenhüllen der Atome gleicher oder verschiedener Elemente müssen sich dazu eignen, miteinander Bindungen zu bilden. Eine genauere Beschreibung der Elektronenhüllen ist jedoch nur mit aufwendigeren mathematischen Methoden möglich (siehe Molekülorbitaltheorie, Valenzstrukturtheorie). Ein wichtiges und starkes Hilfsmittel für das Verständnis von Bindungsverhältnissen ist die weniger komplizierte Edelgasregel. Sie erlaubt die grafische Darstellung von vielen chemischen Verbindungen als Valenzstrichformeln, in denen bindende Elektronenpaare durch Striche zwischen den Elementsymbolen eingezeichnet sind.
Edelgasregel
Nach Lewis und Kossel (1916) sind chemische Verbindungen besonders stabil, wenn die beteiligten Atome die im Periodensystem nächstgelegene Edelgaskonfiguration erreichen (Edelgasregel). Das nächstgelegene Edelgas für Wasserstoff ist Helium mit nur zwei Elektronen. Für Wasserstoff ist die Regel daher mit nur zwei Elektronen erfüllt und liegt dementsprechend als Molekül vor, das durch eine kovalente Bindung (H−H) zusammengehalten wird.
In vielen Fällen erreichen Atome in Verbindungen eine Valenzschale mit vier Elektronenpaaren, haben also ein Elektronenoktett und erfüllen die so genannte Oktettregel. Die Oktettregel gilt für die meisten Verbindungen von Hauptgruppenelementen. Diese Faustregel greift gut für die Elemente der zweiten Periode, wie Kohlenstoff, Stickstoff und Sauerstoff, welche die wichtigen Elemente von zahllosen organischen Verbindungen sind.
- Grenzen der Edelgasregel
- Unter Nichtmetallen findet man Verbindungen, die das Oktett (formal) überschreiten. Dazu zählen Verbindungen von Fluoriden mit Elementen der 5., 6. und 7. Hauptgruppe. Umgekehrt sind es die elektropositiven (elektronenarmen) Übergangsmetalle, die häufig Elektronenmangelbindungen bilden. Typische Beispiele sind die Borwasserstoffe (siehe Diboran, Borane). Die Oktett-Überschreitung und die Oktett-Unterschreitung sind in vielen Fällen durch die Formulierung von Mehrzentrenbindungen erklärbar. Für Komplexe der Übergangsmetalle gilt oft die 18-Elektronen-Regel.
Physik der kovalenten Bindung
Nötig für eine Bindung von zwei Atomen (bzw. zwei Körpern allgemein) in einem festen Abstand ist das Gleichgewicht zwischen einer anziehenden und einer abstoßenden Kraft. Betrachtet man den einfachen Fall des Wasserstoff-Atoms ergibt sich folgendes: Die abstoßende Kraft ist die elektromagnetische Kraft zwischen den positiven Kernen, die immer stärker wird je näher die Kerne zusammenrücken. Die anziehende Kraft wird durch die Austauschwechselwirkung der zwei Elektronen bewirkt: Die Wellenfunktion der Elektronen ergibt im symmetrischen Fall eine Aufenthaltswahrscheinlichkeit der Elektronen zwischen den Kernen. Die Elektronen schirmen also die Kernladungen voneinander ab und sind selbst größtenteils zwischen den Kernen eingeschlossen. Es entsteht ein bindendes Elektronenpaar. Eine ausführliche Beschreibung befindet sich unter Molekülorbitaltheorie#Wasserstoff.
Bindende Elektronenpaare
| Beispiele von Elektronenformeln | |||
| Einfachbindung | |||
| Chlor (Cl2) | |||
| Methan (CH4) | |||
| Doppelbindung | |||
| Kohlenstoffdioxid (CO2) | |||
| Dreifachbindung | |||
| Stickstoff (N2) | |||
| Formalladung | |||
| Kohlenstoffmonoxid (CO) | |||
Durch kovalente Bindungen existieren molekulare Stoffe, wie Sauerstoff (O2) oder Kohlenstoffdioxid (CO2), aber auch Stoffe wie Diamant (CDiamant) oder Siliciumdioxid (SiO2), die keine Moleküle, sondern Atomgitter bilden. Komplexe Ionen, also Moleküle, die elektrische Ladungen tragen, werden durch kovalente Bindungen zusammengehalten. Diese Ionen bilden zwar Salze durch ionische Bindungen, die Atome der komplexen Ionen, wie Ammonium (NH4+) oder Sulfat (SO42−) werden jedoch durch kovalente Bindungen zusammengehalten.
In einer Elektronenformel lassen sich die Valenzelektronen von Nichtmetallatomen bildlich darstellen, wobei Elektronen auf möglichst vier Positionen um das Elementsymbol verteilt werden. Punkte stellen einzelne Elektronen dar, während Striche einsame Elektronenpaare (auch: freies Elektronenpaar, nichtbindendes Elektronenpaar) symbolisieren. Die Elektronenformeln der Atome lassen sich zu Molekülen vieler bekannter chemischer Verbindungen kombinieren und bei bekannter atomarer Zusammensetzung von kleinen Molekülen der molekulare Aufbau einer Verbindung vorhersagen. Um zu einer Valenzstrichformel eines Moleküls zu gelangen, werden einsame Elektronen (Punkte) zu bindenden Elektronenpaaren (Striche) kombiniert oder Elektronenpaare (Striche) zwischen Atomen so verschoben, dass die Oktettregel erfüllt wird. Dabei sind auch Doppelbindungen und Dreifachbindungen zwischen zwei Atomen möglich (siehe auch: Lewisschreibweise).
Die formale Zuordnung von bindenden und nichtbindenden Elektronenpaaren zur Darstellung einer chemischen Verbindung führt gelegentlich zu einer so genannten Formalladung. Sie ist die Differenz zwischen der positiven Kernladung und dem Atom zugeteilten negativen Elektronen und wird oft als hochgestelltes Plus- bzw. Minuszeichen in einem Kreissymbol angegeben. Formalladungen liegen zum Beispiel bei Kohlenstoffmonoxid vor.
Die Koordinationszahl eines Atoms gibt die Zahl der nächsten Nachbaratome an und ist zum Beispiel bezüglich des C-Atoms in Kohlenmonoxid 1, bei Kohlenstoffdioxid 2 und bei Methan 4.
Polarität von kovalenten Bindungen
Die elektronenanziehenden Kräfte (Elektronegativität, En) sind ein Maß für die Fähigkeit eines Atoms in einer chemischen Bindung die Bindungselektronen an sich zu ziehen. Die Elektronegativität von Bindungspartnern ist nur bei Elementmolekülen exakt gleich und nur hier liegen ideale kovalente Bindungen vor. Streng genommen können nur diese Bindungen unpolar oder auch homöopolar genannt werden.
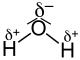
Unterscheiden sich die Bindungspartner in ihrer Elektronegativität, liegen dagegen polare oder auch heteropolar genannte kovalente Bindungen vor. Die bindenden Elektronen sind mehr oder weniger ungleichmäßig zwischen den Bindungspartnern verteilt. Ihr Schwerpunkt ist in Richtung des elektronegativeren Partners verschoben. Das Atom mit der größeren Elektronegativität zieht die Bindungselektronen näher zu sich heran. Dadurch erhält dieser Bindungspartner eine negative Partialladung, die durch δ− symbolisiert wird. Die Elektronenhülle des Atoms am anderen Ende der Bindung verarmt entsprechend an negativer Ladungsdichte und das Atom erhält eine positive Partialladung (δ+). Man nennt solche kovalenten Bindungen polare Bindungen, da Pole mit unterschiedlichen Teilladungen entstehen.
Bei sehr polaren kovalenten Bindungen können Bindungselektronen weitgehend einem Bindungspartner zugeordnet werden. Es liegt der Grenzfall zu ionischen Bindungen vor und in manchen Fällen ist es sinnvoll, die Verbindung als ionisch zu beschreiben.
| Fluorwasserstoff (HF) | Kohlenstoffdioxid (CO2) | Wasser (H2O) |
 | ||
Dipolmoment
Polare Bindungen können dazu führen, dass das gesamte Molekül polar ist: das Molekül trägt dann ein Dipolmoment und liegt als Dipol-Molekül vor. Ob ein Molekül ein (messbares) Dipolmoment besitzt, hängt aber nicht nur von der Polarität der Bindungen, sondern auch vom Molekülbau ab. Die Dipolmomente verschiedener Bindungen im Molekül addieren sich richtungsabhängig (vektoriell) und können sich daher gegenseitig aufheben. Fluorwasserstoff trägt als zweiatomige, heteronucleare Verbindung ein Dipolmoment. Kohlenstoffdioxid hat ein Gesamtdipolmoment von Null, da die Bindungsdipole entgegengesetzt ausgerichtet sind und sich aufheben. Wasser hat ein größeres Gesamtdipolmoment als Fluorwasserstoff, obwohl die Polarität der O–H-Bindung kleiner als die der H–F-Bindung ist. Die Ursache liegt in der Addition der zwei O–H-Bindungsdipole, die in einem Bindungswinkel von etwa 105° (siehe unten) zueinander stehen.
Bindende Elektronenpaare aus einsamen Elektronenpaaren
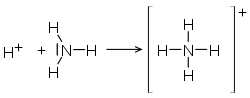
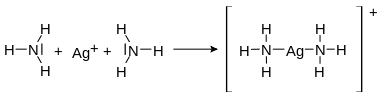
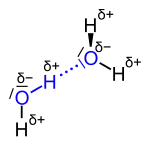
Einsame Elektronenpaare einer Verbindung können in einer Reaktion die Rolle von bindenden Elektronenpaaren übernehmen. Diese Art der Bindungen wird koordinative Bindung (auch: dative kovalente Bindung) genannt und tritt in Verbindungen wie dem Ammonium-Kation und in Komplexverbindungen auf. Koordinative Bindungen haben eine Ähnlichkeit mit den schwachen Bindungen, die zum Beispiel bei der Wasserstoffbrückenbindung auftreten.
- Beispiele
| Koordinative Bindung im Ammonium-Kation |
Koordinative Bindung im Diammin-Silber-I-Komplex |
Wasserstoffbrückenbindungen zwischen zwei Wassermolekülen |
 |
 |
 |
Geometrie
Räumliche Ausrichtung
Drei miteinander verbundene Atome in einem Atomgitter, Molekül oder Komplex stehen in einem bestimmten Bindungswinkel zueinander. Die Kenntnis über Bindungswinkel erlaubt die Aufstellung der Strukturformel einer Verbindung. Aus Kenntnis über bindende und nichtbindende Elektronenpaare in einer Verbindung lassen sich Bindungswinkel mit Hilfe des Elektronenpaarabstoßungsmodells abschätzen. Die Bindungswinkel ergeben sich aus einer Anordnung der Elektronenwolken in einem möglichst großen Abstand zueinander. Eine Elektronenwolke kann aus einem einzelnen Elektron (bei Radikalen), einem nichtbindenden Elektronenpaar oder Einfachbindungen bestehen. Für eine einfache Schätzung können Zweifach- und Dreifachbindungen gedanklich als eine einzige Wolke aufgefasst werden.
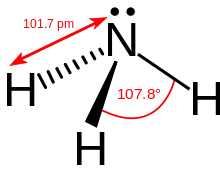
| Beispiele | Blausäure (HCN) | Kohlensäure (H2CO3) | Wasser (H2O) | Ammoniak (NH3) | Methan (CH4) |
|---|---|---|---|---|---|
| Abbildung | 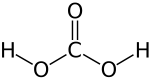 |
 |
 |
 | |
| Anzahl der Kugelwolken | 2 | 3 | 4 | 4 | 4 |
| Abschätzung | linear (180°) | trigonal planar (120°) | tetraedrisch (109,47°) | tetraedrisch (109,47°) | tetraedrisch (109,47°) |
| tatsächlicher Bindungswinkel | 180° | etwa 120° | 104,5° | 107,8° | 109,47° |
Zwischen einer Abschätzung eines Bindungswinkel mit Hilfe des Elektronenwolkenmodells und realen Molekülen können recht kräftige Abweichungen auftreten. Der tatsächliche Bindungswinkel im Wassermolekül beträgt nicht 109,47°, sondern 104,45° auf Grund der geringeren abstoßenden Wirkung der nichtbindenden Elektronenpaare auf die bindenden Paare, bzw. der geringeren Größe der s-q-Bindungs-Orbitale, die das Proton enthalten.
Bindungslänge
| H–H | H–F | H–Cl | H–Br | H–I |
| 74 pm | 92 pm | 128 pm | 141 pm | 160 pm |
| C–C | C=C | C≡C | N–N | N=N | N≡N | |
| 154 pm | 139 pm | 134 pm | 120 pm | 146 pm | 125 pm | 110 pm |
Die Atomabstände in Molekülen und Komplexen mit kovalenter Bindung können experimentell durch Analyse der Rotationsspektren ermittelt werden. Die Bindungslängen hängen von der Größe der Atome ab. Je größer ihr Radius, desto größer ist ihr Abstand.
Bei Bindungen zwischen gleichartigen Atomen ist ihr Abstand auch von der Zahl der bindenden Elektronenpaare abhängig: Je mehr bindende Elektronenpaare wirken, desto kürzer ist die Bindungslänge. Die Form des Bindungpotenzials kann durch das Morse-Potenzial beschrieben werden.
Geometrie von Mehrfachbindungen
| Geometrie |
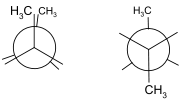 ekliptisch & gestaffelt Butan |
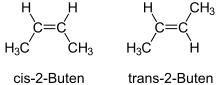 2-Buten |
Einfachbindungen bestimmen zwar die Bindungswinkel zwischen Atomen, sind jedoch in sich selbst drehbar. Ein Molekül wie Butan kann leicht in sich drehen und liegt daher in verschiedenen Konformationen vor. Alle Konformationen beschreiben die gleiche Verbindung. Mehrfachbindungen lassen sich hingegen nicht in sich drehen. Bedeutung haben hier die Doppelbindung besonders in organische Verbindungen. Kohlenwasserstoffe wie 2-Buten existieren als zwei unterschiedliche chemische Verbindungen, nämlich cis- und trans-2-Buten. Die Starrheit der Doppelbindungen führt allgemein zu der so genannten cis-trans-Isomerie. Weitere Verzerrungen von Mehrfachbindungen lassen sich durch das Carter-Goddard-Malrieu-Trinquier-Modell beschreiben.
Konjugierte Doppelbindungen und aromatische Bindungen
Treten in einem Molekül abwechselnd Doppel- und Einfachbindungen auf, sind die Atomabstände der Einfachbindung kürzer (fester) als bei Einfachbindungen ohne Doppelbindungen in der Nachbarschaft. Auf die Mehrfachbindungen hingegen wirkt sich dies verlängernd aus. Dieses Phänomen wird Konjugation genannt und lässt sich mit den hier beschriebenen, einfachen Bindungsmodellen kaum erklären.
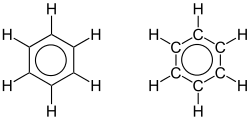
Ein besonderer Fall liegt bei der Aromatizität vor: Hier liegen nur formal Abfolgen von Doppel- und Einfachbindungen vor, die Atomabstände sind jedoch alle gleich kurz. Eine einfache aromatische Verbindung ist das ringförmige Molekül Benzol (C6H6). Valenzstrichformeln dieser Verbindung führen zu zwei möglichen Darstellungen, die in der Abbildung als mesomere Grenzstrukturen bezeichnet werden. Beide Valenzstrichformeln führen zu der richtigen Vermutung, das Benzol ein ebenes (planares) Molekül ist, da die Geometrie trigonal planare Ausrichtungen fordert. Jede C-C-Bindung kann als Doppel- oder Einfachbindung dargestellt werden. In Realität liegen die Doppelbindungen an keinen festen Orten vor, sondern sind über den ganzen Ring verteilt (delokalisiert). Alle aromatischen Verbindungen, also Verbindungen mit delokalisierten Doppelbindungen, müssen die so genannte Hückel-Regel erfüllen, die quantenmechanisch begründet ist.
| Benzol (C6H6) | ||
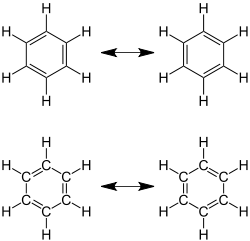 |
 |
.png.webp) |
| Benzol mit sechs Elektronen (genauer sechs π-Elektronen) in delokalisierten Doppelbindungen, einer der einfachsten aromatischen Verbindungen, hier durch mesomere Grenzstrukturen dargestellt. (Hinweis: Die Präsentationen oben und unten sind gleichwertig.) | Die delokalisierten Elektronen und die Gleichheit der Bindungen wird in beiden Zeichnungen des Benzolmoleküls durch den Ring dargestellt. (Die rechts wiedergegebene Präsentation findet man bisweilen in Schulbüchern.) | Historische Kekulé-Benzol-Formel aus der Originalpublikation.[3] |
| Struktur von Amiden |
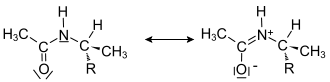 |
Das Erstellen von mesomeren Grenzstrukturen mit den hier beschriebenen, einfachen Bindungsmodellen erlaubt auch Abschätzungen von recht komplizierten Bindungsverhältnissen. Die Abbildung rechts zeigt die Peptidbindung in zwei Grenzstrukturen. Aus der Grenzstruktur 1 lässt einen C-N-C-Bindungswinkel von 109° vermuten (tetraedrisch), während Grenzstruktur 2 auf einen Winkel von 120° hindeutet (trigonal planar). In Realität liegt ein Bindungswinkel von 122° vor, wie er sich eher aus Grenzstruktur 2 mit Formalladungen ergibt. Der C-N-Abstand der möglichen Doppelbindung liegt mit 133 pm zwischen einer C–N-Einfachbindung (147 pm) und einer C=N-Doppelbindung (130 pm).
Bindungsenergie
| Bindungsdissoziationsenthalpie | ||
| Bindung | Bindungslänge in pm | Bindungsenthalpie in kJ/mol |
| H–H | 74 | 436 |
| F–F | 142 | 159 |
| Cl–Cl | 199 | 242 |
| Br–Br | 228 | 193 |
| I–I | 267 | 151 |
| C–H | 108 | 413 |
| C–F | 138 | 489 |
| C–Cl | 177 | 339 |
| C–Br | 228 | 285 |
| C–C | 154 | 348 |
| C=C | 134 | 614 |
| C≡C | 120 | 839 |
Die Bindungsenergie (auch: Dissoziationsenergie, Bindungsspaltungsenergie, Bindungsenthalpie, Bindungsdissoziationsenthalpie oder Valenzenergie) ist gleich der Energie, die zu einer Spaltung einer kovalenten Bindung erforderlich ist und eine Verbindung (A−B) in zwei Radikale überführt:
- A−B → A· + ·B
Diese Dissoziation wird homolytische Spaltung genannt. Die Bindungsdissoziationsenthalpie lässt sich bei einfachen Molekülen messen und bei komplizierteren Molekülen durch Messungen und Berechnungen abschätzen. Sie hängt – wie die Bindungslänge (siehe oben) – von der Größe der gebundenen Atome ab. Je größer der Radius der Bindungspartner, desto größer ist ihr Abstand und desto kleiner ist ihre Bindungsenergie. Auch bei Bindungen zwischen gleichartigen Atomen lässt sich erkennen, dass ihr Abstand mit steigender Zahl von bindenden Elektronenpaaren geringer wird, ihre Bindungsenergie hingegen steigt.
Weblinks
Einzelnachweise
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 226–229.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 662–668.
- August Kekulé: Ueber einige Condensationsproducte des Aldehyds, Liebigs Ann. Chem. 1872, 162 (1), S. 77–124; doi:10.1002/jlac.18721620110.