Zinkfingerprotein
Zinkfingerproteine sind eine Klasse von nucleinsäurebindenden Proteinen, die eine bestimmte Proteindomäne besitzen: die Zinkfingerdomäne, bei der ein Zinkion (Zn2+) koordinativ gebunden ist. Die Polypeptidkette nimmt durch den Einbau des Zinkatoms eine schleifenförmige Struktur – den sogenannten Zinkfinger – ein, welche spezifisch mit der DNA oder auch RNA interagieren kann.[1] Entdeckt wurden sie von Aaron Klug im Transkriptionsfaktor IIIA aus der Krallenfroschart Xenopus laevis.
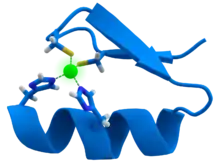
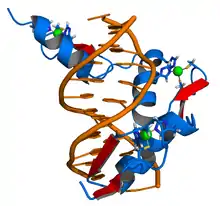
Aufbau
Zinkfingerproteine haben mindestens eine Zinkfingerdomäne, die sich um ein zentrales Zinkion faltet (siehe Abbildung). Hierbei bildet das Zinkion durch seine gefüllte d-Orbitalschale starke Wechselwirkungen mit den Schwefel-, Stickstoff- oder Sauerstoffatomen der Aminosäurereste (meist Cystein und Histidin). Hierbei kommt es zu einer tetraedrisch aufgebauten koordinativen Bindung. Das Zinkion ist auch dafür verantwortlich, dass auch relativ kleine Abschnitte einer Polypeptidbindung so stabilisiert werden, dass sie mit Nucleinsäuren interagieren können.[2] Da Zink nur eine stabile Oxidationsstufe hat, kann es innerhalb der Zelle ebenfalls keine unerwünschten Reaktionen katalysieren. Die Zinkfinger-Domäne ist eine hauptsächlich an DNA bindende Domäne, daher sind Zinkfingerproteine meist Transkriptionsfaktoren. Auch RNA-bindende Zinkfingerproteine sind bekannt. Zu den Zinkfingerproteinen zählen aber auch Rezeptoren für Steroidhormone.
Bei der Rolle als Transkriptionsfaktor bindet die Schleife des Proteins, das im Inneren jeweils zwei Cystein- und zwei Histidinreste um das zentrale Zn2+-Ion enthält (Cys2His2-Zinkfingerprotein), an eine bestimmte Base in der großen Furche der DNA-Doppelhelix. Zinkfingerproteine können auch aus vier beziehungsweise sechs zinkbindenden Cystein-Resten aufgebaut sein (Cys4- bzw. Cys6-Zinkfingerproteine).
Die Zinkfingerdomäne besteht immer aus einer Consensus-Sequenz, die je nach Art der Zinkfingerdomäne variieren kann.
ZAP
Ein spezielles Zinkfingerprotein ist ZAP (englisch zinc finger antiviral protein). Es dient in Säugetieren dazu, Viren abzuwehren.[3][4]
Potenzielle Anwendung
Die Fähigkeit von Zinkfingerproteinen spezifisch an nahezu jede DNA-Sequenz binden zu können, macht speziell aufgebaute (designed) Zinkfingerproteine zu potenziellen Gentherapeutika für die Behandlung verschiedener genetisch bedingter Krankheiten.[5][6][7] Es können mit Zinkfingerdomänen auch künstliche Restriktionsenzyme, die Zinkfingernukleasen hergestellt werden.
Einzelnachweise
- G. Thiel, M. Lietz: Regulator neuronaler Gene: Zinkfingerprotein REST. In: Biologie in unserer Zeit. 34 (2004), S. 96–101. doi:10.1002/biuz.200410244
- D. Voet, J. Voet, C. Pratt: Lehrbuch der Biochemie. 2. Auflage. Wiley-VCH, Weinheim 2010, ISBN 978-3-527-32667-9, S. 177.
- Xuhua Xia: Extreme genomic CpG deficiency in SARS-CoV-2 and evasion of host antiviral defense, in: Molecular Biologa and Evolution, Academic Press, 14. April 2020, doi:10.1093/molbev/msaa094
- Evidence of Stray Dogs as Possible Origin of COVID-19 Pandemic, auf: SciTechDaily vom 14. April 2020, Quelle: University of Ottawa
- M. Papwoth et al.: Designer zinc-finger proteins and their applications. In: Gene. 366 (2006), S. 27–38. PMID 16298089
- J. S. Kang, J. S. Kim: Zinc finger proteins as designer transcription factors. In: J. Biol. Chem. 275 (2000), S. 8742–8748. PMID 10722717.
- W.M. Gomanns et al.: Engineering zinc finger protein transcription factors: the therapeutic relevance of switching endogenous gene expression on or off at command. In: J. Mol. Biol. 354 (2005), S. 507–519. PMID 16253273
Literatur
- K. G. R. Quinlan et al.: Amplification of zinc finger gene 217 (ZNF217) and cancer: When good fingers go bad. In: Biochimica et Biophysica Acta. 1775 (2007), S. 333–340.
Weblinks
- Zinc finger consortium zur Nutzbarmachung von Zinkfingerdomänen für gentechnische Anwendungen