Löslichkeit
Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff in einem Lösungsmittel gelöst werden kann. Sie bezeichnet die Eigenschaft des Stoffes, sich unter homogener Verteilung (als Atome, Moleküle oder Ionen) im Lösungsmittel zu vermischen, d. h. zu lösen. Zumeist ist das Lösungsmittel eine Flüssigkeit. Es gibt aber auch feste Lösungen, wie etwa bei Legierungen, Gläsern, keramischen Werkstoffen und dotierten Halbleitern. Bei der Lösung von Gasen in Flüssigkeiten bezeichnet der Begriff Löslichkeit einen Koeffizienten, der die in der Flüssigkeit gelöste Gasmenge bei einem bestimmten Druck des Gases angibt, wenn sich das Gas zwischen Gasraum und Flüssigkeit im Diffusionsgleichgewicht befindet, d. h. genau so viel hinein wie heraus diffundiert. Die Löslichkeit ist außerdem von der Temperatur, vom Druck (in geringem Umfang auch bei nicht gasförmigen Verbindungen) und bei einigen Verbindungen vom pH-Wert[1] abhängig.[2][3][4]
Unterschiedliche Definitionen
Nach dem europäischen Arzneibuch versteht man unter Löslichkeit das bei Sättigung vorliegende Verhältnis von gelöster Substanzmasse zum Volumen des Lösungsmittels bei Raumtemperatur.[5] Diese Definition unterscheidet sich von der Definition der Massenkonzentration, welche (trotz gleicher Einheit von g/l) das Verhältnis von Substanzmasse zu Volumen der Lösung angibt. Die Massenkonzentration wird zum Beispiel von der IUPAC als eine mögliche quantitative Angabe für die Löslichkeit definiert (analytische Zusammensetzung einer gesättigten Lösung, ausgedrückt in Form des Anteils eines gelösten Stoffes in einem bestimmten Lösungsmittel).[6]
Das bekannte CRC Handbook of Chemistry and Physics gibt die Löslichkeit als Substanzmasse der Verbindung (mit Ausnahme des Kristallwassers von Hydraten), die sich in 100 g Wasser lösen lassen an.[7]
Im Allgemeinen unterscheidet man:
- qualitative Löslichkeit: Ist der Stoff in einem bestimmten Lösungsmittel überhaupt in erkennbarem Maße löslich?
- quantitative Löslichkeit: Sie gibt die genaue Stoffmenge an, die sich maximal im Einheitsvolumen eines bestimmten Lösungsmittels löst.
Qualitative Löslichkeit
Bei Temperaturen über dem absoluten Nullpunkt gibt es aus thermodynamischen Gründen (Entropie) für jeden Stoff in jedem anderen Stoff eine gewisse Löslichkeit, wie es im Artikel Reinstoff beschrieben wird. Die zunehmende Genauigkeit der Analysemethoden bestätigt das. Eine Unterscheidung zwischen „löslich“ und „unlöslich“ ist von den gewählten Grenzbedingungen abhängig. Es handelt sich also um relative Feststellungen wie schwer löslich, begrenzt löslich oder unbegrenzt löslich ein Stoff in einem anderen ist.
Eine übliche Einteilung der Löslichkeiten ist über die Menge an maximal gelöstem Stoff gegeben. Unter 0,1 mol/l gelöstem Stoff bezeichnet man als schwerlöslich, zwischen 0,1 und 1 mol/l als mäßig löslich und Löslichkeiten größer als 1 mol/l gelten als leicht löslich.[8]
In welchen Flüssigkeiten ein Feststoff gut löslich ist, hängt von den molekularen Eigenschaften des Stoffes und der Flüssigkeit ab. So sind salzartige Stoffe (Ionen-Verbindungen) fast nur in polaren Lösungsmitteln wie Wasser oder beispielsweise Fluorwasserstoff (HF) löslich. Viele lipophile („fettliebende“) Stoffe sind dagegen nur in organischen Lösungsmitteln wie Benzin [einem unpolaren („apolaren“) Lösungsmittel] nennenswert löslich. „Polar“ bedeutet in diesem Zusammenhang, dass die Moleküle des Lösungsmittels ein Dipolmoment aufweisen und deshalb mit geladenen (Ionen) oder ihrerseits polaren Molekülen der zu lösenden Substanz in Wechselwirkung treten, jedoch ohne dass es zu einer Reaktion kommt. Einige Substanzen, zum Beispiel Ethanol oder Aceton, sind sowohl mit Wasser als auch mit unpolaren Lösungsmitteln in jedem Mengenverhältnis mischbar.
Die Polarität von Lösungsmitteln ist skalierbar: die eluoptrope Reihe.
Unterschiedliche Polaritäten und damit unterschiedliche Löslichkeiten werden in den chromatografischen Verfahren zum Trennen von Substanzen genutzt.
Siehe auch: Eigenschaften des Wassers#Wasser als Lösungsmittel
Quantitative Löslichkeit
Löslichkeit und Löslichkeitsprodukt
Die Löslichkeit eines Stoffes in einem Lösungsmittel muss nicht begrenzt sein. So ist Schwefelsäure mit Wasser in beliebigen Verhältnissen mischbar.
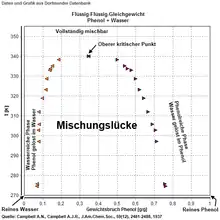
Bei der Mischung von Phenol mit Wasser gibt es bei Raumtemperatur zwei Bereiche, eine Lösung von bis zu 8 % Phenol in Wasser und eine Lösung von bis zu 25 % Wasser in Phenol. Dazwischen bleibt ein Bereich „verbotener“ Mischungsverhältnisse. Werden Phenol und Wasser in diesen Verhältnissen zusammengemischt, führt dies zur Ausbildung von zwei flüssigen Phasen. Der Bereich der nicht möglichen Mischungsverhältnisse wird als Mischungslücke bezeichnet. Oberhalb einer bestimmten Temperatur, der oberen kritischen Temperatur der Lösung, im Fall von Phenol und Wasser bei ca. 340 K (67 °C), ist das Gemisch jedoch vollständig in jedem Verhältnis mischbar.
Die quantitative Löslichkeit oder Löslichkeitsgrenze gibt bei begrenzt löslichen Systemen die maximale Konzentration des einen Stoffes in dem anderen an, bei der das Gemisch unter Gleichgewichtsbedingungen noch einphasig ist. Die Löslichkeitsgrenze ist temperaturabhängig. Wird die Löslichkeitsgrenze überschritten, so scheidet sich eine zweite Phase aus. Fehlt die nötige Aktivierungsenergie oder Diffusion für das Ausscheiden der zweiten Phase, so bleibt das Gemisch auch oberhalb der Löslichkeitsgrenze einphasig in einem metastabilen, übersättigten Zustand.
Bei Salzen folgt die Löslichkeit aus dem Löslichkeitsprodukt unter der Bedingung, dass sich das Salz in und Ionen teilt.
Liegt keines der beteiligten Ionen zusätzlich aus einer Mischung vor, kann die Löslichkeit des betreffenden Salzes berechnet werden. Die Löslichkeit des Salzes ist:
In gemischten Lösungen, wie im natürlichen Wasser mit einer Vielzahl von Ionen, stimmen die Konzentrationen von Anionen und Kationen nicht stöchiometrisch paarweise überein (wie es der Lösung einzelner Salze entspräche). Ein Beispiel hierfür ist der gelöste Kalk, der durch gelöstes Kohlenstoffdioxid als Calciumhydrogencarbonat in Lösung geht und den wesentlichen Beitrag zur Wasserhärte bildet. Über das Dissoziationsgleichgewicht der Kohlensäure verschiebt sich mit dem wechselnden Kohlenstoffdioxidgehalt des Wassers (durch Atmung und Photosynthese der Wasserorganismen) auch die Konzentrationen der Carbonat- und Hydrogencarbonat-Anionen, die Konzentration der Calcium-Kationen bleibt unberührt. In diesem Fall entscheidet das Produkt aus den nicht äquivalenten Konzentrationen an Calcium- und Carbonat-Ionen darüber, ob und in welchem Umfang es wegen einer Überschreitung des Löslichkeitsproduktes zu einer Ausfällung von Calciumcarbonat (als Kesselstein oder Seekreide) kommt.
Die quantitative Löslichkeit wird, wie allgemein die Konzentration von Lösungen, in verschiedenen Einheiten angegeben (auch ergänzt um die Temperatur):
- g/l Lösung (Massenkonzentration), ggf. auch mg/l
- g/g Lösung (Massenanteil, „Massenprozent“ bei Bezug auf 100 g)
- l/l Lösung (Volumenkonzentration, Vol.-% bei Bezug auf 100 l), ggf. auch ml/l
- mol/l Lösung (Stoffmengenkonzentration)
- val/l Lösung (Normalität, veraltet)
- mol/kg Lösemittel (Molalität)
Bestimmung durch Leitfähigkeitsmessungen
Für in Wasser sehr schwer lösliche Salze (z. B. BaSO4, PbS, HgS, AgCl) kann das Löslichkeitsprodukt aus Leitfähigkeitsmessungen mit empfindlichen Konduktometern ermittelt werden. Zur Berechnung wird ferner die Grenzleitfähigkeit des Salzes bei unendlicher Verdünnung benötigt.
Friedrich Kohlrausch und Arnold F. Holleman entwickelten diese Bestimmungsmethode.[9][10][11]
Temperaturabhängigkeit
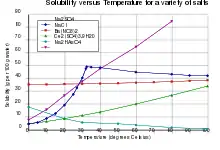
Die Löslichkeit eines Stoffes in einem anderen hängt in erster Näherung von der Lösungsenthalpie ab: Ist die Lösungsreaktion endotherm (positive Lösungsenthalpie), so steigt die Löslichkeit beim Erhitzen. Bei einer exothermen Lösungsreaktion sinkt die Löslichkeit beim Erhitzen. Ist die Lösungsenthalpie annähernd null, wie etwa bei Kochsalz, so ändert sich die Löslichkeit beim Erhitzen kaum.[12]
Wie hoch die Löslichkeit ist, hängt jedoch nicht nur von der Lösungsenthalpie, sondern auch von der Lösungsentropie ab. Eine negative Lösungsenthalpie trägt damit zwar zu einer guten Löslichkeit bei, dennoch kann ein Salz schwer löslich sein, falls die Lösungsentropie gleichfalls negativ ist.[13]
Beispiel für die Berechnung der Konzentration der gesättigten Lösung eines Salzes
Berechnung der Konzentration c für eine gesättigte Lösung von Aluminiumsulfat in Wasser, bei bekanntem KL
Das heißt: aus jedem Mol Aluminiumsulfat entstehen in der Lösung 2 Mol Aluminium- und 3 Mol Sulfationen. Weiterhin gelten folgende Zusammenhänge:
Die Faktoren vor c, wie die Exponenten in der vorhergehenden Gleichung, sind die stöchiometrischen Faktoren. In die Gleichung für KL eingesetzt, ergibt sich:
womit:
Die Zahlenwerte für die Löslichkeitsprodukte erhält man aus den freien Standard-Enthalpien.
Verbale Einstufung nach Europäischem Arzneibuch
Das Europäische Arzneibuch definiert die folgenden Begriffe, bei 15 °C bis 25 °C:[14]
| Bezeichnung | V(Lösungsmittel) in ml je g Substanz | g·l−1 Lösungsmittel |
|---|---|---|
| sehr leicht löslich | < 1 | >1000 |
| leicht löslich | 1 bis 10 | 100 bis 1000 |
| löslich | 10 bis 30 | 33 bis 100 |
| wenig löslich | 30 bis 100 | 10 bis 33 |
| schwer löslich | 100 bis 1000 | 1 bis 10 |
| sehr schwer löslich | 1000 bis 10000 | 0,1 bis 1 |
| praktisch (nahezu) unlöslich | > 10000 | < 0,1 |
Lösung von Gasen in Flüssigkeiten
An der Grenzfläche zwischen Gasen und Flüssigkeiten kommt es durch Diffusion zum Austausch von Gasmolekülen zwischen der Lösung und dem Gasraum. Dabei ist der Eintritt von Molekülen in die Lösung proportional dem Partialdruck des Gases, und der Austritt ist proportional der Konzentration des Gases in der Lösung (siehe Henry-Gesetz). Bei der sogenannten Sättigungskonzentration herrscht ein dynamisches Gleichgewicht zwischen beiden Diffusionsrichtungen. Die Sättigungskonzentration ist proportional zum Partialdruck im Gasraum. Die verbindende Proportionalitätskonstante wird hier als Löslichkeit, präziser als Löslichkeitskoeffizient, bezeichnet:
- GaslöslichkeitGas i = Sättigungskonzentrationi / Partialdrucki
Der Index i bezieht sich dabei auf das Gas in möglichen gemischten Lösungen, wie etwa bei der Lösung des Gasgemisches „Luft“ in Wasser.
In der Regel nimmt diese Löslichkeit von Gasen in Flüssigkeiten mit steigender Temperatur ab. Ebenso wirken sich im Wasser gelöste Feststoffe mindernd auf die Gaslöslichkeit aus. Deshalb ist beispielsweise in Meerwasser weniger Sauerstoff löslich als in Süßwasser.
Eine Abweichung von der Proportionalität zwischen Gasdruck und Gleichgewichtskonzentration macht sich erst bei sehr hohen Drücken (im Vergleich zum Atmosphärendruck) bemerkbar.
Lösung in Feststoffen
Die Gesetzmäßigkeiten der Löslichkeit bleiben prinzipiell auch für Feststoffe erhalten. Auch hier können unterschiedliche Phasen beobachtet werden. Ist ein festes Gemisch einphasig, liegt eine Lösung vor. Kristalline Stoffe bilden dabei Mischkristalle oder intermetallische Verbindungen. Getrennte Phasen liegen oft sehr feinverteilt vor. Dies ist besonders der Fall bei gegenüber der Diffusionsgeschwindigkeit hoher Abkühlgeschwindigkeit bei der Entstehung oder bei eutektischer Zusammensetzung. Daher ist mit bloßem Auge eine Beurteilung der Löslichkeit meist nicht möglich, besonders da auch einphasige Systeme oft kristallin gekörnt sind und außerdem interkristalline Korngrenzenphasen entstehen können. Hilfsmittel sind Diagramme des Temperaturverlaufes der Abkühlung, wo Phasenumwandlungen als Haltepunkte oder Knicke erscheinen, und lichtmikroskopische sowie weitere kristallographische Untersuchungen mit noch höherem Aufwand.
Wesentlich häufiger als bei Flüssigkeiten liegen bei Feststoffen metastabile Lösungen vor. Diese entstehen besonders dann, wenn im bereits erstarrten Gemisch bei Temperaturabnahme die Löslichkeit abnimmt und keine ausreichende Diffusionsgeschwindigkeit mehr gegeben ist. Durch Lösungsglühen kann eine gleichmäßige Löslichkeit in einer Legierung nahe dem thermodynamischen Gleichgewicht erreicht werden.
Die Löslichkeit von Feststoffen ineinander bzw. deren Mehrphasigkeit und die Veränderung dieser Eigenschaft mit der Temperatur ist von großer Bedeutung für die Bildung technischer Legierungen. Dabei ist auch oft eine Mehrphasigkeit erwünscht. Kupfer/Nickel und Silber/Gold sind Beispiele für Systeme mit vollständiger Löslichkeit bei jeder Zusammensetzung, das Letztere kommt als Elektron auch natürlich vor. Stähle sind dagegen weit überwiegend mehrphasig (Ferrit, Austenit, Martensit, Zementit), als einphasige Legierungen sind nur hochlegierte ferritische Chromstähle mit 15 % bis 30 % Chrom und weniger als 0,1 % Kohlenstoff von technischer Bedeutung. Das System Kupfer/Zink hat bei Raumtemperatur fünf verschiedene Phasen, die durch Mischungslücken getrennt sind. Je nach Zusammensetzung liegt nur eine davon oder in der Mischungslücke zwischen zwei Phasen ein Gemisch dieser beiden vor. Im technisch relevanten Bereich (Messing: Kupfergehalt min. 50 %) liegen zwei dieser Phasen.
Das System Kupfer/Zinn, zu dem die Zinnbronze als älteste technische Legierung gehört, ist ein Beispiel für metastabile Verhältnisse: Zwischen 520 °C und 586 °C ist Zinn in Kupfer mit einem Anteil bis zu 15,8 % der bei dieser Temperatur bereits festen Legierung löslich. Obwohl bei Raumtemperatur im Gleichgewicht die Löslichkeit von Zinn nahe null liegt, bleibt Material, das bei der erhöhten Temperatur eine solche Zinnkonzentration nicht überschritten hat, bei weiterer Abkühlung einphasig, da nun kaum noch Diffusion stattfindet. Andererseits entmischt sich bereits bei der vorangehenden Erstarrung die Schmelze und das zuletzt erstarrte Material kann die Grenze von 15,8 % Zinn schon bei deutlich niedrigeren Zinngehalten der Legierung überschreiten. Wegen der großen Diffusionsträgheit des Zinns können diese Konzentrationsunterschiede nur durch längeres Glühen bei ca. 750 °C ausgeglichen werden. Beide Effekte zusammen führen dazu, dass gegossene Zinnbronze je nach Abkühlgeschwindigkeit bei Zinngehalten von maximal 4 % bis 6 % einphasig ist und durch Glühen sogar Einphasigkeit bis 15 % erreicht werden kann, obwohl bei Raumtemperatur keine nennenswerte Löslichkeit gegeben ist.
Weblinks
Einzelnachweise
- Jürgen Feßmann, Helmut Orth: Angewandte Chemie und Umwelttechnik für Ingenieure Handbuch für Studium und betriebliche Praxis. ecomed-Storck GmbH, 2002, ISBN 978-3-609-68352-2, S. 299 (eingeschränkte Vorschau in der Google-Buchsuche).
- Solubility and pH: Solubility and pH, abgerufen am 18. August 2018.
- Peter Rudolph: Handbook of Crystal Growth Bulk Crystal Growth. Elsevier, 2014, ISBN 978-0-444-63306-4, S. 1192 (eingeschränkte Vorschau in der Google-Buchsuche).
- Y. Taniguchi, K. Hara, M. Senoo: High Pressure Liquids and Solutions. Elsevier, 2013, ISBN 978-1-4832-9051-5, S. 1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Martin Bultmann: Grundlagen der Arzneiformenlehre: ein Leitfaden zu Vorlesung und Praktikum. BoD – Books on Demand, 2003, ISBN 978-3-8330-0794-1, S. 5 (books.google.de).
- iupac.org: IUPAC Gold Book - solubility, abgerufen am 8. Februar 2017.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, 2016, ISBN 978-1-4665-7115-0, S. 19 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jander, Blasius: Einführung in das anorganisch-Chemische Praktikum. 14. Aufl. S.Hirzel, Leipzig 1995, ISBN 3-7776-0672-3.
- Friedrich Wilhelm Georg Kohlrausch, Friedrich Rose: Die Löslichkeit einiger schwer löslicher Körper im Wasser, beurtheilt aus der elektrischen Leitungsfähigkeit der Lösungen. In: Zeitschrift f. physik. Chemie. Nr. 12, 1893, S. 234–243.
- Friedrich Wilhelm Georg Kohlrausch, Friedrich Rose: Die Löslichkeit einiger schwer löslicher Körper im Wasser, beurtheilt aus der electrischen Leitungsfähigkeit der Lösungen. In: Annalen der Physik. Band 286, Nr. 9, 1893, S. 127–137, doi:10.1002/andp.18932860907.
- Arnold F. Holleman: Bestimmung der Löslichkeit sogenannter unlöslicher Salze. In: Zeitschrift f. physik. Chemie. Nr. 12, 1893, S. 125–139.
- Charles E. Mortimer, Ulrich Müller: Chemie das Basiswissen der Chemie ; 126 Tabellen. Georg Thieme Verlag, 2007, ISBN 978-3-13-484309-5, S. 207 (eingeschränkte Vorschau in der Google-Buchsuche).
- Rudi Hutterer: Fit in Anorganik Das Prüfungstraining für Mediziner, Chemiker und Biologen. Springer-Verlag, 2012, ISBN 978-3-8348-2304-5, S. 284 (eingeschränkte Vorschau in der Google-Buchsuche).
- Europäisches Arzneibuch, 8. Ausgabe, 2. Nachtrag, S. 5614 f. (1.4 Monographien).