Phosphane
Phosphane und Phosphine bezeichnen dieselbe Verbindungsklasse, deren Verbindungen aus einem dreiwertigen Phosphoratom oder entsprechenden Phosphorketten bestehen, an die Wasserstoff oder organische Substituenten gebunden sind. Phosphin ist die ursprüngliche Bezeichnung, die jedoch nicht IUPAC-konform ist (Phosphin erinnert an die leichtere stickstoffanaloge Verbindungsklasse der Amine). Im Folgenden wird nur Phosphan verwendet.
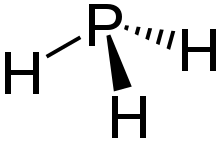
Struktur
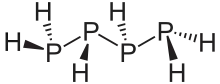
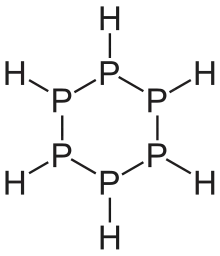
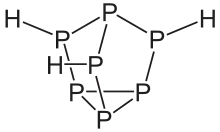
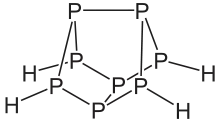
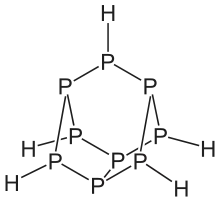
Phosphane zeigen eine Vielfalt an Strukturen. Lineare Phosphane sind bis zu einer Kettenlängen von sechs Phosphoratomen bekannt. Sie sind ähnlich wie die Alkane aufgebaut, jedoch weist das Phosphoratom als vierten Substituenten jeweils ein Elektronenpaar auf. Daher haben sie die allgemeine Summenformel PnHn+2. Daneben gibt es auch noch Verbindungen mit den Summenformel PnHn und PnHn−2. Wie bei den Kohlenwasserstoffen treten auch ringförmige Phosphane auf. Besonders ausgeprägt sind jedoch käfigartige Strukturen, die relativ häufig auch ansonsten ungewöhnliche, weil instabile Dreierringe enthalten. Allen Phosphanen – außer dem Monophosphan – ist gemein, dass sie aus einem Gerüst aus Phosphoratomen bestehen, die über Einfachbindungen verknüpft sind.[1]
Nomenklatur
Die Gruppe an Phosphanen, die nur aus Wasserstoff und Phosphor bestehen, nennen sich auch Phosphorhydride. Die einfachste Verbindung aus dieser Gruppe ist Monophosphan (PH3). Analog zu den Boranen wird der Name der Phosphane aus einem der Anzahl der Phosphor-Atome entsprechenden griechischen Zahlwort, der Bezeichnung phosphan und einer in Klammern gestellten arabischen Ziffer für die Anzahl der Wasserstoffatome gebildet, beispielsweise Triphosphan(5) für P3H5 oder Heptaphosphan(3) für P7H3. An dieser Stelle sei angemerkt, dass die entsprechende fünfwertige Verbindung PH5, das sogenannte Phosphoran, nicht existiert. Auch bei den organischen Derivaten ist eine entsprechende Fünfbindigkeit nur selten vertreten (z. B. bei PPh5).
Organische Derivate des Monophosphans (PH3) entstehen formal durch den Austausch des Wasserstoffs (H) gegen organische Reste – allgemein mit R bezeichnet. Die von den Phosphanen abgeleitete funktionelle Gruppe wird Phosphino-Gruppe genannt. Je nachdem, ob Phosphane ein (PH2R), zwei (PHR2) oder drei (PR3) organische Reste tragen, spricht man wie bei den Aminen von primären, sekundären bzw. tertiären Phosphanen. Phosphane, die kurze Alkylgruppen tragen, wie Trimethylphosphin [(H3C)3P] sind unangenehm riechende Flüssigkeiten. Sie sind sehr reaktionsfähig und neigen zur Selbstentzündung. Triarylphosphine wie (H5C6)3P sind Festsubstanzen, die schwache basische Eigenschaften aufweisen. Sie reagieren leicht unter Aufnahme eines weiteren organischen Restes zu Phosphoniumsalzen. Organophosphorverbindungen, die drei Bindungseinheiten P-O-C enthalten, nennt man Phosphite (Formel: P(OR)3).
Eigenschaften
Phosphor-Wasserstoff-Verbindungen
Phosphane sind extrem giftige Substanzen. Monophosphan (PH3) ist gasförmig, Diphosphan (P2H4) ist bei Zimmertemperatur eine farblose und an Luft selbstentzündliche Flüssigkeit, die höheren sind fest. Phosphane sind sehr reaktionsfähig. Sehr reines Monophosphan PH3 entzündet sich nicht von selbst. Wegen der Anwesenheit höherer Phosphane (vor allem Diphosphan) muss bei der Verwendung von kommerziell erhältlichem oder im Labor zubereiteten Monophosphan immer mit Selbstentzündung gerechnet werden. Diese Phosphorverbindungen haben einen extrem durchdringenden knoblauchartigen Geruch, der schon in geringsten Konzentrationen wahrnehmbar ist.
Organische Phosphane
Organische Phosphane mit kurzen Alkylgruppen sind flüssig und sehr luftempfindlich, teilweise auch lichtempfindlich (beispielsweise t-Bu3P, wegen der Möglichkeit einer α-H-Abstraktion). Auch sie haben einen charakteristischen durchdringenden Geruch, der entfernt an Knoblauch erinnert.
Die Basizität des Phosphans wird durch Alkylgruppen bedeutend gesteigert, und zwar in viel größerem Umfang, als dies bei Ammoniak der Fall ist. So beträgt der pKb-Wert von Phosphan 27, der von Triethylphosphan 5,31.[2] Im Vergleich hierzu nehmen die pKb-Werte vom Ammoniak (4,75) zum Triethylamin (3,25) nur wenig ab.
Triarylphosphane dagegen sind fest und wesentlich stabiler. Sie können im festen Zustand problemlos gelagert werden und sind erst in Lösung oxidationsempfindlich. Die Reinstoffe sind geruchlos, kommerzielle Produkte können jedoch mit primären und sekundären Phosphanen verunreinigt sein, die einen Geruch aufweisen.
Unter den Methylchlorphosphanen sind zwei Verbindungen bekannt, das Methyldichlorphosphan CH3PCl2 und das Dimethylchlorphosphan (CH3)2PCl. Beide Substanzen sind farblose Flüssigkeiten, an der Luft selbstentzündlich und weisen eine hohe Reaktivität auf. Die Synthese kann erfolgen, indem man ein Phosphordampf-Methylchlorid-Gemisch bei 350 °C über einen Aktivkohlekatalysator leitet. Eine andere Möglichkeit besteht über die Kinnear-Perren-Reaktion von Phosphortrichlorid, Aluminiumchlorid und Methylchlorid über die Komplexe [CH3PCl3][AlCl4] bzw. [(CH3)2PCl2][AlCl4] als Zwischenstufe. Wegen ihrer hohen Reaktivität lassen sich aus den Methylchlorphosphanen eine Vielzahl von phosphororganischen Verbindungen herstellen.[3]
Gewinnung/Darstellung
Monophosphan
Es gibt zahlreiche Möglichkeiten zur Darstellung von Monophosphan, z. B. disproportioniert weißer Phosphor (P4) im alkalischen Medium zu Phosphan und Phosphinsäure:
Analog zur Herstellung von Ammoniak im Haber-Bosch-Verfahren kann auch eine Synthese aus den Elementen erfolgen:
Im Labor lässt man Calciumphosphid oder Aluminiumphosphid mit Wasser reagieren:
Neben Monophosphan entsteht hierbei auch etwas Diphosphan.
Zuletzt ist Monophosphan auch aus Phosphoniumiodid und Kaliumhydroxid zugänglich:[4]
Organische Phosphane
Die Gewinnung von Phosphanen kann ausgehend von Monophosphan oder von Phosphortrichlorid erfolgen. In Substitutionsreaktionen werden Wasserstoff bzw. Chlor durch organische Reste ersetzt.
Monophosphan kann dabei mit Alkylhalogeniden oder Olefinen umgesetzt werden:
- Monophosphan reagiert mit Methylchlorid zu Trimethylphosphin und Chlorwasserstoff.
Ausgehend vom Phosphortrichlorid verwendet man Grignard- oder Organolithium-Verbindungen:
- Phosphortrichlorid reagiert mit Phenylmagnesiumbromid zu Triphenylphosphin und Magnesiumbromid/Magnesiumchlorid.
Statt PCl3 ist die Verwendung von Phosphiten, z. B. P(OPh)3 oder P(OMe)3 (wobei Ph = Phenyl, -C6H5 und Me = Methyl, -CH3) von Vorteil, da diese nicht so sehr zu Nebenreaktionen neigen (Bildung von organischen Diphosphanen R2P-PR2) und einfacher zu handhaben sind.
Eine weitere Darstellungsmöglichkeit ist die Hydrophosphorylierung von Doppel- und Dreifachbindungen. Diese kann basisch katalysiert ablaufen oder photolytisch mit einem Radikalstarter (etwa Azobis(isobutyronitril), AIBN) initiiert werden:
Verwendung
Phosphane haben herausragende Bedeutung als Liganden in der homogenen Katalyse. Sie stabilisieren eine Vielzahl von Katalysatoren und ermöglichen durch ihre strukturelle Vielfalt eine Einstellung der Katalysator-Eigenschaften. Durch den Einsatz von chiralen Phosphanen ist die enantiomerenreine Darstellung vieler organischer Verbindungen (v. a. Pharmazeutika und deren Ausgangsverbindungen) erst ermöglicht worden. Auch bei der Herstellung von Kunststoffen werden häufig Katalysatoren verwendet, die Phosphanliganden enthalten oder für Olefinierungsreaktionen.
Phosphane werden aber auch als Reagenzien in einer Reihe von chemischen Reaktionen eingesetzt, z. B. Mitsunobu-Reaktion, Wittig-Reaktion usw. Hierbei wird die hohe Oxophilie des Phosphors ausgenutzt, d. h. die hohe Neigung eines Phosphoratoms, Bindungen zu Sauerstoffatomen auszubilden (hier O=P-Doppelbindungen).
Phosphane werden auch über metallorganische Gasphasenepitaxie (MOVPE) zur Herstellung phosphorhaltiger III-V-Verbindungshalbleiter, z. B. dotiertes Silicium, GaP, GaAsP und InGaAsP für Leuchtdioden und Halbleiterlaser sowie ultraschnelle Transistoren (HEMTs) verwendet.
Phosphorwasserstoffe werden als Rodentizid eingesetzt. Aluminiumphosphid und Calciumphosphid werden in Wühlmausgänge eingebracht und bilden mit Feuchtigkeit Phosphorwasserstoffe. Zinkphosphid wird als Fraßköder eingesetzt. Hier bildet sich im Magen Phosphorwasserstoff.
Monophosphan wird als Begasungsmittel zur Abtötung von Vorratsschädlingen in Lagerräumen oder Containern eingesetzt. Was bei konventionell erzeugter Ware erlaubt ist, ist für ökologisch erzeugte Produkte nicht zulässig.[5]
Derivate
Phosphanoxid (Phosphorylhydrid) O=PH3, das Oxid des Monophosphans, existiert nur in Form von Alkyl- und Arylderivaten OPR3, OPHR2 bzw. OPH2R. Ersetzt man im Phosphanoxid die drei Wasserstoffatome durch einwertige Reste (ausgenommen Hydroxygruppen), so erhält man die Phosphorylverbindungen (siehe z. B. Phosphorylchlorid); ersetzt man sie nacheinander durch eine bis drei Hydroxygruppen, so erhält man die Phosphin-, Phosphon- bzw. Phosphorsäure.
Tris(trimethylsilyl)phosphan wird oftmals als leichter zu handhabender Ersatzstoff für das Phosphan als Synthesebaustein eingesetzt.
Siehe auch
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 757–758.
Einzelnachweise
- Michael Binnewies, Manfred Jäckel, Helge Willner, Geoff Rayner-Canham: Allgemeine und Anorganische Chemie. Spektrum Akademischer Verlag, Heidelberg u. a. 2003, ISBN 3-8274-0208-5.
- Francis A. Carey, Richard J. Sundberg: Organische Chemie. Ein weiterführendes Lehrbuch. 2. korrigierte Nachdruck. Wiley-VCH, Weinheim 2004, ISBN 3-527-29217-9.
- Horst Staendeke, Hans-Jerg Kleiner: Methylchlorphosphane und Folgeprodukte. In: Angewandte Chemie. 85. Jg., 1973, Nr. 22, S. 973–978.
- Georg Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry.Volume 1. 2nd edition. Academic Press, New York u. a. 1963, S. 525–530.
- Phosphin auf der Seite von Galab, abgerufen am 28. April 2018.