Ammoniumheptamolybdat
Ammoniumheptamolybdat bildet farblose Kristalle, die sich bei etwa 90 °C unter Abgabe von Kristallwasser zersetzen. Es bildet üblicherweise ein Tetrahydrat mit der chemischen Formel (NH4)6Mo7O24 · 4 H2O. Es wird häufig nur als Ammoniummolybdat bezeichnet, obwohl Ammoniummolybdat genauso gut Ammoniumorthomolybdat (NH4)2MoO4 und andere Molybdate bezeichnen kann.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
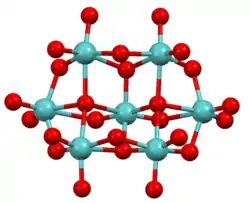 | |||||||||||||||||||
| _ Mo6+ _ O2− Das Heptamolybdatanion in Ammoniumheptamolybdat | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumheptamolybdat | ||||||||||||||||||
| Verhältnisformel | (NH4)6Mo7O24 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 1235,86 g·mol−1 (Tetrahydrat) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,498 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
Ammoniumheptamolybdat wird recht einfach durch Auflösen von Molybdän(VI)-oxid in einem Überschuss von wässrigem Ammoniak und anschließendem Eindampfen der Lösung bei Raumtemperatur hergestellt. Während die Lösung verdunstet, entweicht das überschüssige Ammoniak. Diese Methode führt zur Bildung von sechsseitigen transparenten Prismen des Tetrahydrats von Ammoniumheptamolybdat.[5] Lösungen von Ammoniumheptamolybdat reagieren mit Säuren wieder zu Molybdän(VI)-oxid und den entsprechenden Ammoniumsalzen. Der pH-Wert einer konzentrierten Lösung liegt zwischen 5 und 6.
Verwendung

Ammoniumheptamolybdat dient im Labor zum Nachweis von Kieselsäuren, Phosphorsäure, Phosphaten, Arsen, Blei und Sorbit[6] sowie zur Analyse von Seewasser.[7] Darüber hinaus wird es in einem standardisierten Verfahren zur Immissionsmessung von Schwefelwasserstoff eingesetzt.[8]
Mit Phosphaten bildet es nach vorangegangener Behandlung der Stoffprobe mit Salpetersäure einen gelblichen Niederschlag von Molybdängelb/Ammoniumdodecamolybdatophosphat (NH4)3[P(Mo3O10)4].[9] Bei Zusatz von Ascorbinsäure als mildem Reduktionsmittel erfolgt starke Blaufärbung (Bildung von Molybdänblau). Bei geringeren Konzentrationen von Molybdat erfolgt keine Fällung, sondern nur Farbänderung der Lösung.
Unter Berücksichtigung, dass das Heptamolybdat in wässriger Lösung ein Gleichgewicht eingeht:
ergibt sich folgende Reaktionsgleichung:
Diese Reaktionen werden auch zur photometrischen Bestimmung von Molybdat oder Phosphat im Spurenbereich eingesetzt.
Es dient weiterhin zur Herstellung von Katalysatoren, als Molybdändünger[10] und großtechnisch als Zwischenprodukt zur Gewinnung von Molybdän aus Molybdänerzen.[11]
In der Biologie und Biochemie wird es darüber hinaus in der Elektronenmikroskopie als Kontrastmittel (negativer Abdruck) in einer Konzentration von 3 bis 5 Vol.-% verwendet, auch dann, wenn Trehalose in der Probe vorhanden ist.[12] Auch in der Kryo-Elektronenmikroskopie dient es – in gesättigten Konzentrationen – als Kontrastmittel.[13][14]
Weblinks
- climaxem.com: Preparation of molybdate solutions (Memento vom 1. März 2012 im Internet Archive) (engl.)
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-47.
- Datenblatt Ammoniumheptamolybdat (PDF) bei Carl Roth, abgerufen am 20. August 2010.
- Eintrag zu Ammoniummolybdat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Datenblatt Ammoniumheptamolybdat-Tetrahydrat (Memento vom 9. Mai 2011 im Internet Archive) bei GFS Chemicals (PDF; 44 kB).
- L. Svanberg, H. Struve: Ueber einige Verbindungen und über das Atomgewicht des Molybdäns. In: Journal für Praktische Chemie. Band 44, 1848, S. 257–321, hier: S. 282 (Volltext – zitiert in Gmelin’s Handbuch für Anorganische Chemie. Band 53, S. 255).
- Chemikalien.de
- T. Parsons, V. Maita, C. Lalli: A manual of chemical and biological methods for seawater analysis, Pergamon, Oxford 1984.
- VDI 2454 Blatt 1:1982-03 Messen gasförmiger Immissionen; Messen der Schwefelwasserstoff-Konzentration; Molybdänblau-Sorptionsverfahren. VDI-Verlag, Düsseldorf, S. 2–3.
- Bilder bei Seilnacht
- Übersicht (Memento vom 28. Februar 2013 im Internet Archive) (PDF; 252 kB)
- Bericht zu Molybdän von Wissenschaft Online.
- J. R. Harris, R. W. Horne: Negative staining, in: J. R. Harris (Ed.), Electron Microscopy in Biology, Oxford University Press, Oxford 1991.
- M. Adrian, J. Dubochet, S. D. Fuller, J. R. Harris: Cryo-negative Staining, in: Micron, 1998, 29 (2–3), S. 145–160; doi:10.1016/S0968-4328(97)00068-1.
- S. De Carlo, C. El-Bez, C. Alvarez-Rúa, J. Borge, J. Dubochet: Cryo-negative staining reduces electron-beam sensitivity of vitrified biological particles, in: J. Struct. Biol., 2002, 138 (3), S. 216–226; doi:10.1016/S1047-8477(02)00035-7; PMID 12217660.
