Säuren
Säuren sind Chemische Verbindungen, die in der Lage sind, ein oder auch mehrere ihrer gebundenen H-Atome als Proton (H+) an einen Reaktionspartner zu übertragen, der für jedes zu bindende Proton ein freies Elektronenpaar zur Verfügung stellen muss. Man spricht dann von Protonenübertragungsreaktionen. Dementsprechend werden die Moleküle, die Protonen binden können, auch als Protonenakzeptoren bezeichnet. Zu bedenken bleibt, dass an unterschiedliche Atome gebundene H-Atome auch unterschiedlich leicht als Protonen abgegeben werden können. Pauschal spricht man dann von mehr oder weniger stark sauren Protonen bzw. Verbindungen. In rein wässrigen Lösungen steht als Reaktionspartner, der die Protonen aufnehmen kann, nur das Lösungsmittel Wasser zur Verfügung. Es bilden sich dann Oxonium-Ionen, die auch Hydroniumionen genannt werden (H3O+) und der pH-Wert der Lösung sinkt. Säuren reagieren mit sogenannten Basen unter Bildung von Wasser und Salzen. Eine Base ist somit das Gegenstück zu einer Säure und vermag die Säure zu neutralisieren.[1]
Im weiteren Sinn beschreiben verschiedene Säure-Base-Konzepte wesentlich breitere Paletten von chemischen Reaktionen, die weit über die bisher erwähnten Reaktionen hinausreichen können.
Geschichte
Wohl die älteste bekannte Säure (lat. acidum) ist Essig (lat. acetum), eine etwa fünfprozentige wässrige Lösung der Verbindung Essigsäure. Säuren waren etwas Essigartiges (oxos od. acidus). In der Alchemie galt Säure als ein Urstoff. Die sauren Eigenschaften basierten auf einer einzigen Ursäure, die dann in verschiedenen Substanzen zur Wirkung kam. So lassen Säuren Kalk bzw. Carbonate aufschäumen, haben eine ätzende Wirkung und einen sauren Geschmack. Bis zum Ende des 13. Jahrhunderts waren neben Essig und anderen sauren Pflanzensäften keine Säuren bekannt. Frühe Kenntnisse bezüglich Säuren werden dem im 8. Jahrhundert lebenden, arabischen Autor wissenschaftlicher Schriften, Geber zugeschrieben, der auf Schriften früherer Autoren, der sogenannten Pseudo-Geber zurückgreifen konnte. Es entwickelten sich Kenntnisse über verschiedene anorganische Säuren, die alle den Varietäten des Elements Wasser zugeschrieben wurden. Ab dem 18. Jahrhundert wurden sie als Mineralsäuren bezeichnet.
- Eine Herstellung von Salpetersäure (HNO3) wurde von den Pseudo-Gebern vermutlich nach dem 13. Jahrhundert als „auflösendes Wasser“ (aqua dissolutiva) oder „starkes Wasser“ (aqua fortis) beschrieben. Dabei wurde Kupfervitriol (siehe aber auch Chalkanthit) mit Salpeter und Alaunen auf Rotglut erhitzt. Es entweichen nitrose Gase, die mit Wasser Salpetersäure bilden. Man nannte diese Säure auch Scheidewasser, da sie Silber in einer chemischen Reaktion löst, aber Gold nicht. J. R. Glauber beschrieb 1648 die Herstellung der konzentrierten (rauchenden) Salpetersäure (spiritus acidus nitri) durch Umsetzung mit Schwefelsäure.
- Königswasser, aus heutiger Sicht eine Mischung aus Salpeter- und Salzsäure, dürfte ähnlich früh bekannt gewesen sein, da es sich relativ einfach durch Umsetzung von Salpetersäure mit dem bekannten Salmiak gewinnen lässt. Königswasser war die Königin aller Säuren, der nicht einmal Gold, der König der Metalle, widerstehen konnte.
- Schweflige Säure (H2SO3) ist sicher lange bekannt, da sie durch Verbrennung von elementarem Schwefel zu erhalten ist. Sicherlich war bei vielen Prozessen auch Schwefelsäure (mit) dabei. Genauere Prozesse zur Darstellung von Schwefelsäure (H2SO4) wurden aber erst 1597 von A. Libavius genauer beschrieben: a) Glühen von Eisen- oder Kupfersulfat, dem sogenannten Eisen- bzw. Kupfervitriol – siehe hierzu auch Vitriolverfahren – zum Oleum vitrioli (rauchender Schwefelsäure) und b) Verbrennung von Schwefel und anschließende Oxidation, die zu verdünnten Lösungen (Oleum sulphuris) führten. Eine technische Umsetzung gelang im 19. Jahrhundert mit dem Bleikammerverfahren.
- Salzsäure (HCl) wurde erst Ende des 16. Jahrhunderts bekannt. Durch Glühen einer Mischung aus Kochsalz und Ton beschrieb A. Libavius eine Synthese. B. Valentinus beschrieb die Umsetzung von Vitriol und Kochsalz zu aqua caustica, dem ätzenden Wasser. Intensive Untersuchungen durch J. R. Glauber im 17. Jahrhundert führten zu Glaubers Salzgeist (Spiritus salis Glauberianus), der sehr konzentrierten, sogenannten rauchenden Salzsäure bzw. dem Gas Chlorwasserstoff.
Der wichtige Begriff Base als phänomenologisches Gegenstück zur Säure wurde im 17. Jahrhundert von Alchimisten und Chemikern wie G. E. Stahl, R. Boyle und G. F. Rouelle verwendet, weil „basische“ Stoffe die nichtflüchtige Grundlage zur Fixierung flüchtiger Säuren bildeten und die (ätzende) Wirkung von Säuren aufheben konnten. Grundlegende Schritte in die Chemie gelangen A. L. Lavoisier im 18. Jahrhundert, der bestimmten chemischen Verbindungen bestimmte Eigenschaften zuwies. Er dachte, dass Säuren stets aus Nichtmetalloxiden und Wasser sowie Basen aus Metalloxiden und Wasser entstünden. Humphry Davy fand 1808 ein Gegenbeispiel (Chlorwasserstoff). J. von Liebig sah Säuren als Wasserstoff-Verbindungen, die sich durch Metalle in Salze überführen lassen.
1887 definierte S. Arrhenius Säuren als Stoffe, die beim Auflösen in Wasser unter Abgabe von Protonen (H+) dissoziieren, und Basen als Stoffe, die beim Auflösen in Wasser unter Abgabe von Hydroxidionen (OH−) dissoziieren. Gibt man Säuren und Basen zusammen, neutralisieren sie sich unter Bildung von Wasser. Die Theorie war jedoch noch unzureichend, da Verbindungen ohne Sauerstoff nicht einbezogen wurden: Auch Ammoniak neutralisiert eine Säure. J. N. Brønsted und Martin Lowry beschrieben 1923 unabhängig voneinander die heute noch wichtigste Definition von Säuren und Basen. Sie bilden die Basis der unten erläuterten Erklärungen zur Säure.
Was sind Säuren?
Ohne näher auf verschiedene Säure-Base-Konzepte einzugehen, soll hier als Einstieg eine mögliche und übliche Betrachtungsweise beschrieben werden. In engem Zusammenhang mit Säuren stehen in der Regel und häufig ohne ausdrückliche Erwähnung die Anwesenheit und bestimmte Eigenschaften des Wassers. Reines Wasser unterliegt einer sogenannten Autoprotolyse. Hierbei entstehen aus dem Wasser in sehr kleinen und gleichen Mengen Oxoniumionen (H3O+) und Hydroxidionen (OH−):
In dieser Reaktionsgleichung des Wassers zeigt sich die Eigenschaft einer Säure, nämlich die Fähigkeit der Bildung von H3O+-Ionen in Wasser. Gleichzeitig bilden sich OH−-Ionen in Wasser – eine der Eigenschaften, über die eine Base verfügen kann. Man bezeichnet jedoch Wasser weder als eine Base noch als eine Säure und nennt sein Verhalten neutral. Dies bezieht sich auf den pH-Wert, der die Konzentration der H3O+-Ionen in Wasser angibt. Reines Wasser hat den pH-Wert von 7, also eine sehr kleine Konzentration. Diese Reaktion ist, wie alle in diesem Abschnitt beschriebenen Reaktionen, eine Gleichgewichtsreaktion: Die Bildung der Ionen sowie deren Vereinigung zu Wasser findet ständig und mit gleicher Häufigkeit statt. Neutral heißt also nicht, dass nichts passiert.
| Organische Säuren |
|---|
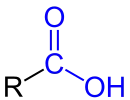 Carbonsäure |
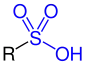 Sulfonsäure |
| R ist eine Organylgruppe, z. B. eine Methyl- oder Phenylgruppe. Die funktionellen Gruppen sind blau markiert. |
Als Säuren kann man chemische Verbindungen bezeichnen, die in einer bestimmten Wechselwirkung mit Wasser stehen können. Sie verfügen über Wasserstoffatome, die ionenähnlich (ionogen) gebunden sind. So reagiert reine Essigsäure (H3C-COOH) mit Wasser und bildet dabei weitere H3O+-Ionen. Tritt eine solche Reaktion auf, kann man eine Verbindung als Säure bezeichnen. Neben dem Oxoniumion entstehen auch das Acetat-Anion H3C-COO−:
Essigsäure ist eine Carbonsäure und im Vergleich zu anorganischen Säuren wie Chlorwasserstoff eine eher schwache Säure. In wässriger Lösung liegen ein guter Teil der Moleküle undissoziiert als H3C-COOH vor. Auch hier stellt sich zügig ein Gleichgewicht ein. Die obige Reaktionsgleichung (2) lässt sich aus diesem Grund mit gleicher Berechtigung von rechts nach links lesen. Ein Acetat-Anion reagiert mit einem Oxoniumion zu Wasser und Essigsäure. In dieser Leserichtung findet eine basische Reaktion statt: die Umsetzung von Hydroxoniumionen zu Wassermolekülen. Setzt man einer Essigsäurelösung in geeigneter Menge Acetat-Anionen, beispielsweise in Form des gut löslichen Natriumacetats zu, kann die saure Eigenschaft der Essigsäure vollständig durch die basische Eigenschaft des Acetat-Ions kompensiert werden. Die wässrige Lösung wird neutralisiert. Neutral heißt auch hier keineswegs, dass nichts in der Lösung passiert. Nur die Konzentration der H3O+-Ionen ist so gering wie in reinem Wasser.
Ergänzend soll nun die basische Reaktion betrachtet werden, die auftritt, wenn Natriumacetat in reinem Wasser gelöst wird (das Na+-Kation ist in der Reaktionsgleichung weggelassen):
Hier bilden sich Hydroxidionen (OH−). Fügt man dieser Acetatlösung eine geeignete Menge an wässriger Essigsäurelösung zu, wird die Lösung neutral. Es stellt sich zwischen H3O+ und OH− das Gleichgewicht (1) ein, das zu Anfang als Grundeigenschaft von Wasser vorgestellt wurde und hier als Gleichung (1a) andersherum dargestellt ist.
| Eine Säure kann man als chemische Verbindung auffassen, die über die Fähigkeit verfügt, in wässriger Lösung H3O+-Ionen zu bilden oder OH−-Ionen zu Wassermolekülen zu überführen. Eine Base hingegen verfügt in wässriger Lösung über die Fähigkeit, OH−-Ionen zu bilden oder H3O+ zu H2O zu überführen. |
Viele als Säure bezeichnete Substanzen sind von vornherein wässrige Lösungen und können nicht ohne weiteres als chemische Verbindungen verstanden werden, die über ionogen gebundene Wasserstoffatome verfügen. Salzsäure ist eine wässrige Lösung des Gases Chlorwasserstoff (HCl) und gilt als eine starke Säure. In dieser Lösung liegt – vor jeder praktischen Verwendung der Säure – bereits die Gleichgewichtsreaktion (4) vor, bei der das Gleichgewicht fast vollständig auf der rechten Seite liegt.
Der Chlorwasserstoff hat sein Potential, eine Säure zu sein, schon längst ausgespielt, und es haben sich H3O+-Ionen gebildet. Die chemischen Auswirkungen, die durch eine praktische Anwendung der Salzsäure auftreten, sind auf Reaktionen der H3O+-Ionen zurückzuführen. Die Säure ist das H3O+-Ion. Das Maß für den Säuregehalt (Konzentration) ist hier der pH-Wert, während bei schwächeren Säuren, wie Essigsäure, das Maß für die Säurestärke, der pKS-Wert, im Vordergrund steht. Starke und schwache Säuren unterscheiden sich durch ihre Tendenz, „gerne“ oder „weniger gerne“ H3O+-Ionen in Wasser zu bilden. Im Abschnitt Säure-Base-Gleichgewicht werden diese Tendenzen näher beschrieben.
| Die chemische Wirkung bei der praktischen Verwendung einer Säure geht meist auf H3O+-Ionen zurück. Man kann die Oxoniumionen als die wichtigste Säure auffassen. |
Säure-Base-Gleichgewicht
Bei der Protolyse nimmt ein Reaktionspartner (in der Regel Wasser) das von der Säure abgegebene Proton auf. Dies ist abzugrenzen von den Redoxreaktionen, bei denen Elektronenübergänge stattfinden.
Die allgemeine Gleichgewichtsreaktion einer Säure HA in wässriger Lösung lautet:
Die Säuren unterscheiden sich in ihrer Tendenz, H+-Ionen an Wasser zu übertragen. Diese wird als Säurestärke KS bezeichnet und gibt die Gleichgewichtskonstante (Säurekonstante) der Säurereaktion an. Die Säurekonstante wird häufig in Form des pKS-Wertes angegeben, der als negativer dekadischer Logarithmus der Säurekonstante definiert ist.
Säuren mit großem KS-Wert (kleinem pKS-Wert) sind starke Säuren. Liegt ein pH-Wert einer Lösung, die eine Säure enthält, zwei Einheiten unter dem pKS-Wert, werden nur noch ein Hundertstel der H3O+-Ionen gebildet.
Mehrprotonige Säuren
Säuren, die mehrere Protonen abspalten können, nennt man mehrprotonige Säuren oder auch mehrbasige Säuren. Schwefelsäure (H2SO4) ist eine zweiprotonige (auch diprotonige), Phosphorsäure (H3PO4) eine dreiprotonige (auch triprotonige) Säure. Das Bestreben der Abgabe der einzelnen Protonen (Protolyse) ist unterschiedlich groß und lässt sich durch die Säurekonstante (Ks) beschreiben. Für die einzelnen Protolyseschritte gilt allgemein: KS(I) > KS(II) > KS(III) (bzw. pKS(I) < pKS(II) < pKS(III)).
Für Phosphorsäure gilt:
pKS-Werte wichtiger Säuren
Eigenschaften
Die Eigenschaften von Säuren, insbesondere die von ihnen ausgehenden Gefahren, sind sehr unterschiedlich. Als Beispiele seien hier Salpetersäure (Hauptgefahr: ätzend), Blausäure (starkes Gift) und Pikrinsäure (ein Sprengstoff) genannt.
- Säuren greifen besonders unedle Metalle und Kalk an. Aber auch Kleidung, Haut und Augen (allgemein alle organischen Materialien) laufen bei Kontakt Gefahr, von der Säure zerstört zu werden.
- Es gibt starke und schwache Säuren. Chlorwasserstoff ist eine starke Säure und dissoziiert in Wasser vollständig. Die wässrige Lösung nennt man Salzsäure. Essigsäure ist eine schwächere Säure und dissoziiert in Wasser nur zum Teil.
- Säuren kann man mit Wasser verdünnen, dabei wird ihre Wirkung je nach Verdünnung deutlich schwächer. Das Verdünnen von konzentrierten Säuren ist eine exotherme Reaktion. Es entsteht also Wärme. Vor allem beim Verdünnen von konzentrierter Schwefelsäure kann die Säurelösung unkontrolliert wegspritzen.[2] Daher gilt beim Verdünnen die Regel, die Säure in das Wasser zu geben, nicht umgekehrt: „Zuerst das Wasser, dann die Säure, sonst geschieht das Ungeheure.“ Aber auch bei korrektem Mischen ist darauf zu achten, dass die konzentrierte Säure langsam und vorsichtig dem Wasser beigefügt wird.
- Es ist ein weit verbreiteter Irrtum, dass Säuren immer Flüssigkeiten sind. Bekannte Vertreter von Säuren, die rein als Feststoff vorliegen, sind Vitamin C und Citronensäure, eine gasförmige Säure ist beispielsweise Chlorwasserstoff.
- Wässrige Lösungen von Säuren bewirken eine Farbveränderung von Indikatoren, zum Beispiel färben sie blaues Lackmuspapier rot.
- Die „Gegenspieler der Säuren“ sind die Basen (Basenlösung = Lauge). Sie können Säuren neutralisieren. Auch Basen sind ätzend und greifen viele andere Stoffe an, die mit Säuren nicht unbedingt reagieren.
- In Wasser gelöst leiten Säuren den elektrischen Strom. Hierbei erfolgt eine Elektrolyse, bei der sich an der Kathode (dem Minuspol) Wasserstoff und an der Anode (dem Pluspol) der neutralisierte Stoff des Säureanions bilden, bei der Salzsäure z. B. Chlor. An der Kathode erfolgt eine Reduktion (Elektronenaufnahme) und an der Anode erfolgt eine Oxidation (Elektronenabgabe).
Säure-Base-Reaktionen ohne Wasser
Analog zu den Säure-Base-Reaktionen, die in wässrigen Lösungen und unter Beteiligung des Wassers ablaufen, existieren Reaktionen in anderen Medien. In wasserfreiem Ethanol findet mit Chlorwasserstoff eine Reaktion statt, bei dem Ethanol die Rolle einer Base übernimmt:
In der Gasphase reagieren die Gase Ammoniak und Chlorwasserstoff unter Bildung des Salzes Ammoniumchlorid:
In Säure-Base-Reaktionen können neben Wasser auch andere hinreichend polare Lösungsmittel als Reaktionspartner wirken. Ein gutes Beispiel ist die Autoprotolyse des flüssigen Ammoniaks:
Beispiele für Säuren
Wichtige Säuren sind:
- Schwefelsäure: H2SO4 (industrielle Verwendung, saurer Regen)
- Salzsäure: HCl (industrielle Verwendung)
- Kieselsäure: H4SiO4
- Phosphorsäure: H3PO4 (Lebensmittelindustrie, unter anderem Cola, DNA)
- Kohlensäure: H2CO3 (Lebensmittelindustrie, Technik, Atmosphäre)
- Essigsäure: CH3COOH (Salatbereitung in der Küche, Lebensmittelindustrie)
- Benzoesäure (Konservierungsmittel für Lebensmittel)
- Flusssäure: HF (Computerchipherstellung)
- Salpetersäure: HNO3 (industrielle Verwendung)
Auch Salze mehrprotoniger Säuren können als Säuren wirken („saure Salze“), beispielsweise
Siehe auch
Literatur
Historische Entwicklung der Säuren:
- Claus Priesner, Karin Figala: Alchemie: Lexikon einer hermetischen Wissenschaft. Beck, München 1998, ISBN 3-406-44106-8
- V. Karpenko, J. A. Norris: Vitriol in the History of Chemistry. Chem. Listy, Band 96, 2002, S. 997–1005, PDF
- Geber in Britannica
Weblinks
Einzelnachweise
- Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten: Chemie. Die zentrale Wissenschaft. Pearson Studium, 2007, ISBN 978-3-8273-7191-1, S. 155 f., 773 f.
- G. Jander, E. Blasius: Einführung in das anorganisch-chemische Praktikum. 12., überarbeitete Auflage. Hirtzel Verlag, Stuttgart 1987, ISBN 3-7776-0433-X, S. 5.