Ligand
Ein Ligand (lat. ligare = „binden“) ist in der Komplexchemie (sowie in Organometallchemie und Bioanorganik) ein Atom oder Molekül, welches sich über eine koordinative Bindung (veraltet auch „dative Bindung“) an ein zentrales Metall-Ion binden („koordinieren“) kann. Die koordinative Bindung kommt durch den Lewis-Charakter der beteiligten Bindungspartner zustande: In vielen Komplexen sind die Liganden Lewis-Basen (Elektronenpaar-Donatoren) und die Metallionen Lewis-Säuren (Elektronenpaar-Akzeptoren).
Die Besonderheit der koordinativen Bindung besteht darin, dass (im Unterschied zur klassischen kovalenten Bindung) beide Bindungselektronen vom Liganden oder Metallion zur Verfügung gestellt werden. Komplexverbindungen sind zum Beispiel das rote Blutlaugensalz (Kaliumhexacyanidoferrat(III)), bei dem das zentrale Eisen(III)-Ion von sechs Liganden, in diesem Fall Cyanid-Ionen, umgeben ist.
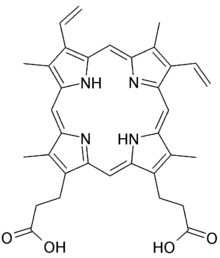
Beispiele aus der Bioanorganik sind das Häm und das Chlorophyll: hier agieren die vier Stickstoffatome im Porphyringerüst als mehrzähniger Ligand für das zentrale Eisen- bzw. Magnesium-Ion.
Die Beschreibung der Metall-Ligand-Bindung als rein donative Bindung ist stark vereinfachend. Vor allem bei schweren Übergangsmetall-Ionen haben die Bindungen meist einen hohen klassisch-kovalenten Anteil (beispielsweise bei Hydrid-Liganden). Auch spielen Rückbindungseffekte vom Metall zum Ligand oftmals eine entscheidende Rolle bei der Bindungsstärke (Bindungsenergie). Dies ist bei vielen Liganden mit π-Systemen der Fall, da die Metallzentren Elektronendichte in die π*-Orbitale verschieben können; Beispiele für solche Liganden sind CO, dessen Komplexe als Metallcarbonyle bezeichnet werden, und Ethen.
Nach dem CBC-Formalismus können Liganden als L-,X- oder Z-Typ klassifiziert werden. Liganden vom L-Typ stellen für die Bindung ein Elektronenpaar zur Verfügung. Dies sind Lewis-Basen wie Phosphane oder das Carbonyl-Molekül. Neutral geladene X-Typ-Liganden können dagegen nur ein Elektron für die Bindung an das Zentralatom bereitstellen, weshalb für die Bindung ein Elektron des Metallatoms benötigt wird. Beispiele für Liganden dieses Typs sind der Clorido- oder Cyanat-Ligand. Handelt es sich bei dem Liganden dagegen um eine Lewis-Säure, so wird er als Z-Typ-Ligand eingestuft. Hierbei handelt es sich um Elektronenmangelverbindungen wie AlCl3 oder BR3, sodass vom Metallatom zwei Elektronen für die Bindung gestellt werden müssen.[1]
In der metallorganischen Chemie werden Liganden seit jeher eingesetzt, um aktive Metallzentren stabil in Lösung zu halten und sie daran zu hindern, zu metallischen Kolloiden (Nanopartikeln) zu agglomerieren. Diese löslichen Metallkomplexe können durch geeignete Wahl der elektronischen und sterischen Eigenschaften der Liganden zu hochaktiven Katalysatoren für die homogene Katalyse optimiert werden.
Siehe auch
Weblinks
Einzelnachweise
- James E. Huheey, Ellen A. Keiter, Richard L. Keiter: Anorganische Chemie. Hrsg.: Ralf Steudel. 5. Auflage. de Gruyter, Berlin/Boston 2014, ISBN 978-3-11-030433-6, 11.5, S. 450–451.