Tuberkulose
Die Tuberkulose (kurz Tb oder Tbc; so benannt von dem Würzburger Kliniker Johann Lukas Schönlein wegen des charakteristischen histopathologischen Bildes, von lateinisch Tuberculosis, von lateinisch tuberculum ‚kleine Geschwulst‘) ist eine weltweit verbreitete bakterielle Infektionskrankheit. Die Erkrankung wird durch verschiedene Arten von Mykobakterien (Mycobacterium-tuberculosis-Komplex) verursacht und befällt beim Menschen als Lungentuberkulose am häufigsten die Lunge, bei Immundefekt zeigt sich vermehrt auch ein Befall außerhalb der Lunge.
| Klassifikation nach ICD-10 | |
|---|---|
| A15 | Tuberkulose der Atmungsorgane, bakteriologisch oder histologisch gesichert |
| A16 | Tuberkulose der Atmungsorgane, weder bakteriologisch noch histologisch gesichert |
| A17 | Tuberkulose des Nervensystems |
| A18 | Tuberkulose sonstiger Organe |
| A19 | Miliartuberkulose |
| ICD-10 online (WHO-Version 2019) | |
Die Tuberkulose, an der weltweit etwa 10 Millionen Menschen pro Jahr erkranken, führt die weltweite Statistik der tödlichen Infektionskrankheiten an. Nach dem Global tuberculosis report der Weltgesundheitsorganisation (WHO) starben 2015 etwa 1,4 Millionen Menschen an Tuberkulose. Dazu kamen noch 400.000 Todesfälle von zusätzlich[1] HIV-Infizierten.[2] Tuberkulose wird (zumindest heutzutage in Deutschland) am häufigsten durch Mycobacterium tuberculosis verursacht, seltener – in absteigender Folge – durch Mycobacterium bovis, Mycobacterium africanum oder Mycobacterium microti.
Die Beschreibung des Erregers Mycobacterium tuberculosis durch Robert Koch war 1882 ein Meilenstein der Medizingeschichte.[3] Die Tuberkulose wird deshalb auch Morbus Koch genannt. Die Bezeichnungen Schwindsucht (Phthisis bzw. Phthise) oder umgangssprachlich die Motten, Weiße Pest und Weißer Tod[4] sind veraltet, ebenso wie die Termini Lungendärre, Darre und Dörre.[5][6]
Nur etwa fünf bis zehn Prozent der mit Mycobacterium tuberculosis Infizierten erkranken tatsächlich im Laufe ihres Lebens, betroffen sind besonders Menschen mit geschwächtem Immunsystem oder genetisch bedingter Anfälligkeit. Die Übertragung erfolgt in der Regel durch Tröpfcheninfektion von erkrankten Menschen in der Umgebung. Sind Keime im Auswurf (Sputum) nachweisbar, spricht man von offener Tuberkulose, bei Keimnachweis in anderen äußeren Körpersekreten von potentiell offener Tuberkulose. Durch tiefes Ausatmen[7] oder Husten entsteht ein infektiöses Aerosol, das seine Ansteckungsfähigkeit durch Sedimentation, Durchlüftung und natürliche UV-Lichtquellen verliert. Da Rinder ebenfalls an der Tuberkulose erkranken können, war in Westeuropa früher (nicht-pasteurisierte) Rohmilch eine verbreitete Infektionsquelle und ist es in Teilen der Welt bis heute.[8] Aufgrund der Übertragbarkeit von Tieren auf Menschen zählt die Tuberkulose zu den Zoonosen. Umgekehrt ist die Übertragung von Menschen auf Tiere ein wichtiger Aspekt beim Artenschutz seltener Primaten.
Erst mit dem direkten Nachweis der Erreger oder deren Erbgut ist die Erkrankung labordiagnostisch bestätigt. Indirekte, d. h. immunologische Befunde oder Hauttests tragen nur zur Diagnose bei, da man durch sie nicht zwischen einer Erkrankung und einer stattgehabten Infektion unterscheiden kann. Auch können sie bei einer zusammengebrochenen Immunabwehr falsch-negativ ausfallen.
Zur Behandlung stehen verschiedene Antibiotika zur Verfügung, die speziell gegen Mykobakterien wirksam sind und deshalb auch Antituberkulotika genannt werden. Diese müssen zur Vermeidung von Resistenzentwicklungen und Rückfällen unbedingt in Kombination und nach Vorgabe der WHO über mindestens ein halbes Jahr, also weit über das Bestehen der Beschwerden hinaus, eingenommen werden. Es existiert eine Impfung, die aber wegen unzureichender Wirksamkeit in Deutschland seit 1998 nicht mehr empfohlen und auch nicht mehr verfügbar ist. Eine Primärprophylaxe mit einem antituberkulös wirksamen Medikament wird in Deutschland in erster Linie bei Kindern oder schwerst immunologisch beeinträchtigten Kontaktpersonen empfohlen. Bei Erwachsenen, die über ein intaktes Immunsystem verfügen (und daher als immunkompetent bezeichnet werden), erfolgt hingegen eine Sekundärprophylaxe oder Prävention erst nach Feststellung einer Infektion mittels vorbeugender Gabe von antituberkulös wirksamen Medikamenten unter Beachtung der Resistenzlage. Die Tuberkulose unterliegt in der Europäischen Union und im größten Teil der Welt der namentlichen Meldepflicht.
Epidemiologie und gesundheitspolitische Bedeutung
Weltweit
Etwa ein Drittel der Weltbevölkerung ist mit Tuberkuloseerregern infiziert. Nur ein geringer Teil der Infektionen führt jedoch zu einer Erkrankung. Nach dem Tuberkulosebericht der WHO (Global tuberculosis report 2016) gab es im Jahr 2015 weltweit 10,4 Millionen Neuinfektionen und 1,8 Millionen Todesfälle. Beide Zahlen sanken seit 1990 stetig.[9]
Die Möglichkeiten zur Behandlung sind oft unzureichend, da sie teure Antibiotika erfordert, lang dauert und angesichts der sozialen Lebensumstände der Betroffenen oft undurchführbar ist. Auch fehlen in betroffenen Regionen oft Laboratorien zur Diagnose und Behandlung. Besonders in Osteuropa ist durch Armut und Mängel im Gesundheitswesen eine besorgniserregende Zunahme der Tuberkulose zu verzeichnen, vor allem auch mit multiresistenten Erregerstämmen. Auch weltweit wird die Krankheit immer häufiger durch solche medikamentenresistenten Tuberkulosestämme verursacht.
Besonders problematisch ist eine Tuberkuloseinfektion bei HIV-Infizierten mit manifestem AIDS. Durch die Immunschwäche erhöht HIV die Wahrscheinlichkeit des Ausbruchs einer Tuberkuloseerkrankung um ein Vielfaches. Tuberkulose ist in Afrika neben AIDS die häufigste Todesursache. Beide Krankheiten treten besonders bei Bewohnern von Metropolenslums in enger Wechselbeziehung zueinander auf. Dabei führt die Immunschwäche durch HIV oft zu negativen Ergebnissen bei Tuberkulose-Routineuntersuchungen, obwohl die Krankheit vorliegt (siehe auch Fehler 1. und 2. Art). Das liegt daran, dass die Hauttests (Tuberkulin-Test, Tine-Test) die immunologische Reaktion auf Erregerbestandteile prüfen, die aber durch AIDS gehemmt ist. Der Verlauf der Tuberkulose ist dann erheblich beschleunigt. In armen Ländern gilt TBC als Zeichen des Ausbruchs von AIDS und führt bei der Mehrheit aller HIV-Erkrankten zum Tod. Die WHO fordert und fördert daher eine weltweite Koordination der Tuberkulose- und AIDS-Forschung.
Überraschend fand eine italienische Studie eine Prävalenz (Krankheitshäufigkeit) latenter Tuberkuloseinfektionen von neun Prozent unter gesunden Angestellten im Gesundheitsbereich und von 18 Prozent unter gut 400 an Psoriasis Erkrankten. Auch 30 Prozent der Kranken mit Lungenentzündung und Lungenkrebs waren latent infiziert.[10]
Deutschland, Österreich und Schweiz
Dem Robert Koch-Institut (RKI) wurden 2016 in Deutschland 5915 Tuberkulosekranke gemeldet,[11] darunter 233 Kinder unter 15 Jahren (2005: 230). 2016 kamen in Deutschland 7,2 Erkrankungen auf 100.000 Einwohner. Die offizielle Statistik gab für 2015 100 Todesopfer an. Die Daten dürften nicht ganz den realen Zahlen entsprechen, da die Dunkelziffer bei dieser Krankheit wegen ihrer unspezifischen Symptome relativ hoch ist. Nach einer Pathologiestudie aus Deutschland war die Diagnose bei lediglich einem Drittel der postmortal diagnostizierten Tuberkulosen zu Lebenszeiten gestellt worden.
In Deutschland ist die Krankheit besonders in Hamburg, Bremen und Berlin verbreitet. Bei im Lande geborenen Erkrankten überwiegen die älteren Jahrgänge aufgrund Aktivierungs- und Reaktivierungsneigung infolge der abnehmenden Immunabwehr. Unter den Migranten überwiegen die mittleren Jahrgänge, da hier eher frische Infektionen erkrankungsauslösend sind. Die vorläufige Tuberkulosestatistik für 2017 zeigt in Deutschland ein Plateau auf der Höhe von 2016 an, nachdem ein Anstieg der Erkrankungen an Tuberkulose, bedingt durch erhöhte Zuwanderung im Herbst 2015 zu verzeichnen war. In der Schweiz und in Österreich haben die Fallzahlen bis 2017 ebenfalls leicht abgenommen. Ein befürchteter stärkerer Anstieg der Fallzahlen durch die Migrationswelle von 2017 ist bislang demnach ausgeblieben.
In Österreich wurden im Jahr 2015 583 Erkrankungen an Tuberkulose erfasst, die Schweiz verzeichnete im gleichen Jahr 546 Erkrankungen.
In der folgenden Tabelle sind die Neuerkrankungen pro 100.000 Einwohner (Inzidenz) und die Neuerkrankungszahlen pro Jahr in Deutschland (D), der Schweiz (CH) und Österreich (A) aufgeführt.[12][13][14][15][16][17][18][19][20]
| Jahr | Inzidenz D | Gemeldete Fälle (Neuerkrankungen) D | Inzidenz CH | Gemeldete Fälle (Neuerkrankungen) CH | Inzidenz A | Gemeldete Fälle (Neuerkrankungen) A | Inzidenz DDR |
|---|---|---|---|---|---|---|---|
| 1940 | 156,8 | 109.508 (Reichsgebiet) | ca. 100 | 3.127 | nur Zahlen für das Reichsgebiet | ||
| 1950 | 277 | 137.721 (nur BRD) | 68,1 | ca. 8200 | ca. 500 | ||
| 1960 | 126,6 | 70.325 (nur BRD) | ca. 40 | ca. 4600 | ca. 210 | ||
| 1970 | 79,3 | 48.262 (nur BRD) | ca. 25 | 2.850 * | ca. 80 | ||
| 1980 | 42,1 | 27.845 (nur BRD) | ca. 20 | 1.396 | 2.191 * | ||
| 1990 | 19,6 | 12.184 (nur BRD) | 18,4 | 1.278 | 20,4 | 1.521 * | |
| 2000 | 11,0 | 9.064 | 8,7 | 629 | 15,3 | 1.226 | |
| 2006 | 6,5 | 5.402 | 6,9 | 520 | 10,8 | 894 | |
| 2007 | 6,1 | 5.020 | 6,3 | 478 | 10,7 | 891 | |
| 2008 | 5,5 | 4.543 | 6,7 | 520 | 9,9 | 817 | |
| 2009 | 5,4 | 4.444 | 7,1 | 556 | 8,4 | 697 | |
| 2010 | 5,4 | 4.388 | 6,9 | 548 | 8,2 | 688 | |
| 2011 | 5,3 | 4.317 | 7,1 | 577 | 8,2 | 687 | |
| 2012 | 5,2 | 4.220 | 5,7 | 463 | 7,7 | 648 | |
| 2013 | 5,3 | 4.318 | 6,5 | 526 | 7,7 | 649 | |
| 2014 | 5,6 | 4.488 | 5,7 | 473 | 6,8 | 582 | |
| 2015 | 7,3 | 5.865 | 6,4 | 546 | 6,7 | 583 | |
| 2016 | 7,2 | 5.915 | 7,2 | 611 | 7,2 | 634 | |
| 2017 | 6,5 | 5.486 | 6,3 | 534 | 6,4 | 569 | |
| 2018 | 6,5 | 5.513 | 5,9 | 509 | 5,5 | 481 | |
| 2019 | 5,8 | 4.791 | 5 | 431 | 5,3 | 474 | |
| 2020 | 5,0 | 4.127 | 4,2 | 374 | 4,3 | 388 | |
| 2021 | 4,2** | 292** |
* nur ansteckungsfähige ** Vorläufige Zahlen
Erreger der Tuberkulose
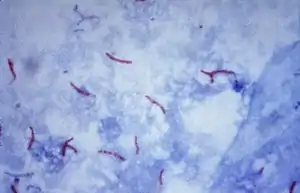
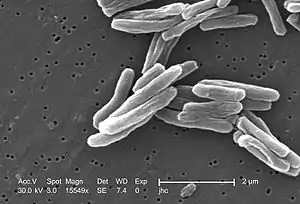
Der wichtigste Erreger der Tuberkulose, Mycobacterium tuberculosis, ist ein aerobes grampositives Stäbchen-Bakterium, das sich alle 16 bis 20 Stunden teilt. Verglichen mit anderen Bakterien, die Teilungsraten im Bereich von Minuten haben, ist dies extrem langsam. Der mikroskopische Nachweis gelingt durch die typischen Färbeeigenschaften: Das Bakterium behält seine Färbung nach Behandlung mit einer sauren Lösung und wird deshalb als säurefestes Stäbchen bezeichnet. In der gebräuchlichsten Färbung dieser Art, der Ziehl-Neelsen-Färbung, heben sich die rot eingefärbten Keime vor einem blauen Hintergrund ab. Der Nachweis gelingt weiterhin durch Fluoreszenzmikroskopie und durch die Auramin-Rhodamin-Färbung. In der Gram-Färbung stellen sich Mykobakterien kaum dar, der Aufbau des Peptidoglycans ähnelt jedoch stark dem grampositiver Bakterien, so dass M. tuberculosis formal als grampositiv klassifiziert wird. Dies wurde durch Sequenzanalysen der RNA bestätigt.
Zur gleichen Bakteriengruppe gehören weitere Mykobakterien, die ebenfalls zu den Erregern der Tuberkulose gezählt werden: M. bovis, M. africanum und M. microti. Diese Erreger werden in Deutschland nur sporadisch bei tuberkulösen Erkrankungen gefunden. M. kansasii und auch M. avium können in seltenen Fällen, wie eine Reihe weiterer Mykobakterien, tuberkuloseähnliche Krankheitsbilder verursachen. Eine Ansteckungsgefahr geht jedoch von atypischen Mykobakterien (mycobacteria other than tuberculosis, MOTT) in der Regel nicht aus.
M. tuberculosis, M. bovis, M. africanum, M. microti, M. canetti, M. pinnipedi, M. caprae und der Impfstamm Bacillus Calmette-Guérin (BCG) werden zusammengefasst als Mycobacterium tuberculosis complex.
Übertragungswege
Einatmung infektiöser Tröpfchen (Aerosole) stellt den häufigsten und somit wichtigsten Übertragungsweg dar: Für eine Infektion genügt hierbei die Inhalation einiger Mikrotröpfchen (2–5 µm Durchmesser), die jeweils 1–3 Erreger enthalten.[21][22] Weitaus seltener ist die Übertragung über den Blutweg, durch Organtransplantationen oder über andere Körpersekrete. Prinzipiell ist jeder der folgenden Übertragungswege möglich und in der Literatur als gesichert beschrieben:
- aerogen, das heißt über Mikrotröpfchen in der Luft, die den Erreger Mycobacterium tuberculosis enthalten, mit den Eintrittspforten Lungenbläschen, offene Wunden, frische Tätowierungen und Schleimhäute
- gastral durch die Ingestion mykobakterienhaltiger Nahrungsmittel (Milch, rohes Fleisch etc.)
- parenteral über blut- und sekretkontaminierte diagnostische und therapeutische Instrumente (Transfusionen, Spritzen, Nadeln, Skalpelle, Lanzetten, Biopsienadeln, Endoskope etc.)
- transplantationsbedingt durch heterogene Verpflanzungen von infiziertem Gewebe (Nieren etc.)
- sexuell (nur wenn Geschlechtsorgane betroffen sind)
- durch Schmierinfektionen auf die nichtintakte Haut (Rhagaden, Ekzeme oder Verletzungen)
- intrauterin bei Infektionen der Gebärmutter
- sub partu (während der Geburt) infolge einer Urogenitaltuberkulose der Mutter
Wiederholt nachgewiesen wurde der Befall von Kakerlaken und deren Kot mit Mycobacterium tuberculosis. Dieser Umstand wird regelmäßig von Schädlingsbekämpfern angeführt. Eine Sichtung der Literatur brachte keinen einzigen gesicherten Übertragungsfall.
Ausscheidungstuberkulose ist ein nicht mehr gebräuchlicher medizinischer Begriff für jene Formen der Tuberkulose, bei denen die Krankheitserreger über die Ausscheidungsorgane im Körper verbreitet werden und zu einem sekundären Befall anderer Organe führen.
Die aerogenen Infektionen gehen meist von Erwachsenen aus, da bei Kindern selbst bei offener Lungentuberkulose die ausgeschiedene Bakterienmenge zu gering ist (paucibacilläre = erregerarme Tuberkulose). Organbeteiligungen außerhalb der Lungen stellen mit Ausnahme der hochkontagiösen Kehlkopftuberkulose (Larynxtuberkulose) nur dann ein Infektionsrisiko dar, wenn die Infektionsherde durch natürliche Wege (Magen-Darm-Trakt) oder Fistelbildung mit dem Körperäußeren verbunden sind[15] oder es bei diagnostischen Punktionen/Eingriffen zu Nadelstichverletzungen oder Kontakt zu Wunden kommt. Eine historisch bedeutsame, heute fast vergessene Sonderform stellten die Leichentuberkel (engl. prosectors wart) dar, wobei sich Anatomen, Pathologen, Schlachter etc. über Handwunden erneut infizieren. Auch eine Infektion durch infizierte Milch ist möglich. Solche Infektionen sind in Industrieländern, wo die Rinderbestände weitgehend tuberkulosefrei sind und die Milch pasteurisiert wird, jedoch inzwischen sehr selten geworden. Neugeborene von Müttern mit Lungentuberkulose stecken sich nur selten über die Blutbahn an. Hat die Tuberkulose-Infektion allerdings den Mutterkuchen (Plazenta) ergriffen, kann sich das Kind durch das Verschlucken bakterienhaltigen Fruchtwassers infizieren. Wenn bei der Mutter die ableitenden Harnwege und damit verbunden die Geschlechtsorgane befallen sind, kann sich das Neugeborene bei der Geburt anstecken.[23]
Immunologie und Pathologie
_TBLB.jpg.webp)
Nach der Infektion werden die Erreger in den meisten Fällen schon in den Atemwegen abgewehrt. Von allen Infizierten erkrankt nur etwa ein Zehntel tatsächlich an Tuberkulose. Ob ein Organismus sich ausreichend gegen die Mykobakterien wehren kann, hängt von vielen Faktoren ab. Wichtig sind der Ernährungszustand, eine genetische Disposition (es gibt etwa 20 bekannte Genpolymorphismen, die das Erkrankungsrisiko bis auf den Faktor 5 steigern) sowie eine medikamentöse, infektbedingte oder toxische Unterdrückung der Immunabwehr, aber auch die Menge der aufgenommenen Bakterien und die Häufigkeit des Kontaktes. Auch die Größe und Durchlüftung eines Raumes und das Fehlen von UV-Lichtquellen können als Faktoren eine Rolle spielen.
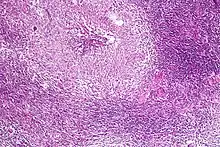
Ein erstes Abwehrbollwerk stellen spezialisierte Fresszellen (Alveolarmakrophagen) in den Lungenbläschen dar. Diese können die Erreger zwar in ihr Zellinneres aufnehmen (phagozytieren), dann aber nicht abtöten. Auch weitere herbeigerufene Fresszellen sind dazu nicht in der Lage. Der Vorgang der Phagozytose wird durch verschiedene Stoffe an der Oberfläche von Krankheitserregern aktiviert. Das können zum einen Bestandteile der Zellwand, aber auch Moleküle des Wirts sein, die sich an die Zellwand des Eindringlings gebunden haben. Mykobakterien verhindern, dass die Zellbestandteile der Fresszellen, in denen sie sich befinden, die so genannten Phagosomen, weiter reifen. Dies sichert das Überleben von Mycobacterium tuberculosis. Das Immunsystem bildet deshalb um den anfänglichen Infektionsherd einen Wall aus mehreren Ringen verschiedener Abwehrzellen. Dieser Abwehrwall aus Fresszellen (Makrophagen), so genannten Epitheloidzellen, Langhans-Riesenzellen und Lymphozyten formiert sich um einen zentralen Entzündungsherd mit Gewebsuntergang (Nekrose). Diese besondere Form der Nekrose, die auch pathognomonisch für die TBC ist, wird Verkäsende Nekrose genannt. Das gesamte Gebilde wird als tuberkulöses Granulom (oder Tuberkulom[24]) bezeichnet. Es isoliert Mycobacterium tuberculosis am Ort des Eindringens und verhindert eine Weiterverbreitung. Dazu ist ein funktionierendes Zusammenspiel der verschiedenen Abwehrzellen erforderlich, die sich gegenseitig über verschiedene Botenstoffe (Zytokine) herbeirufen und aktivieren. Insbesondere die Ausschüttung von Tumornekrosefaktor sorgt für nitrosativen Stress im Phagosom, der zusammen mit der Einkapselung das Bakterium zwingt, in einen Ruhezustand überzugehen.[25]
Die Mykobakterien wiederum reagieren auf die Abkapselung mit einer Veränderung ihres Aktivitätszustandes. Seit der Entschlüsselung des Genoms der wichtigsten Mykobakterienstämme 1998[26] sind verschiedene Mechanismen hierzu entdeckt worden. Sie sind dabei in der Lage, ihren Stoffwechsel im Granulom vorübergehend einzustellen oder so umzustellen, dass sie die hier vorkommenden Fette verstoffwechseln und dadurch besonders wenig Sauerstoff benötigen. Sie befinden sich nun im Stadium der Dormanz, d. h., sie teilen sich noch seltener. Aus dieser schlummernden Primärinfektion kann durch erneuten Übergang in einen aktiven Zustand eine (postprimäre) aktive Tuberkulose entstehen. Da eine solche aber auch nachgewiesenermaßen durch eine (exogene) Reinfektion (exogene Neuherdsetzung[27]) entstehen kann, muss man davon ausgehen, dass eine vorangegangene Infektion keinen ausreichenden Schutz vor dem Ausbruch der Erkrankung bei erneutem Kontakt darstellt. Dies macht deutlich, warum es so schwierig ist, einen wirksamen Impfstoff gegen Tuberkulose zu entwickeln.[28]
Symptome
Grundsätzlich wird der Erkrankungsverlauf bei der Tuberkulose in verschiedene Stadien eingeteilt. Krankheitszeichen, die sich direkt nach der Infektion manifestieren, werden als Primärtuberkulose bezeichnet. Da die Bakterien aber auch bei intakter Immunabwehr ohne Krankheitszeichen oder nach durchgemachter Primärtuberkulose lebenslang im Körper schlummern und jederzeit wieder reaktiviert werden können, spricht man bei einer nicht zur Erkrankung führenden Erstinfektion von einer latenten Tuberkuloseinfektion (LTBI) bzw. nach einer Ersterkrankung von einer postprimären Tuberkulose oder auch Sekundärtuberkulose. Da sich die Infektion zwar zumeist an der Lunge, aber eben prinzipiell auch an jedem anderen Organ abspielen kann, wird außerdem die Lungentuberkulose von der Organtuberkulose unterschieden.
Primärtuberkulose, geschlossene Tuberkulose, Frühform
Nach der Ansteckung über infizierte Tröpfchen bilden sich als Reaktion auf die Bakterien in den folgenden drei bis sechs Wochen in der Lunge der betroffenen Person kleine Entzündungen mit Beteiligung des zugehörigen Lymphknotens (Primärkomplex). Die Entzündungsherde (Frühinfiltrate) werden von Blutabwehrzellen eingeschlossen. Es bilden sich kleine Knötchen (Tuberkel). So abgekapselt verursachen die Tuberkuloseherde keine Beschwerden und haben in der Regel auch keinen Anschluss an die Atemwege (das Bronchialsystem). Man spricht bei dieser Primärtuberkulose (früher auch Primärherdphthise oder Erstherdtuberkulose[29]) von einer geschlossenen Tuberkulose, die definitionsgemäß nicht ansteckend ist, da keine Krankheitserreger ausgeschieden werden. Die Mykobakterien können aber jahrelang im Körper überleben.
Ist das infizierte Individuum nicht in der Lage, die Erreger auf diese Weise abzukapseln, kann aber auch eine aktive Infektion mit meist uncharakteristischen Symptomen (B-Symptomatik) auftreten, weil sich die Erreger immer weiter ausbreiten. Dazu können Müdigkeit und Schwäche, Appetitlosigkeit und Gewichtsabnahme, geschwollene Lymphknoten, leichtes Fieber, besonders in den Nachmittagsstunden, Nachtschweiß und ständiges Hüsteln ohne viel Auswurf gehören. Heiserkeit kann ein Hinweis auf eine Kehlkopfbeteiligung mit erhöhter Ansteckungsgefährdung sein. Bei kräftigen Erkrankten können diese Symptome trotz Ansteckungsgefahr schwach ausgeprägt sein und mitunter fehlen. Durch Bildung von Exsudat im Rahmen einer Infektion der Pleura kann es bei der Tuberkulose auch zur Entstehung eines Pleuraergusses kommen (Der pH-Wert der Pleuraflüssigkeit zeigt dann eine Azidose).[30] Schwere Verläufe mit blutigem Auswurf (Hämoptoe), starker Blutarmut und Untergewicht sind auch in Mitteleuropa nicht rar. Die Zahl der Todesfälle an Tuberkulose ist in den letzten Jahrzehnten weit weniger abgeflacht als die Zahl der gesamten Erkrankungsfälle. Seit den 1980er Jahren zeigte sich vor allem ein Rückgang der leichteren geschlossenen Formen.[31]
Kommt es bei geschwächten Personen zu einer Aussaat der Mykobakterien über die Blutbahn mit Beteiligung beider Lungenhälften und vieler Organe gleichzeitig, spricht man von einer Miliartuberkulose. Sie ist nach der im Röntgenbild sich darstellenden miliaren (hirsekornartigen, von lateinisch milium „Hirse, Hirsekorn“) Aussaat[32] (Metastasierung) benannt und stellt sich als schweres Krankheitsbild mit erheblicher Beeinträchtigung des Allgemeinzustandes, Fieber, Appetitlosigkeit, Gewichtsverlust, Husten und Luftnot dar. Auch eine Hirnhautentzündung (tuberkulöse Meningitis) kann auf diesem Weg entstehen. Diese zeigt sich zunächst in uncharakteristischen Symptomen wie Irritabilität und Wesensveränderung. Später kann es zu meningitischen Zeichen mit Kopfschmerzen, Nackensteifheit, Halluzinationen, Bewusstseinsstörungen, Krampfanfällen sowie Fieber, also einer schweren Beeinträchtigung des Allgemeinzustandes kommen. Unbehandelt führt sie zu Koma und Tod. Es können zudem Tuberkel der Aderhaut (Chorioidaltuberkel) auftreten.[33] Bei extremer Abwehrschwäche kann es zu einer fulminanten Sepsis mit in der Regel tödlichem Ausgang kommen, die vielfach als Landouzy-Sepsis bezeichnet wird.
Postprimäre Tuberkulose, sekundäre Tuberkulose
Bei mindestens zehn Prozent der Menschen, die sich mit Tuberkulose angesteckt haben, bricht die Krankheit zu einem späteren Zeitpunkt als sekundäre Tuberkulose aus.[31] Die Patienten klagen dann oft über verschiedene Symptome: über Wochen anhaltender Husten mit Abhusten von gelblich-grünem Schleim, Abgeschlagenheit, Müdigkeit, subfebrile Temperaturen zum Abend hin und Nachtschweiß. Beim Husten können Schmerzen in der Brust auftreten und es kann zu Atemnot kommen. Blutiger Auswurf kann Ausdruck einer Arrosion der Bronchien oder der Luftröhrenschleimhaut sein (Bronchialtuberkulose, Trachealschleimhauttuberkulose[34]), oft liegt dann bereits eine offene ansteckungsfähige Erkrankung vor. Blutiger Auswurf sollte daher umgehend ärztlich abgeklärt werden.
Die Tuberkulose-Bakterien vermehren sich in der Lunge und zerstören das Gewebe. Das zerstörte Gewebe bekommt bei Arrosion kleinerer oder mittlerer Äste des Bronchialbaumes Anschluss an die Atemwege und wird dann ausgehustet. Der Auswurf enthält jetzt Bakterien – der Patient leidet an offener Tuberkulose. Im fortgeschrittenen Stadium können durch Aussaat der Bakterien über die Blutbahn (hämatogene Streuung) weitere Organe befallen werden. Dann treten beispielsweise schmerzhafte Schwellungen an Knie- und anderen Gelenken (Poncet-Krankheit oder Morbus Poncet, benannt nach dem Chirurgen Antonin Poncet, der das tuberkulöse Rheumatoid[35] bzw. den Rheumatismus tuberculosus 1897[36] beschrieben hatte[37]) oder der Wirbelsäule auf (Gelenktuberkulose, Knochentuberkulose[38]). Eine Sonderform der Tuberkulose ist die in Mitteleuropa früher unter anderem als durch Trinken von roher Milch und der damit verbundenen Infektion mit Mycobacterium bovis[39] angesehene, inzwischen sehr selten gewordene Hauttuberkulose (Lupus vulgaris). Nicht abheilende kleine Wunden, Risse, warzenartige Eiterherde und umschriebene Geschwüre sind u. a. typische Symptome der Hauttuberkulose.
Organtuberkulose, extrapulmonale Tuberkulose
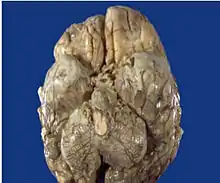

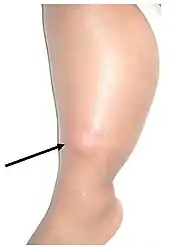
Neben der Beteiligung der Lunge, die mit etwa 80 % das mit Abstand am häufigsten betroffene Organ ist, kann sich die Tuberkulose auch in zahlreichen anderen Organen manifestieren. Diese Organtuberkulose (früher auch Organphthise genannt) kann entweder durch primäre Infektion an anderen Eintrittspforten als den Atemwegen oder aber durch Streuung über die Blutbahn im Rahmen der Primärtuberkulose der Lungen entstehen. Hiervon sind wiederum die Lymphknoten (Lymphknotentuberkulose) am häufigsten betroffen.
- Eine Hauttuberkulose (Skrophuloderm, vgl. Skrophulose) kann entstehen, wenn bei den käsigen Gewebsuntergängen (Nekrosen), wie sie für die Tuberkulose typisch sind, eine Tendenz zur Einschmelzung besteht.
- Vorkommen kann auch eine Tuberkulose von Muskeln und Sehnenscheiden.[40]
- Häufig ist die untere Brust- und Lendenwirbelsäule befallen und es kommt durch die Entzündung zu einer Aufweichung und Deformation mit Gibbus-Bildung (sogenannter Morbus Pott).[41][42] Früher war die Differenzialdiagnose zur Rachitis häufig schwierig zu stellen. Diese Manifestationsform kann zur Bildung eines Abszesses im Bereich des Psoasmuskels führen. Die Lokalisation in der Nähe des Rückenmarks und der dort austretenden Nervenbahnen macht sich klinisch häufig in Form von neurologischen Ausfällen oder neuropathischen, oft in die Beine und ins Gesäß ausstrahlenden Schmerzen bemerkbar.
- Die Tuberkulose des Gehirns oder der Hirnhäute (tuberkulöse Meningitis, Meningitis tuberculosa[43]) kann mit den heutigen bildgebenden Verfahren dargestellt werden. Sie kann mikrobiologisch durch eine Lumbalpunktion gesichert werden. Sie betrifft meistens die basalen (unteren) Abschnitte des Gehirns und führt klinisch oft zu Schädigungen der dort austretenden Hirnnerven.
- Eine Beteiligung der Nieren, Nebennieren, der Harnwege und des Genitaltraktes wird Nierentuberkulose, Genitaltuberkulose[44] bzw. Urogenitaltuberkulose genannt und entsteht meist auf dem Blutweg.
- Die Knochentuberkulose (mit Knochenfraß, genannt auch Knochenkaries[45]) ist eine insgesamt seltene Manifestationsform, die auf dem Blutweg entsteht.
- Die Darmtuberkulose ist sehr selten geworden, entsteht sie doch zumeist durch eine primäre Infektion mit Mycobacterium bovis in infizierter Milch.
- Bei der Kehlkopftuberkulose (Larynxtuberkulose) handelt es sich um eine hochansteckende Komplikation der (offenen) Lungentuberkulose.[46]
- Eine seltene Manifestation ist die Tuberkulose der Zähne, der Mundschleimhaut und der Zunge, die zumeist durch bronchogene Streuung bei vorbestehenden Läsionen entstehen kann. Orale Befunde können Zahngranulome, Geschwüre des Zahnfleisches und der Mundschleimhaut sowie eine Vergrößerung der Zunge sein. Bei etwa 1,4 % der an Tuberkulose Erkrankten findet sich nach Studien eine orale Beteiligung. Eine orale Tuberkulose kann auch isoliert vorkommen.[47]
Diagnostik
Zur Diagnosestellung tragen die Erhebung der Infektionsanamnese, eine Tuberkulin-Hauttestung, ein Interferon-γ-Bluttest, Gewebsuntersuchungen, eine bildgebende Diagnostik und wenn irgend möglich der kulturelle Erregernachweis bei. Die Diagnose gilt nur dann als gesichert, wenn die Falldefinitionen, in Deutschland die des Robert Koch-Institutes, erfüllt sind, zum Beispiel wenn neben dem klinischen Bild ein kultureller Erregernachweis von Mycobacterium tuberculosis vorliegt.[48] Diese Methoden können bei speziellen Fragestellungen durch moderne molekularbiologische oder immunologische Testverfahren ergänzt werden. Eine sichere Diagnose wird jedoch durch die höchst unterschiedliche Präsentation erschwert.[49]
Tuberkulin-Hauttestung
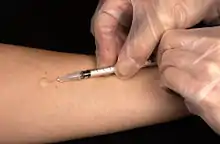
Beim Tuberkulin-Hauttest (auch Mendel-Mantoux-Test genannt) wird eine definierte Menge gereinigter und filtrierter Antigene aus Mykobakterien (Tuberkulin) in die Oberhaut (Epidermis) gespritzt. Ebenfalls gebräuchliche Stempeltests sind sehr unzuverlässig und daher nicht empfehlenswert. Hat das Immunsystem des getesteten Menschen schon einmal Kontakt mit Mykobakterien gehabt, tritt an der entsprechenden Stelle innerhalb von drei Tagen eine Abwehrreaktion mit Einwanderung von Abwehrzellen in die Haut ein, die zu einer Verdickung führt. Es handelt sich hier um eine Typ IV Reaktion (nach COOMBS). Bereits sechs Wochen nach einer Infektion mit TBC wird der Test positiv.
Eine tastbare Verhärtung an der Teststelle bezeichnet man als positive Reaktion. Dies kann bedeuten, dass eine Tuberkulose-Infektion stattgefunden hat. Über eine Erkrankung sagt der Test allerdings nichts aus. Auch nach einer Tuberkulose-Schutzimpfung ist eine positive Testreaktion möglich. Bleibt die Haut an der Teststelle unverändert oder zeigt sich nur eine Rötung, wird dies als negativ bewertet. Eine Tuberkulose-Infektion ist dann mit hoher Wahrscheinlichkeit ausgeschlossen.
Der Tuberkulin-Test ist ungefährlich und gut verträglich. Er kann auch bei Schwangeren, stillenden Müttern oder Kleinkindern ohne Bedenken durchgeführt werden.
Tuberkulin-Tests sind nur eingeschränkt verlässlich. Einerseits können sie gerade bei schweren Verläufen, wie einer Miliartuberkulose, negativ bleiben. Andererseits führen eine frühere Impfung oder ein Kontakt zu atypischen Mykobakterien (mycobacteria other than tuberculosis, MOTT) zu einer falsch positiven Reaktion.
Bildgebung
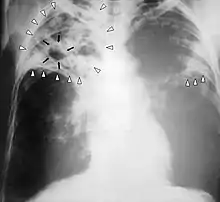
Besteht aufgrund von Symptomen und Vorgeschichte der Verdacht auf eine Tuberkulose, so sind auch bei negativem Tuberkulin-Test die Röntgenuntersuchung oder bei besonderen Fragestellungen die CT der Lunge gut brauchbare bildgebende Untersuchungsverfahren. Sie lassen oft das charakteristische, mottenfraßartige Bild des Lungenbefalls der Tuberkulose erkennen, welches der Erkrankung auch den Beinamen die Motten eingebracht hat. Auch bei geschlossener Tuberkulose zeigen diese Untersuchungen einen Befund. Nachteilig ist aber, dass auf einem Röntgenbild oft nicht ausreichend sicher zwischen einer Tuberkulose und anderen Lungenerkrankungen differenziert werden kann.
Bei Kindern unter 15 Jahren und bei Schwangeren sollte bei vermuteter Tuberkulose statt einer Röntgenuntersuchung ein immunologisches Testverfahren wie γ-Interferon-Test oder ein Tuberkulin-Hauttest bevorzugt werden.[50]
Erregernachweis

Mycobacterium-tuberculosis-Kultur
Die Diagnose der Tuberkulose ist gesichert, wenn ein kultureller Nachweis der Erreger vorliegt. Dies gelingt aber ohne weiteres nur aus dem Auswurf (Sputum) bei offener Tuberkulose, wenn also die tuberkulösen Gewebeveränderungen Anschluss an das Bronchialsystem, die ableitenden Harnwege oder den Darm haben und ausgeschieden werden können. Andernfalls kann versucht werden, Material durch Punktionen mit Nadeln oder direkt durch Entnahme von Gewebe zu gewinnen. Der Vorteil des kulturellen Nachweises liegt in der Möglichkeit, eine Resistenztestung durchführen zu können und sollte daher immer angestrebt werden, da die Behandlung dann gezielt erfolgen kann.
Da Kinder erstens kaum Auswurf haben und zweitens dabei nur wenige Bakterien hochhusten, ist eine herkömmliche Sputumuntersuchung bei ihnen kaum zuverlässig. Im Kindesalter wird deshalb der Magennüchternsaft untersucht, denn hier sammelt sich das gesamte Sekret, das die Kinder während der Nacht nach oben gehustet und anschließend verschluckt haben. Die Mykobakterien wiederum sind säurefest und im Magensaft überlebensfähig. Südafrikanische Forscher konnten nachweisen, dass der Erregernachweis auch bei Säuglingen und Kindern aus dem Sputum möglich ist. Wenn man sie zuvor mit einer hochprozentigen Salzlösung inhalieren lässt (induziertes Sputum), gelingt der Nachweis von Mykobakterien aus dem anschließend ausgehusteten Sekret mit gleicher Zuverlässigkeit wie aus dem Magensaft.[51]
Auf herkömmlichen, festen Nährböden muss man des langsamen Keimwachstums wegen auf ein Ergebnis vier bis sechs Wochen warten. In Flüssigkulturen mit modernen Nachweismethoden für ein Mykobakterien-Wachstum gelingt der Nachweis möglicherweise schon nach etwa zwei Wochen.[23] Der früher häufig verwendete Tierversuch, bei dem Meerschweinchen das zu untersuchende Material in die Bauchhöhle gespritzt bekamen, wird nicht mehr eingesetzt. Moderne Nachweismethoden schließen molekulargenetische Methoden wie die Polymerase-Kettenreaktion ein.
Immunologische Testverfahren
Als weitere Diagnosemöglichkeit steht neben dem Tuberkulin-Hauttest seit 2005 ein weiteres immunologisches Testverfahren zur Verfügung, der sogenannte γ-Interferon-Test. Dabei werden Abwehrzellen aus dem Blut der Testperson mit einer Mischung aus Antigenen von Mycobacterium tuberculosis stimuliert. Hatte der Betreffende aufgrund einer Tuberkulose-Infektion schon mit dem Erreger Kontakt, so bilden sie vermehrt den Botenstoff Interferon-γ. Die Konzentration dieses Interferon-γ kann im Zellüberstand bestimmt werden und liegt bei Blutproben infizierter Menschen deutlich über derjenigen in einer mitzuführenden Negativkontrolle. Da die gewählten Antigene nur in Mycobacterium tuberculosis vorkommen sollten, nicht aber in den meisten atypischen Mykobakterien und auch nicht in den Impfstämmen der für die BCG-Impfung verwendeten Mykobakterien, lässt sich in der Theorie bei positivem Tuberkulin-Hauttest durch dieses Verfahren zwischen einer Infektion durch Tuberkulose-Bakterien und durch atypische Mykobakterien unterscheiden. Die Sensitivität dieser Tests wird in verschiedenen Arbeiten mit 82 % bis 100 %, die Spezifität mit 98 % angegeben.[48]
Die Durchführung der Tests ist jedoch in Praxis mit Schwierigkeiten und Unsicherheiten verbunden. Das Zeitfenster für die Inkubation und auch die dabei notwendige Temperaturkonstanz von 37 °C bieten Fehlerquellen, ebenso die notwendige Erfahrung mit der Methode im Labor selbst. Die angegebenen Werte für die Sensitivität und Spezifität werden daher in der Praxis bei weitem nicht erreicht. Bei den beiden eingeführten Testen scheint der ELISPOT (speziell der T-SPOT-Test) insbesondere bei Kindern und bei extrem niedriger Anzahl von Helferzellen im Vorteil zu sein. Aber auch hier bestehen Fehlerquellen in der präanalytischen Phase.
Wie bei allen Untersuchungsmethoden, deren Sensitivität und Spezifität ja nicht 100 % beträgt, ist die Aussagekraft auch abhängig von der Häufigkeit der echten Infektion. Deshalb eignen sich auch diese In-vitro-Tests nicht zum Screening von Bevölkerungs- oder Berufsgruppen mit niedriger Durchseuchung. Bei zweifelhafter Exposition und positivem Ausfall[52] oder gesicherter enger Exposition und negativem Ausfall[53] empfiehlt sich daher eine genaue klinische Überprüfung mit der Methode nach Mendel-Mantoux und gegebenenfalls eine Wiederholung mit dem alternierenden Y-Interferontest. Auch der Zeitpunkt der Infektion ist mit den neueren In-vitro-Testverfahren nicht bestimmbar. Der Test wird häufig nach ausgeheilter Infektion in den folgenden Jahrzehnten wieder negativ. Es gibt Berichte über Störungen durch frühere BCG-Impfungen oder Boostereffekte nach vorausgegangener Testung nach Mendel-Mantoux.
2010 stellte eine britische Forschergruppe einen Test vor, der auf Änderung der Transkriptionssignatur in neutrophilen Granulozyten beruht. Durch diesen Test soll es möglich sein, eine abgelaufene von einer aktiven Infektion zu unterscheiden. Die Marktreife bleibt noch abzuwarten.[54]
Therapie
Da sich die Erreger nur sehr langsam teilen und außerdem in den tuberkulösen Granulomen lange Zeit ruhen können, ist die Gefahr der Resistenzentwicklung bei Mykobakterien besonders hoch. Bei gesicherter Tuberkulose oder auch nur hochgradigem Tuberkuloseverdacht müssen daher alle Patienten mit einer Kombinationstherapie aus mehreren, speziell gegen Mycobacterium tuberculosis wirksamen Antibiotika (auch Antituberkulotika genannten Medikamenten) behandelt werden. Außerdem muss die Behandlungsdauer, ebenfalls wegen der niedrigen Teilungsgeschwindigkeit, unbedingt ausreichend lang sein, um Rückfälle zu vermeiden.
Standardtherapie
Gemäß der Leitlinien von 2011 soll die Therapie einer unkomplizierten Tuberkulose aus einer vierfachen Kombination von Isoniazid, Rifampicin, Ethambutol und Pyrazinamid bestehen und zunächst für zwei Monate erfolgen. Anschließend muss die Behandlung für weitere vier Monate mit Isoniazid und Rifampicin fortgesetzt werden. Sie dauert also insgesamt mindestens ein halbes Jahr. Bei Kindern wird anfangs nur eine Dreifachkombination (ohne Ethambutol) eingesetzt. Dies ist in besonders leichten Fällen ausnahmsweise auch bei Erwachsenen möglich. Als Reservemedikament bei Unverträglichkeiten steht noch Streptomycin zur Verfügung. Thiacetazon, eine sechste Substanz, wird aufgrund eines ungünstigen Nebenwirkungsprofils in den Industrienationen nicht angewandt. Es wird für die Behandlung von gleichzeitig an HIV erkrankten Patienten nicht empfohlen. Allerdings ist die Mehrzahl der Tuberkulosekranken in einigen armen Ländern, wo die Substanz wegen des günstigen Preises weiterhin zum Einsatz kommt, gleichzeitig HIV-positiv.[55]
Die häufigste Nebenwirkung von Isoniazid ist eine periphere Polyneuropathie. Des Weiteren kann es wie bei Rifampicin und Pyrazinamid auch zu Leberschäden kommen. Ethambutol kann eine Entzündung des Sehnervs (Nervus opticus) hervorrufen, Streptomycin schädigt Nieren und Innenohr. Diese Organe sollten vor Beginn untersucht und im Verlauf der Therapie überwacht werden.
Da sich die Patienten oft relativ gesund fühlen, nehmen viele die Tabletten von sich aus nach gewisser Zeit nicht mehr regelmäßig ein (man spricht hier von einer niedrigen Compliance). Nachdem die Zulassung mehrerer neuer Tuberkulosemedikamente bevorsteht, wird in Mausstudien bereits erprobt, mit welcher Medikamentenkombination eine Verkürzung der Behandlungszeit möglich wäre. Mit der Kombination TMC207, Pyrazinamid und Rifapentin/Moxifloxazin konnten bei der Maus trotz Verkürzung auf zwei Monate 100 Prozent der Keime getötet werden.[56]
Sollte sich in der mikrobiologischen Bakterienkultur eine Resistenz finden, muss im Sinne einer spezifischen Therapie ein Wechsel auf andere Antibiotika ins Auge gefasst werden, gegen die der konkrete Bakterienstamm tatsächlich empfindlich ist. In Flüssigkulturen (Bactec MGIT) kann ein Wachstum von Mykobakterien bei hoher Ausgangskonzentration und ohne Vorbehandlung bereits nach einer Woche nachgewiesen werden. Ein positives Wachstum im Flüssigkultursystem allein erlaubt noch keine Artdiagnose der Mykobakterien, sie stellt jedoch die Basis für eine genaue Speziesdifferenzierung mittels weiterführender diagnostischer Methoden dar. Die parallele Bebrütung fester Nährböden (Löwenstein-Jensen- und Stonebrink-Medium) dauert meist länger, erlaubt aber eine Beurteilung der Koloniemorphologie. Das Endergebnis der Kultur liegt in der Festkultur nach max. 8–10 Wochen vor. Die konventionelle Resistenzüberprüfung der Standardmedikamente dauert mindestens zehn Tage. Es gibt mittlerweile kommerzielle Schnellteste, die mit molekularbiologischen Methoden Resistenzen früher nachweisen können. Diese neueren Methoden haben sich in der Praxis allerdings noch nicht bewährt.
Therapie der multiresistenten Tuberkulose
Bei Vorliegen von Resistenzen gegen die Standardmedikamente soll nach Austestung aller zur Verfügung stehenden Antituberkulotika die Behandlung um mindestens zwei wirksame Substanzen erweitert werden.[57] Angewandt werden Kombinationen verschiedener Wirkstoffe: Die Aminoglykoside Capreomycin und Kanamycin, die Fluorchinolone Ofloxacin/Levofloxacin, Ciprofloxacin und Moxifloxacin, die Thionamide Ethionamid, Prothionamid sowie die bakteriostatisch wirksamen Substanzen 4-Aminosalicylsäure (PAS) und Cycloserin bzw. Terizidon.
Zur Sekundärtherapie bei Resistenzen kommen auch Streptomycin, Amikacin und Protionamid in Betracht.[58]
Das Antibiotikum Linezolid galt einige Zeit als Wunderwaffe gegen multiresistente Tuberkulose und findet noch heute bei besonders schweren Fällen Anwendung. Jedoch entwickelten in einer rezenten Studie von Lee[59] 82 % der Patienten möglicherweise Linezolid-assoziierte Nebenwirkungen. Häufigste unerwünschte Wirkungen sind Myelosuppression mit Anämie und Neutropenie, optische Neuropathie und periphere Neuropathie.[60]
Die Behandlung einer multiresistenten Tuberkulose (englisch multidrug-resistant tuberculosis – MDR-TB) bedeutet die Einnahme mehrerer Medikamente gleichzeitig über einen Zeitraum von mindestens 21 Monaten. In den ersten drei Monaten erhalten die Patienten eine Mischung aus fünf verschiedenen Medikamenten. Grundsätzlich sind die Chancen auf eine erfolgreiche Behandlung einer multiresistenten Tuberkulose geringer als bei der Behandlung einer unkomplizierten Tuberkulose, selbst wenn die Patienten die effizienteste Therapie erhalten.
Die Anwendung von Ofloxazin und Levofloxazin ist durch vergleichsweise hohe Produktpreise in ärmeren Ländern kaum durchführbar. Beide Wirkstoffe stehen unter Patentschutz der Hersteller. Capreomycin wird nur von einem einzigen Hersteller (Eli Lilly) vertrieben, zu einem Preis, der die Verwendung enorm einschränkt.
Mittlerweile werden in die Behandlung der multiresistenten Tuberkulose auch neuere Arzneistoffe einbezogen. So wurden im Mausmodell erfolgreich Kombinationen aus Bedaquilin,[61] PA-824 und Sutezolid sowie Rifapentin eingesetzt.[62]
Bedaquilin (Handelsname Sirturo) wurde zwischenzeitlich von der Europäischen Kommission zugelassen.[63][64] Zwei weitere Arzneistoffe – die neue chemische Entität Delamanid (Handelsname: Deltyba; Hersteller: Otsuka Pharmaceuticals) und die seit langem bekannte Substanz 4-Aminosalicylsäure (Handelsname: Granupas; Hersteller: Lucane) – wurden im Mai 2014 europaweit zugelassen.[65][66][67][68]
In einer türkischen Studie führte die zusätzliche Anwendung einer pulmonalen Resektion bei 12 von 13 MDR-TB-Patienten zu einer dauerhaften Heilung.[69]
Thioridazin mindert unter anderem die Aktivität der Antibiotikum-Resistenzen in Mycobacterium tuberculosis,[70] weshalb der Einsatz in Kombination mit Antibiotika untersucht wird.[71][72]
Therapie der komplizierten Tuberkulose
Bei zusätzlichen Komplikationen, wie zum Beispiel Verlegung eines Teils der Atemwege durch einen beteiligten Lymphknoten, soll die Behandlung auf insgesamt neun bis zwölf Monate ausgedehnt werden. Eine Miliartuberkulose oder eine tuberkulöse Hirnhautentzündung (Meningitis) machen eine initiale Vierfachtherapie auch im Kindesalter über dann eher drei Monate und eine Ausdehnung der Gesamtbehandlungsdauer auf neun bis zwölf Monate erforderlich. Außerdem sollen die Patienten für mindestens sechs Wochen mit Prednisolon beziehungsweise bei der Meningitis mit Dexamethason in absteigender Dosierung behandelt werden.[73]
Eine besondere therapeutische Herausforderung stellt die Behandlung der Tuberkulose bei gleichzeitig HIV-infizierten Patienten dar. Insbesondere das Standardmedikament Rifampicin darf wegen erheblicher Wechselwirkungen nicht gleichzeitig mit bestimmten Wirkstoffen, die zur Therapie der HIV-Infektion eingesetzt werden, verabreicht werden. Daher muss von entsprechend erfahrenen Fachärzten entweder die HIV-Therapie oder die tuberkulostatische Therapie umgestellt werden.
Unterstützende Behandlung
Aufgrund der Schwierigkeit und Langwierigkeit der Standardtherapie wurde versucht, durch Ergänzung diverser Stoffe die Therapie zu unterstützen. Am aussichtsreichsten zeigten sich hierbei L-Arginin, eine Aminosäure, die die Bildung von reaktiven Stickstoffspezies in Makrophagen unterstützen soll, so durch täglichen Verzehr von 30 Erdnüssen, die etwa 1 g L-Arginin enthalten,[74] und Vitamin D, dessen unterstützende Rolle bei Infektionen allgemein belegt ist. Beide Stoffe sind in Erkrankten zu wenig vorhanden.[75][76][77]
Eine hochdosierte Vitamin-D-Therapie bei Patienten mit Lungentuberkulose beschleunigte in einer randomisierten Studie der Queen Mary Universität London sogar die mikroskopische Sputumkonversion, d. h. die Zeitdauer, während der die Patienten ansteckend sind, verringerte sich signifikant von 36 auf 23 Tage. Dabei wurde die Konzentration verschiedener entzündlicher Zytokine und Chemokine im Blut vermindert und lebensbedrohliche Entzündungserscheinungen gingen schneller zurück als in der Kontrollgruppe.[78][79]
Weiterhin untersuchten Subbian und andere in einer Studie mit Kaninchen den Einfluss eines PDE-4-Hemmers auf die angeborene Immunantwort in der Lunge und den Effekt, den ihre Abschwächung wiederum auf die Expression verschiedener Bakteriengene hatte. Es zeigte sich eine verminderte Expression der INH-Resistenzgene und, damit zusammenhängend, eine bessere Clearance des Gewebes bei Behandlung mit Isoniazid.[80]
Eine andere Möglichkeit besteht in der Abschwächung der Granulombildung in der Lunge mittels Laktoferrin. Hierzu gibt es noch keine klinischen Studien.[81]
Prävention
Da es derzeit keinen wirksamen Impfschutz gegen Tuberkulose gibt, besteht die wichtigste vorbeugende Maßnahme darin, infizierte Personen möglichst frühzeitig zu entdecken und sowohl rasch als auch effektiv zu behandeln. Wegen der geringen Fallzahl in Deutschland sind hierzu Reihenuntersuchungen weder in Form von Tuberkulintestungen noch von Röntgenuntersuchungen sinnvoll. Die aktive Suche nach infizierten Personen in Form einer Umgebungsuntersuchung von Kontaktpersonen von Patienten mit infektiöser Tuberkulose ist eine unverzichtbare Voraussetzung zur Verringerung der Erkrankungshäufigkeit. Zur Gruppe der Personen mit erhöhtem Tuberkuloserisiko, bei denen aktiv nach einer Infektion gesucht werden soll, gehören außerdem zum Beispiel Personen aus Ländern mit hoher Tuberkuloserate, Obdachlose, Drogenabhängige, Gefängnisinsassen, aber auch HIV-Positive.[15] Das persönliche Erkrankungsrisiko kann heute unter Einbeziehungen wichtiger Einflussgrößen algorithmisch eingeschätzt werden. Ein ausgefeiltes, auch Medikamentenunverträglichkeiten berücksichtigendes Beispiel dafür ist der Online TST/IGRA Interpreter, der an der kanadischen McGill-Universität von Dick Menzies und seinen Mitarbeitern entwickelt wurde.[82]
Impfung
Bis 1998 wurde in Deutschland eine aktive Schutzimpfung (Lebendimpfung) mit dem abgeschwächten Mykobakterien-Impfstamm Bacillus Calmette-Guérin (BCG) gegen die Tuberkulose durchgeführt. Aufgrund der nachlassenden Schutzwirkung, lokaler Komplikationen und Nebenwirkungen und der geänderten epidemiologischen Situation wird die Indikation zur BCG-Impfung seit 1998 in Deutschland nur noch selten gestellt. Bei der Einführung des Impfstoffs kam es 1930 in Lübeck zum Lübecker Impfunglück. Dabei wurden 208 Kinder durch eine fehlerhafte Verarbeitung der aus Paris bezogenen BCG-Kultur zu Impfstoff mit virulenten Tuberkulosebakterien infiziert. 77 von ihnen starben. Durch diesen Impfunfall weiß man aus der Beobachtung dieser Kinder heute viel über den Verlauf der Krankheit. Die Einführung der Impfung in Deutschland wurde dadurch aber bis in die Zeit nach dem Zweiten Weltkrieg verzögert. Die BCG-Impfung wird heute von der Ständigen Impfkommission nicht mehr empfohlen, da die eingeschränkte Wirksamkeit die Impfkomplikationen nicht aufwiegen konnte. Außerdem ist bei geimpften Personen der Tuberkulintest auch nach Jahrzehnten noch gelegentlich leicht bis mäßig positiv. Aus diesem Grund wird dieser Test (etwa bei einem Kontakt mit einer Person, die an offener TBC erkrankte) erst bei einer stärkeren Reaktion in Form einer verhärteten Schwellung (Induration) von mehr als 15 mm Querdurchmesser zur Unterarmachse als positiv gewertet. Auch weltweit konnte die BCG-Impfung die Verbreitung der Tuberkulose nicht eindämmen, obwohl sie zu den am weitesten verbreiteten Impfungen gehört. Lediglich die besonders fulminanten und gefürchteten Verläufe im Kindesalter in Form einer tuberkulösen Meningitis oder einer Miliartuberkulose vermag die BCG-Impfung wohl relativ zuverlässig zu verhindern. Derzeit versuchen verschiedene Forscher, die Wirksamkeit des BCG-Impfstammes durch gentechnische Veränderungen zu erhöhen, indem die Impfbakterien zusätzliche Antigene produzieren, durch die das Immunsystem besser auf die echten Mykobakterien reagieren kann.[28]
Der BCG-Impfstoff ist besonders in den Tropen und in den Subtropen von sehr schlechter Wirksamkeit. Tiermodelle wie auch Impfstudien mit Menschen zeigten, dass die schlechte Wirksamkeit von bereits existierenden Immunantworten auf boden- und (trink-)wasserbewohnende, nichtpathogene Mycobacterium-Arten herrührt. Viele der Mykobakterien besitzen kreuz-reaktive Antigene, so dass eine Infektion mit dem einen Mykobakterium einen gewissen Schutz gegen die Infektion mit dem anderen verleiht. Dies hat Folgen für den Impfschutz: Einerseits bestehen Antikörper gegen den BCG-Lebendimpfstoff – der Impfstoff wird vom Körper vernichtet, bevor er selbst das Immunsystem stimulieren kann. Und zweitens besteht durch die im täglichen Leben aufgenommenen Mykobakterien ein immerhin so guter Schutz gegen das Tuberkulose-Bakterium, dass die Impfung keinen nennenswerten zusätzlichen Schutz bringt. Man vermutet, dass durch die bessere Hygiene und Trinkwasseraufbereitung in Industrieländern dieser natürliche Impfschutz fehlt und dadurch die BCG-Impfung bislang effektiv war.[83] In den 1970er Jahren wurde in Indien eine Tuberkulose-Impfstoff-Studie an 260.000 Menschen durchgeführt. Diese ergab, dass mehr Fälle von Tuberkulose bei den Geimpften als bei den Ungeimpften auftraten.[84]
Eine Phase-I-Studie mit einem neuen Impfstoff VPM1002[85] wurde in den Jahren 2009 und 2010 in Neuss mit 80 Probanden getestet und mit guter Verträglichkeit bewertet. Der Impfstoff VPM1002 wird in einer Phase-III-Studie bis 2020 an 2000 Menschen in Indien getestet.[86]
Der bisher vielversprechende Impfstoff MVA85A zeigte 2013 in der Phase-II-Studie Schwächen auf. Es gibt bei geimpften gesunden und HIV-negativen Säuglingen keine Verbesserung zum bisherigen Impfstoff. Jedoch ist abzuwarten, ob der Impfstoff bei Erwachsenen oder HIV-Positiven (die den Lebendimpfstoff nicht erhalten dürfen) einen Vorteil bringt.[87] Neben diesem sind derzeit 12 weitere Tuberkulose-Impfstoffe in der klinischen Phase, AERAS-402/Crucell Ad35 und GSK M72 werden aktuell an Erwachsenen und Kindern in Südafrika getestet.[88]
Ende 2010 konnte gezeigt werden, dass im Mausmodell intranasale Impfung mit mRNA (Hsp-65) von M. leprae effektiv und sicher vor Infektion mit M. tuberculosis schützt.[89]
Eine weitere Neuentwicklung ist H4:IC31.[90] Dabei handelt es sich um ein rekombinantes Fusionsprotein H4 und das Adjuvans IC31. H4 besteht aus den Tuberkel-Antigenen Ag85B und TB10.4. Ag85B wird auch α-Antigen[91] genannt und ist eine Mycolyl-Transferase. TB10.4 ist eines von drei sehr ähnlichen Proteinen der ESAT-6-Gruppe von Mycobacterium tuberculosis. Eine Prüfung in Südafrika an BCG-geimpften Jugendlichen verlief vielversprechend.
Chemoprophylaxe und Chemoprävention
Da kleine Kinder unter fünf Jahren nach einer Infektion häufiger und schneller erkranken als Erwachsene (20 % der angesteckten Kinder erkranken nach der Literatur bei einer Mindestlatenzzeit von etwa drei Wochen bis zu Jahren oder gar Jahrzehnten), gelten bei ihnen nach Kontakt zu an Tuberkulose Erkrankten besondere Vorsorgemaßnahmen. Auch bei negativer Tuberkulin-Testung sollten sie nach den Richtlinien der Schweizer Lungenliga für zwei Monate prophylaktisch mit Antituberkulotika (z. B. Isoniazid) behandelt werden. Wenn nach diesen zwei Monaten der Tuberkulin-Test immer noch negativ ist, kann die Behandlung beendet werden. Ist der Tuberkulin-Test in der Zwischenzeit aber positiv geworden, muss zum einen eine aktive Tuberkulose durch eine Röntgenuntersuchung der Lungen ausgeschlossen werden. In Europa geschieht dies durch eine Brustaufnahme; in Übersee wie in Australien empfiehlt man dagegen gerade bei Kindern eine Computertomographie der Brustorgane. Die Behandlung mit dem Antituberkulotikum wird dann für weitere Monate als Chemoprävention fortgesetzt. Wenn die Erreger bei der Infektionsquelle bekanntermaßen resistent gegen das Antituberkulotikum sind, muss die Chemoprophylaxe selbstverständlich mit einem anderen Wirkstoff, vorzugsweise Rifampicin erfolgen. Bei Mehrfachresistenzen soll sie sogar mit zwei verschiedenen wirksamen Substanzen durchgeführt werden.[31]
Meldepflicht
In Deutschland ist „behandlungsbedürftige“ Tuberkulose beim Menschen eine meldepflichtige Krankheit[92] im Sinne des Infektionsschutzgesetzes (IfSG), auch wenn ein bakteriologischer Nachweis nicht vorliegt (§ 6 Absatz 1 Satz 1 Nummer 1a Buchstabe a IfSG). Erkrankung und Tod sind zu melden. Dem Gesundheitsamt ist darüber hinaus zu melden, „wenn Personen, die an einer behandlungsbedürftigen Lungentuberkulose erkrankt sind, eine Behandlung verweigern oder abbrechen“ (§ 6 Absatz 1 Satz 2 IfSG). Außerdem besteht auch für die Leitungen von Gemeinschaftseinrichtungen eine Benachrichtigungspflicht[93] nach § 34 Absatz 6 IfSG.
Beim Tier ist die Erkrankung in Deutschland eine meldepflichtige Tierkrankheit nach § 26 Tiergesundheitsgesetz (TierGesG) in Verbindung mit § 1 und der Anlage der Verordnung über meldepflichtige Tierkrankheiten.[94] Ausgenommen sind davon Mycobacterium-bovis- inklusive deren Subspezies-Infektionen, die sogar anzeigepflichtige Tierseuchen sind nach § 4 TierGesG in Verbindung mit § 1 der Verordnung über anzeigepflichtige Tierseuchen sind.[95][94]
In Österreich ist Tuberkulose beim Menschen eine meldepflichtige Krankheit gemäß § 3 Tuberkulosegesetz[96]. Danach ist jeder Nachweis eines Tuberkuloseerregers, jede aktive oder ansteckende Tuberkuloseerkrankung sowie jeder darauf zurückzuführende Todesfall meldepflichtig. Zudem ist jeder Verdacht auf eine Tuberkuloseerkrankung zu melden, wenn sich die an der Tuberkulose erkrankte Person der diagnostischen Abklärung entzieht. Es besteht nach § 2 Tuberkulosegesetz auch die Pflicht, sich behandeln zu lassen (Behandlungspflicht).
In Österreich ist Tuberkulose der Rinder anzeigepflichtig nach § 16 Tierseuchengesetz.
In der Schweiz ist Tuberkulose beim Menschen ebenfalls eine meldepflichtige Krankheit und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Meldungpflichtig sind der Beginn einer Behandlung mit drei verschiedenen Antituberkulotika oder der Nachweis von Mykobakterien des Tuberculosis-Komplexes in klinischem Material.
In der Schweiz ist Tuberkulose als auszurottende Tierseuche im Sinne von Artikel 3 Tierseuchenverordnung (TSV) mit umfassenden Pflichten nach den Artikeln 158–165a[97] meldepflichtig.[98]
Tuberkulose bei anderen Lebewesen
Tuberkulosen kommen bei nahezu allen Wirbeltieren vor und können neben M. tuberculosis von zahlreichen anderen Mykobakterien des Mycobacterium tuberculosis-Komplexes ausgelöst werden.
Mycobacterium tuberculosis
M. tuberculosis kann sowohl bei Haustieren als auch bei Wildtieren (wie zum Beispiel Hirschen oder Springböcken[99]) eine Erkrankung hervorrufen. Beschrieben ist die Infektion aufgrund des engeren Kontakts zum Menschen bei vielen domestizierten Arten, z. B. bei Haushunden, Hauskatzen und Papageien, und bei Zootieren wie Elefanten.[100]
Bei den meisten Tierarten sitzt der Primärherd vor allem in der Lunge, die Erkrankung gleicht also der Lungentuberkulose des Menschen. Bei Schweinen sind nahezu ausschließlich die mesenterialen Lymphknoten betroffen. Bei Rindern verläuft die Infektion mit M. tuberculosis zumeist ohne pathologische Prozesse, von Bedeutung ist aber, dass der Erreger mit der Milch ausgeschieden wird, weshalb die Pasteurisierung der Milch eine wesentliche Maßnahme für die Bekämpfung der Tuberkulose des Menschen war. Rohmilch sollte allenfalls aus tuberkulosefreien Rinderbeständen konsumiert werden.
Andere Mykobakterien
Die Tuberkulose der Rinder ist von den Tiertuberkulosen für den Menschen am bedeutsamsten. Ihr Erreger, Mycobacterium bovis und Mycobacterium caprae, besitzen zwar eine relativ hohe Wirtsspezifität, können aber auch Erkrankungen bei Menschen und anderen Säugetieren (einschließlich vieler Haustiere und zahlreicher Wildtiere) verursachen, so dass es sich um einen Zoonose-Erreger handelt. Die Tuberkulose der Rinder ist eine anzeigepflichtige Tierseuche.[101] Für Infektionen bei anderen Haussäugetieren als Rindern sowie bei Wildsäugetieren besteht Meldepflicht.[102]
Die Geflügeltuberkulose wird durch M. avium verursacht. Sie war eine der häufigsten Erkrankungen bei Haushühnern, ist heute allerdings selten. Prinzipiell sind alle Vogelarten, aber auch der Mensch, Rinder, Schweine, Schafe, Ziegen, Katzen und vor allem das Kaninchen empfänglich. Die Geflügeltuberkulose zählt zu den meldepflichtigen Tierkrankheiten.[103]
Bei Schlangen ist die Tuberkulose selten und verläuft meist chronisch mit Tuberkelbildung in inneren Organen, der Unterhaut oder im Maul. Hauptsächliche Erreger sind M. thamnopheos, M. marinum und M. chelonae. Bei Echsen ist die Erkrankung ebenfalls selten und verläuft als unspezifische Allgemeinerkrankung oder unter Manifestation in der Haut. Haupterreger sind M. ulcerans, M. marinum und M. thamnopheos. M. ulcerans ist beim Menschen Erreger des Buruli-Ulkus.
Die Fischtuberkulose wird durch M. marinum, M. fortuitum und M. chelonae hervorgerufen und befällt sowohl Süß- als auch Salzwasserfische. M. chelonae kann bei Verfütterung infizierter Fische auch bei Schildkröten geschwürige Veränderungen im oberen Verdauungstrakt, Lungenentzündungen und Hauterkrankungen auslösen.
Die Paratuberkulose ist eine durch M. paratuberculosis hervorgerufene Darmerkrankung der Wiederkäuer.
Pseudotuberkulose
Zwei unterschiedliche, der Tuberkulose sehr ähnliche Krankheitsbilder, die jedoch nicht durch Mykobakterien verursacht werden, bezeichnet man als Pseudotuberkulose.
Die Pseudotuberkulose der Ziegen und Schafe – seltener sind Rinder, Pferde, Schweine und zunehmend auch Kamele betroffen – ist eine Infektionskrankheit, die durch das mit den Mykobakterien verwandte Bakterium Corynebacterium pseudotuberculosis verursacht wird. Beim Menschen kann es nach massivem Kontakt mit Corynebacterium pseudotuberculosis zu Infektionen mit Lymphknotenentzündungen kommen.[104]
Ebenso wird die bei Hasen, Nagetieren und Vögeln, durch Yersinia pseudotuberculosis hervorgerufe Yersiniose als Pseudotuberkulose bezeichnet, bei Nagetieren auch Rodentiose genannt. Yersinia pseudotuberculosis ist für viele Säugetier- und Vogelarten potenziell pathogen, so auch für den Menschen.
Geschichte
Paläolithikum und Neolithikum
Untersuchungen eines etwa 500.000 Jahre alten Fossils des Frühmenschen Homo erectus aus der Türkei zeigten, dass die Tuberkulose wesentlich früher in der Menschheitsgeschichte auftrat als bislang gedacht. Am Schädeldach fanden sich Spuren einer durch Tuberkulose ausgelösten Hirnhautentzündung (Leptomeningitis tuberculosa). Die Forscher mutmaßen, dass dieser aus Afrika stammende Frühmensch dunkelhäutig gewesen sei und daher im Vergleich zu hellhäutigen Menschen deutlich weniger Vitamin D produzieren konnte, was ihn folglich besonders anfällig für diese Erkrankung gemacht haben könnte.[105][106] Diese allerdings nur auf morphologischen Skelettveränderungen beruhende Annahme einer Erkrankung an Tuberkulose sowie der weitere, nunmehr erstmals molekularbiologisch abgesicherte Befund einer 9000 Jahre alten Probe[107] bestätigen die Annahme der modernen Forschung, dass die Tuberkulose nicht in der Jungsteinzeit im Verlaufe der Domestikation des Viehs von diesem auf den Menschen übersprang, sondern sich während eines langen, wesentlich früher beginnenden Zeitraumes parallel mit dem Homo erectus entwickelte. Auch Skelettüberreste von prähistorischen Menschen, die auf ca. 4000 v. Chr. datiert wurden, zeigen Spuren der Krankheit. Auch handelt es sich nicht etwa um geographisch isolierte Befunde, vielmehr wurde Mycobacterium tuberculosis schon 2001 in Wyoming, Nordamerika in 17.000 Jahre alten Funden nachgewiesen.[108]
Altertum
Tuberkulöse Zerstörung fand sich in Knochen ägyptischer Mumien von 3000 bis 2400 v. Chr. Vergleichbare Befunde aus Altamerika datieren um 2000 v. Chr. Nach den schriftlichen Überlieferungen gibt es Hinweise auf eine Tuberkuloseepidemie in Indien um 1300 v. Chr.
Im 5. Jahrhundert v. Chr. kennzeichnete Hippokrates die Schwindsucht (griech. φθίσις phthísis Schwund, Auszehrung)[109] als eine der Epidemien, die fast immer tödlich war. Von ihm sind eindrucksvolle Krankheitsbeschreibungen überliefert.[110]
Mittelalter
Im frühen Mittelalter spielte die Tuberkulose in Europa aufgrund der dünnen Besiedelung eine untergeordnete Rolle. Stärker war sie lediglich in den wenigen Ballungsgebieten vertreten. Dazu gehörte in erster Linie Byzanz. Die Tuberkuloseopfer der Zeit stammen aus allen Klassen bis hin zu Angehörigen des Kaiserhauses. Die medizinische Literatur aus Byzanz beschreibt zu allen Zeiten tuberkulöse Krankheitsbilder. Wesentliche Neuerungen in der Therapie der Tuberkulose wurden dagegen im Mittelalter nicht eingeführt. Bis in die frühe Neuzeit verharrte man auf dem Stand der hippokratischen Schriften und derer Galens. Eine der wenigen Ausnahmen war im 6. Jahrhundert Alexander von Tralleis aus Lydien, der therapeutische Maßnahmen weiterentwickelte oder ausdifferenzierte.
Frühe Neuzeit
Nach einem vorausgehenden Ausbruch in Italien in der zweiten Hälfte des 15. Jahrhunderts begann im 17. Jahrhundert die größte und längste geschichtliche Tuberkulosewelle. Sie erreichte ihren Höhepunkt im 18. Jahrhundert und hält nach einem temporären Aufflackern der Epidemie kurz nach dem Ersten und dem Zweiten Weltkrieg in letzten Ausläufern bis heute an.
Hinsichtlich der Auffassung der Pathogenese existierten in den europäischen Ländern des 18. Jahrhunderts unterschiedliche Traditionen. Viele Medizinautoren dieser Zeit betrachteten die Tuberkulose bzw. die nicht immer damit synonyme Schwindsucht[111] (von mittelhochdeutsch swinden „schwinden, abnehmen, abmagern usw.“) als die schlimmste unter den damals bekannten Seuchen. Ursächlich sahen sie eine Ungleichverteilung der Körpersäfte, unheilvolle Ausdünstungen des Bodens, die Verstädterung oder den Verfall der Sitten. Hingegen neigte man in Italien traditionell zu einer contagiösen, d. h. übertragbaren Ursache. Konsequenterweise führte die Republik Venedig Mitte des 18. Jahrhunderts die schriftliche Meldepflicht bei Erkrankungen an der Phthise (Schwindsucht bei Lungentuberkulose) ein. Die persönliche Habe der an der Erkrankung verstorbenen Personen wurde zur Minderung der Ansteckungsgefahr verbrannt.
In England und den nordischen Ländern vertrat man dagegen gemeinhin die Ansicht, die Erkrankung beruhe auf einer hereditären (erblichen) Ursache. Eine große Ausnahme stellte in England die Veröffentlichung Benjamin Martens von 1720 dar: A New Theory of Consumptions, in der Marten 162 Jahre vor Robert Koch die Ursache der Erkrankung einer Infektion durch Mikroorganismen zuschrieb. Martens in kleiner Auflage erschienene Veröffentlichung fand jedoch keine weitere Rezeption. In Frankreich, Deutschland und der Schweiz mischten sich Vertreter beider Schulen. Zum Teil vertrat man hier ausdrücklich die hereditäre Theorie, leitete aber gleichzeitig Maßnahmen zur Minderung einer Ansteckungsgefahr ein.
Eine herausragende Rolle unter den Phthisiologen seiner Zeit nahm Johann Jakob Wepfer in Schaffhausen ein, der bei seinem Studienaufenthalt in Italien die Idee von der kontagiösen Ätiologie der Erkrankung übernommen hatte. Er beschrieb so als erster die Entstehung der Lungencavernen (hanc calamitatem) aus Tuberkeln (tubercula). Seine Arbeiten und Untersuchungen zur Epidemiologie der Tuberkulose gingen in vielem qualitativ über die Leistungen der folgenden zwei Jahrhunderte hinaus. Sie wurden erst posthum 1727 durch den Sohn veröffentlicht und blieben außerhalb eines kleinen Expertenzirkels unbekannt.
19. Jahrhundert
Zu Beginn des 19. Jahrhunderts behandelte Thomas Beddoes die „Schwindsucht“ bzw. Lungentuberkulose und andere Erkrankungen der Atemwege mit Inhalation bestimmter Gase.[112]
Aufgrund der Vielzahl ihrer Symptome wurde die Krankheit bis ins 19. Jahrhundert nicht von anderen mit ähnlichen Symptomen wie der heute seltenen Skrofulose abgegrenzt. Erst 1819 erklärte René Laënnec die Einheitlichkeit von Tuberkeln mit Miliarknötchen und (tuberkulösen) Kavernen und erkannte, dass die tuberkulöse Materie sich neben der Lunge auch in anderen Organen bilden kann. Erst 1839 wurde von Johann Lukas Schönlein der einheitliche Krankheitsbegriff Tuberkulose geprägt.
Tuberkulose fand im 19. und frühen 20. Jahrhundert allgemeines Interesse als die endemische Krankheit der städtischen Armen. 1815 wurde in England ein Viertel der Todesfälle und 1918 in Frankreich ein Sechstel der Todesfälle durch Tuberkulose verursacht. In der Altersgruppe der 15- bis 40-Jährigen war um 1880 jeder zweite Todesfall in Deutschland auf diese Krankheit zurückzuführen. Auch in ländlichen Gegenden stellte die Tuberkulose die häufigste Todesursache dar. Von den 2188 in der Liechtensteiner Gemeinde Triesen verzeichneten Todesfällen der Jahre 1831 bis 1930 gingen 15 % auf das Konto der Tuberkulose.[113]

Im 19. Jahrhundert entwickelte sich die Luftkur, bei der die Patienten mehrere Stunden täglich an der freien Luft liegen mussten, zur bevorzugten Therapie für Tuberkulose. Diese fand in eigenen Tuberkulose-Sanatorien (Lungenheilstätten) statt; das erste weltweit errichtete Hermann Brehmer 1855 im niederschlesischen Görbersdorf (heute Sokołowsko, Polen).
Nachdem man auch im Norden erkannt hatte, dass die Krankheit ansteckend ist, wurde die Tuberkulose in den 1880er Jahren in Großbritannien meldepflichtig. Es gab damals Kampagnen zum Vermeiden des Ausspuckens auf öffentlichen Plätzen. Die angesteckten Armen wurden angeregt, in Sanatorien zu gehen, die eher Gefängnissen ähnelten. Trotz des behaupteten Nutzens der Frischluft und der Arbeit im Sanatorium verstarben 75 Prozent der Insassen innerhalb von fünf Jahren (1908).
Neben solchen Maßnahmen, die immer noch dem hygienisch-diätetischen Behandlungskonzept anhingen, gab es im 19. Jahrhundert mit zunehmend besseren chirurgischen Möglichkeiten auch sehr unterschiedliche lokale Behandlungskonzepte. Insbesondere die Pneumothorax-Technik bzw. Pneumolyse fand in zahlreichen Varianten verbreitete Anwendung. Dabei wurde ein betroffener Lungenflügel künstlich zum Kollabieren gebracht, um die Lunge zum Stillstand und zur Ausheilung der Veränderungen zu veranlassen. Der italienische Mediziner Carlo Forlanini gilt (seit 1892) als Erfinder dieser Kollapstherapie der Lungentuberkulose.[114][115] Diese Technik war aber von geringem Nutzen und wurde nach 1946 allmählich eingestellt. Daneben entwickelten sich immer feinere Resektionsverfahren, mit denen betroffene Lungenabschnitte entfernt wurden. Der international renommierte französische Herzchirurg Théodore Tuffier[116] resezierte bei Tuberkulose als Erster die Lungenspitze.
Das Bakterium Mycobacterium tuberculosis beschrieb Robert Koch am 24. März 1882. Er erhielt 1905 für die Entdeckung des Erregers den Nobelpreis für Physiologie oder Medizin. Koch glaubte nicht, dass sich die bovine und menschliche Tuberkulose ähnlich waren, was die Erkennung infizierter Milch als Quelle der Erkrankung verzögerte. Später wurde diese Quelle durch Pasteurisierung beseitigt. Koch braute 1890 einen Glycerin-Extrakt der Tuberkelbazillen als Hilfsmittel zur Behandlung der Tuberkulose und nannte ihn Tuberkulin. Es war bei einer zunächst euphorisch begrüßten Anwendung jedoch nicht wirkungsvoll. Die Beobachtung lokaler Hautreaktionen bei der Anwendung von Tuberkulin führte aber später zur Entwicklung eines Testverfahrens zum Nachweis der Ansteckung respektive Erkrankung durch Clemens von Pirquet 1907, Felix Mendel und Charles Mantoux jeweils um 1910.
1883 wies Robert Koch erstmals Tuberkelbazillen im Gewebe von Lupus vulgaris, einer zu Beginn des 19. Jahrhunderts erstmals als eigenständiges Krankheitsbild beschriebenen Hauterkrankung, nach und zeigte somit deren Ursache als Hauttuberkulose.[117] Eine von dem Chirurgen Ferdinand Sauerbruch in München, wo dieser an der Universitätsklinik eine Lupusstation eingerichtet hatte (im ersten Viertel des 20. Jahrhunderts) gemäß den Erfahrungen eines Bielefelder Arztes namens Gerson durchgeführte mineralhaltige, aber kochsalzfreie Diät zeigte offenbar (angeblich in 448 von 450 Fällen) Erfolge bei der Behandlung der Hauttuberkulose.[118]
20. Jahrhundert
Den ersten Erfolg mit Immunisierung gegen Tuberkulose hatten 1906 Albert Calmette und Camille Guérin mit ihrem BCG-Impfstoff. Er wurde erstmals am 18. Juli 1921 in Frankreich am Menschen angewendet. Nationalistische Strömungen, die das Lübecker Impfunglück für ihre Zwecke nutzten, verhinderten in Deutschland den weitverbreiteten Gebrauch bis nach dem Zweiten Weltkrieg.
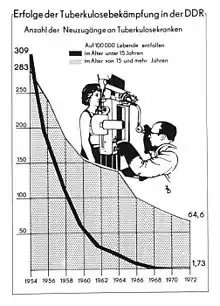
Dennoch sank die durch Tuberkulose verursachte Sterblichkeitsrate in den hundert Jahren von 1850 bis 1950 in Europa deutlich von 500 auf 50 pro Jahr, bezogen auf 100.000 Einwohner. Verbesserungen im öffentlichen Gesundheitswesen, vor allem die Einrichtung eines dichten Netzes an Tuberkulosefürsorgestellen ab 1905,[119] verringerten die Erkrankungszahl schon vor Einführung von Antibiotika. Dabei wechselte das Konzept mehrfach. Bis 1945 stand die Heilstättenbehandlung von Frühfällen und leicht erkrankten Fällen im Vordergrund. Aus den Erfahrungen der kriegsbeeinflussten Jahre 1917 bis 1919 wurde 1945 das stationäre Behandlungskonzept grundlegend geändert. Primär kamen nur noch schwer erkrankte und ansteckungsverdächtige Patienten in die Heilstätten. Die Heilstätten wurden apparativ aufgerüstet, um unter Einschluss lungenchirurgischer Verfahren eine Maximalversorgung anbieten zu können.
Mit der Entwicklung des Antibiotikums Streptomycin im Jahr 1943 wurde neben der Prävention die aktive Behandlung möglich. Den Erfolg trübten allerdings häufige Resistenzen der Mykobakterien gegen Streptomycin. Die fast gleichzeitige Herstellung von Paraaminosalicylsäure (PAS) fand zunächst kaum Beachtung, obwohl schon die Kombination dieser beiden Substanzen die Bildung resistenter Stämme erschwert. Ab 1952 fand Isoniazid als weiteres Tuberkulosemedikament zunehmende Verwendung. Die Kombinationstherapie zur Vermeidung von Resistenzbildungen wurde von dieser Zeit an Standard der Tuberkulosebehandlung. Der bis heute anhaltende Durchbruch in der antituberkulotischen Behandlung wurde ab den 1960er Jahren durch das Hinzukommen von Ethambutol und zuletzt Rifampicin erzielt.
Bedingt durch die Abschaffung des öffentlichen Gesundheitswesens im New York der 1970er Jahre kam es dort in den 1980er Jahren zu einer Zunahme an Erkrankungen. Die Zahl derer, die ihre Medikamente nicht einnehmen konnten, war hoch. In der Folge erlitten in New York mehr als 20.000 Menschen eine vermeidbare Infektion mit antibiotikaresistenten Erregerstämmen.
Seit dem Auftreten antibiotikaresistenter Stämme (d. h. resistent gegen mindestens Rifampicin und Isoniazid) in den 1980er Jahren geht die Hoffnung zurück, dass man die Krankheit vollständig ausrotten könnte. So gab es um 1955 in Großbritannien 50.000 Tuberkulose-Fälle. Von 1987 bis 2001 stieg die Zahl Tuberkulosekranker in Großbritannien dann wieder von 5500 auf über 7000 bestätigte Fälle an.
Das Wiederaufleben der Tuberkulose veranlasste die WHO 1993 dazu, einen globalen Gesundheitsnotfall auszurufen. 1996 erklärte sie den 24. März zum Welttuberkulosetag.
21. Jahrhundert
In Ländern außerhalb Europas und Nordamerika, wie z. B. Bangladesch bleibt Tuberkulose auch im 21. Jahrhundert weiterhin eines der Hauptprobleme für die Gesundheitsversorgung. Eine erneute Zunahme von Fällen wurde mehrfach mit dem Problem des Klimawandels in Verbindung gebracht.[120]
Die Tuberkulose in der Kunst
Aufgrund ihrer enormen Bedeutung spiegelt sich die Krankheit vielfach in der Kunst wider. Manche Künstler verarbeiteten die Konfrontation mit dem frühen (eigenen) Tod auf eindrucksvolle Weise. Bereits in der darstellenden Kunst der Ägypter findet sich ab dem mittleren Reich die Darstellung des Gibbus, des markanten äußeren Ausdrucks der Pott’s Disease, der Wirbelsäulentuberkulose. Vergleichbare Darstellungen sind auch aus den altamerikanischen Kulturen überliefert.
- In den letzten Jahren seines Lebens zeigte der deutsche Schriftsteller Friedrich Schiller immer öfter Symptome einer Tuberkuloseerkrankung. In dieser Zeit entstand eines seiner wichtigsten Werke, das Drama Wilhelm Tell. Am 9. Mai 1805 verstarb der Schriftsteller an der durch die Tuberkuloseerkrankung hervorgerufenen akuten Lungenentzündung in Weimar.
- Drei der sechs Geschwister Brontë starben an Tuberkulose. Charlotte Brontë nahm das Thema in ihrem Roman Jane Eyre auf, in dem Janes Freundin Helen Burns daran stirbt. Auch im Roman Sturmhöhe ihrer Schwester Emily Brontë ist Tuberkulose ein Thema. Darin stirbt Hindleys Frau Frances sehr jung an Tuberkulose.
- Schon 1848 ließ Alexandre Dumas d. J. in seinem Roman La Dame aux Camélias – Die Kameliendame (EA Paris, Alexandre Cadot) die weibliche Hauptfigur an der Tuberkulose sterben. Der Stoff wurde von Giuseppe Verdi (Musik) und Francesco Maria Piave (Libretto) in der 1853 uraufgeführten Oper La traviata (italienisch: Die Gestrauchelte oder Die Entgleiste) verarbeitet. In dieser geht Violetta Valery sehr realistisch drei Akte lang an der weißen Pest zugrunde. Zur Zeit der Entstehung war es fast ein Skandal, den Tod so realistisch zu inszenieren.
- Im Roman Anna Karenina lässt der Autor Leo Tolstoi seine Figur Nikolaj Dmitrijewitsch Lewin an der Tuberkulose sterben.
- In der 1896 uraufgeführten Oper La Bohème von Giacomo Puccini stirbt die Hauptfigur Mimì im 4. Akt an der Tuberkulose.
- Auch in Knut Hamsuns Erzählung Victoria (1898) stirbt die Heldin zuletzt an Tuberkulose.
- Der tschechische Dichter Jiří Wolker verstarb mit 24 Jahren an Tuberkulose; seine Erkrankung und das herannahende Sterben verarbeitete er in seinem Spätwerk.
- Eines der wohl bekanntesten Beispiele dürfte Thomas Manns Zauberberg (Erstausgabe von 1924) sein. Inspiriert durch die Erkrankung seiner Frau Katia lokalisiert er die Handlung des weltbekannten Romans in Davos zu einer Zeit ohne wirksame Medikamente.
- Franz Kafkas Lungentuberkuloseerkrankung, an der er 1924 in einem österreichischen Sanatorium bei Wien verstarb, wird in dem biografischen Roman Die Herrlichkeit des Lebens von Michael Kumpfmüller (2011) thematisiert. In Franz Kafkas Parabel Auf der Galerie leidet die im ersten Teil erwähnte Kunstreiterin an Tuberkulose, dort „Lungensucht“ genannt. Franz Kafka litt zeitlebens an einer Tuberkuloseerkrankung.
- Der amerikanische Country-Musiker Jimmie Rodgers singt in mehreren Liedern über seine TB-Erkrankung, an der er 1933 im Alter von 35 Jahren verstarb (TB Blues, 1931; Whippin’ That Old TB, 1933).
- Joachim Ringelnatz, seine Tagebuchaufzeichnungen aus dem Tuberkulosekrankenhaus Waldhaus Charlottenburg, erschienen posthum, in Der Nachlaß, Berlin 1935
- Im 1967 veröffentlichten Lied T. B. Sheets schildert der nordirische Musiker Van Morrison das Leid eines jungen Mädchens, das auf der Tuberkulose-Abteilung eines Spitals im Sterben liegt, aus der Sicht ihres mit der Situation völlig überforderten Freundes.
- In John Schlesingers Film Asphalt-Cowboy (1969) siecht der Kleingauner Ratso – gespielt von Dustin Hoffman – an der Tuberkulose dahin.
- In dem Roman Das Tagebuch der Jutta S. von Inge Stolten werden ausführlich die Diagnose- und Therapiemethoden der 1950er Jahre beschrieben, inklusive eines längeren Luftkur-Aufenthalts der Hauptperson.
- Im Roman Les trois quarts du temps (Leben will ich) beschreibt Benoîte Groult die Behandlungsmethoden im Jahr 1945 bis zum Tod des erkrankten Jean-Marie.
- Der aus Frankreich stammende polnische Grafiker Józef Gielniak, der 1972 an Tuberkulose im Sanatorium verstarb, stellte in seinen Linolschnitten hauptsächlich das Thema Tuberkulose mit ihren gesundheitlichen und sozialen Folgen sowie die geschlossene Welt der Sanatorien künstlerisch dar.
- Einer trage des anderen Last … (1987), preisgekrönter Film der DEFA, Regie: Lothar Warneke: Zu Zeiten der DDR müssen sich ein Polizist und ein evangelischer Pfarrer ein Zimmer in einer Tuberkuloseklinik teilen. Dabei diskutieren sie über Gott, die Liebe, den Sinn des Lebens, den Tod und die Krankheit. Aus anfänglicher Abneigung wird Freundschaft.
- Thomas Bernhard, der selbst seit frühen Jahren an Tuberkulose litt, verarbeitete die Krankheit in beinahe allen Werken. Viele seiner Protagonisten sind Kranke und Leidende. Besonders deutlich wird das in seinen autobiographischen Bänden Die Kälte und Der Atem. Bernhard starb 1989 letztlich auch an den Folgen dieser Krankheit.
- John le Carré beschreibt im Roman Der ewige Gärtner eine im Jahr 2001 spielende Verschwörung eines multinationalen Unternehmens, das ein neuartiges, noch in der Entwicklung befindliches Mittel gegen Tuberkulose im Feldversuch an Einheimischen in Kenia ohne deren Wissen anwendet und dadurch ethische Grenzen überschreitet.
- Weitere Beispiele aus Literatur und Film sind in Romanen von Fjodor Dostojewski Ippolít Teréntjeff in Der Idiot und Katerina Iwanowna in Schuld und Sühne; Julika Stiller-Tschudy in Stiller (Roman von Max Frisch); Patrice Hollmann (Pat) in Erich Maria Remarques Roman Drei Kameraden; Lilian in Remarques Roman Der Himmel kennt keine Günstlinge; Ruby Gillis in Anne in Kingsport (Roman von Lucy Maud Montgomery); Red Stovall (gespielt von Clint Eastwood) in dem Film Honkytonk Man (USA 1982); Satine (gespielt von Nicole Kidman) in dem Film Moulin Rouge (USA 2001), nach Verdis Oper bzw. Dumas’ Roman, siehe oben.
- Angorichina ist ein 2011 erschienener Roman von Marion Grace Wolley über Menschen in einem Tuberkulose-Sanatorium in Australien in den 1930er Jahren.
- Im Film Winter’s Tale von 2014, mit dem Hauptdarsteller Colin Farrell, stirbt Beverly Penn, die Geliebte des Haupthelden, dargestellt von Jessica Brown Findlay, an Tuberkulose.
- Im Roman Ana in Venedig von João Silvério Trevisan leidet eine der Hauptfiguren, die schwarze ehemalige Sklavin Ana, in ihren letzten Lebensjahren an Tuberkulose.
- Im Videospiel Red Dead Redemption 2 erkrankt der Hauptcharakter im Laufe des Spiels an Tuberkulose.
Museum
Am 1. Dezember 2011 wurde im Rohrbacher Schlösschen in Heidelberg auf dem Gelände der Thorax-Klinik das Museum für Tuberkulose eröffnet. Es besteht zu einem großen Teil aus den Exponaten und der Fachliteratur des früheren Tuberkulose-Archivs in Fulda, das der Lungenfacharzt Robert Kropp leitete; es ist seit Anfang 2012 öffentlich zugänglich.[121][122]
Welttuberkulosetag
Jedes Jahr findet am 24. März der Welttuberkulosetag statt. Er wurde von der Weltgesundheitsorganisation (WHO) ausgerufen und wird von der Europäischen Arzneimittelagentur (EMA) unterstützt. Er soll das öffentliche Bewusstsein wachhalten und darauf hinweisen, dass die Tuberkulose in vielen Ländern der Welt, überwiegend in Entwicklungsländern, immer noch als Epidemie auftritt. Das Datum erinnert an den Tag, an dem Robert Koch 1882 erklärte, dass er den Erreger der Tuberkulose entdeckt habe.[64][123]
Literatur
19. Jahrhundert
- August Predöhl: Die Geschichte der Tuberkulose. Leipzig 1888; Neudruck: Sändig, Wiesbaden 1966.
20. Jahrhundert
- M. L. Holbrook: Die Verhütung, hygienische Behandlung und Heilung der Lungenschwindsucht. Concord, München 1900. (Digitalisat)
- Erich Stern: Die Psyche des Lungenkranken. Der Einfluß der Lungentuberkulose und des Sanatoriumslebens auf die Seele der Kranken. Halle an der Saale 1925.
- Kurt Lydtin: Lungentuberkulose als Indikationsgebiet. In: Reichsärztekammer (Hrsg.): Richtlinien für Schwangerschaftsunterbrechung und Unfruchtbarmachung aus gesundheitlichen Gründen. Bearbeitet von Hans Stadler. J. F. Lehmanns Verlag, München 1936, S. 58–79.
- Norman Meachen: A short history of tuberculosis. London 1936; Neudruck New York 1978.
- Richard Bochalli: Die Geschichte der Schwindsucht. Leipzig 1940.
- Wilhelm Roloff: Die Lungentuberkulose. Springer, Berlin / Göttingen / Heidelberg 1948.
- Wilhelm Roloff: Das Tuberkulose-Lexikon. 2. Auflage. Thieme, Stuttgart 1949.
- Walter Schaich: Die Tuberkulose. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. Auflage ebenda 1961, S. 224–308.
- Paul-Georg Schmidt: Die Lungentuberkulose – Diagnose und Therapie. Georg Thieme Verlag, Stuttgart,3. Auflage 1956
- Michel Oury: Geschichte der Tuberkulose. In: Illustrierte Geschichte der Medizin. Deutsche Bearbeitung von Richard Toellner, Salzburg 1980–1982 und als Sonderauflage ebenda 1986, Band V, S. 2734–2755.
Neuere Literatur
- T. Schaberg, T. Bauer, F. Brinkmann u. a.: S2k-Leitlinie: Tuberkulose im Erwachsenenalter. In: Pneumologie. Band 71, 2017, S. 325–397.
- Deutsche Gesellschaft für Pädiatrische Infektiologie e. V. (DGPI) (Hrsg.): Handbuch Infektionen bei Kindern und Jugendlichen. 4. Auflage. Futuramed, München 2003, ISBN 3-923599-90-0.
- Werner E. Gerabek: Lungentuberkulose. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 871 f.
- Juan Carlos Palomino, Sylvia Leão, Viviana Ritacco u. a.: Tuberculosis 2007. From basic science to patient care. (PDF; 8,3 MB) TuberculosisTextbook.com, Gewinner des Amedeo Textbook Award (englisch), gut bebilderte Übersicht
- Peter D. Davies, Peter Barnes, Stephen B. Gordon: Clinical Tuberculosis. Hodder Arnold Publishers, 2008, ISBN 978-0-340-94840-8.
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 238–245.
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (Hrsg.): 100 Jahre deutsche Pneumologie. Springer, Berlin / Heidelberg 2010, ISBN 978-3-642-11453-3.
- Christine Wolters: Tuberkulose und Menschenversuche im Nationalsozialismus. Das Netzwerk hinter den Tbc-Experimenten im Konzentrationslager Sachsenhausen. Steiner, Stuttgart 2011, ISBN 978-3-515-09399-6.
- Jörg Braun: Infektionskrankheiten. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 437–519, hier: S. 462 f. (Tuberkulose).
- Ulrike Moser: Schwindsucht. Eine andere deutsche Gesellschaftsgeschichte. Matthes und Seitz, Berlin 2018, ISBN 978-3-95757-556-2.
Aufsätze in Zeitschriften
- Hans Gertler: Geschichtliches zur Diagnostik und Therapie der Tuberkulose. In: Medizinische Monatsschrift 11, 1957, S. 386–388.
- American Thoracic Society: Diagnostic Standards and Classification of Tuberculosis in Adults and Children. In: American journal of respiratory and critical care medicine. Nr. 161, 2000, S. 1376–1395. PMID 10764337
- Flurin Condrau: Behandlung ohne Heilung. Zur sozialen Konstruktion des Behandlungserfolges bei Tuberkulose im frühen 20. Jahrhundert. In: Medizin, Gesellschaft und Geschichte. Band 19, 2000, S. 71–94.
- B. Hauer, D. Rohde, R. Loddenkemper: Tuberkulose. In: Der Pneumologe. Nr. 4, Heidelberg 2005, S. 291–306, ISSN 1613-5636
- Horst Kremling: Historische Betrachtungen zur präventiven Heilkunde. In: Würzburger medizinhistorische Mitteilungen. 24, 2005, S. 222–260, hier S. 225–227.
- Peter-Philipp Schmitt: Erreger hinter Stacheldraht. In: Frankfurter Allgemeine Zeitung. 13. April 2007, S. 9.
- S. Ahmad: Pathogenesis, immunology, and diagnosis of latent Mycobacterium tuberculosis infection. In: Clinical and Developmental Immunology. Vol. 2011, 2011, S. 814943, doi:10.1155/2011/814943, PMID 21234341, PMC 3017943 (freier Volltext).
- K. Luong, L. T. Nguyen: Impact of vitamin D in the treatment of tuberculosis. In: The American journal of the medical sciences. Band 341, Nr. 6, Juni 2011, S. 493–498. doi:10.1097/MAJ.0b013e3182070f47, PMID 21289501. (Review).
- S. H. Kaufmann: Fact and fiction in tuberculosis vaccine research: 10 years later. In: The Lancet Infectious Diseases. Band 11, Nr. 8, August 2011, S. 633–640. doi:10.1016/S1473-3099(11)70146-3, PMID 21798463. (Review).
- M. Möller, E. G. Hoal: Current findings, challenges and novel approaches in human genetic susceptibility to tuberculosis. In: Tuberculosis. Band 90, Nr. 2, März 2010, S. 71–83. doi:10.1016/j.tube.2010.02.002, PMID 20206579. (Review).
- Thaddäus Zajaczkowski: Genitourinary tuberculosis: historical and basic science review: past and present. In: Central European Journal of Urology, 65, 2012, S. 182–187.
- Urs Ehehalt: Tbc – weltweit verbreitet. In: Hamburger Ärzteblatt, 10/2014, S. 12–15.
- Rüdiger Döhler, Loukas Konstantinou: Die Skelett-Tuberkulose – eine der ältesten Erkrankungen der Menschheit. In: Chirurgische Allgemeine, 16. Jg., 10. Heft (2015), S. 556–558.
- Isabelle Suárez u. a.: Diagnostik und Therapie der Tuberkulose. In: Deutsche Ärzteblatt. Band 116, Heft 43, 25. Oktober 2019, S. 729–735.
Rundfunkbericht
- Claudia Doyle, Mathias Tertilt: Kampf gegen Tuberkulose in Indien – „Wir werden die Seuche beenden“, Deutschlandfunk – Wissenschaft im Brennpunkt vom 11. Februar 2018
Weblinks
- Tuberkulose – Informationen des Robert Koch-Instituts
- DZK e.V. – Deutsches Zentralkomitee zur Bekämpfung der Tuberkulose: www.dzk-tuberkulose.de
- Website des Nationalen Referenzzentrums für Mykobakterien am Forschungszentrum Borstel
- Bilder der Tuberculosis cutis luposa-Veränderungen bei DermIS
- Bilder der Tuberculosis cutis verrucosa-Veränderungen bei DermIS
- Bilder der Tuberculosis primaria cutis-Veränderungen bei DermIS
- Tb-spezifische Seite. WHO-Regionalbüro für Europa
- stoptb.org – Initiative Stopp der Tb (englisch) abgerufen am 8. November 2009
- Tuberculosis in Europe and North America, 1800–1922. Harvard University Library, Open Collections Program, Contagion, Historical Views of Diseases and Epidemics
- Deutsche Lepra- und Tuberkulosehilfe e. V.
- Kompetenzzentrum Tuberkulose (Schweiz)
- Deutsche Lungenstiftung
- Detaillierte Informationen zu Tuberkulose bei HIV-Patienten
- Tuberkulose. Lungeninformationsdienst.de
- Zeitschriftenbestand des Deutschen Tuberkulose Archives (2009). (PDF; 296 kB)
- Carola Otterstedt: Die Kinder von Scheidegg. (Berichte aus einer Kinderheilstätte für Lungen- und Knochentuberkulose, Dokumentation).
- Tuberkulose – Informationen des Bundesamts für Gesundheit (Schweiz)
Anmerkungen
- Die Tuberkulose gilt als AIDS-definierende Erkrankung. Jörg Braun (2016), S. 462.
- Global tuberculosis report 2016. (PDF) WHO, S. 1, abgerufen am 11. Juni 2017.
- Vgl. etwa Thomas Schlich: Ein Symbol medizinischer Fortschrittshoffnung: Robert Koch entdeckt den Erreger der Tuberkulose. In: Heinz Schott (Hrsg.): Meilensteine der Medizin. Harenberg, Dortmund 1996, ISBN 3-611-00536-3, S. 368–374, 620 f. und 660.
- Brachten Einwanderer den „Weißen Tod“ zu uns? News.de vom 10. November 2015.
- Max Höfler: Deutsches Krankheitsnamen-Buch. München 1899, S. 93 und 99.
- Matthias Kreienkamp: Das St. Georgener Rezeptar. Ein alemannisches Arzneibuch des 14. Jahrhunderts aus dem Karlsruher Kodex St. Georgen 73, Teil II: Kommentar (A) und textkritischer Vergleich, Medizinische Dissertation Würzburg 1992, S. 68 f.
- Apoorva Mandavilli: Tuberculosis, Like Covid, Spreads by Breathing, Scientists Report. In: The New York Times. 19. Oktober 2021, ISSN 0362-4331 (nytimes.com [abgerufen am 20. Oktober 2021]).
- J. T. Lejeune, P. J. Rajala-Schultz: Food safety: unpasteurized milk: a continued public health threat. In: Clinical Infectious Diseases. Band 48, Nummer 1, Januar 2009, S. 93–100. doi:10.1086/595007. PMID 19053805. (Review).
- Fact sheet Tuberculosis. WHO, Stand: Oktober 2019; abgerufen am 31. Dezember 2019.
- V. Bordignon, S. Bultrini u. a.: High prevalence of latent tuberculosis infection in autoimmune disorders such as psoriasis and in chronic respiratory diseases, including lung cancer. In: Journal of biological regulators and homeostatic agents. Band 25, Nr. 2, Apr-Jun 2011, S. 213–220. PMID 21880210.
- Bericht zur Epidemiologie der Tuberkulose in Deutschland für 2016. (PDF) (Nicht mehr online verfügbar.) Robert Koch-Institut, 2018, S. 112, ehemals im Original; abgerufen am 26. März 2018. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Bundesblatt N° 27, 10. Juli 1947 (Angabe für 1940)
- H. P. Pöhn, G. Rasch: Statistik meldepflichtiger Erkrankungen. BGA Schriften 5/1993, MMV Verlag, München, 1004.
- Robert Koch-Institut: Archiv der Berichte zur Epidemiologie der Tuberkulose in Deutschland (seit 2001). Abgerufen am 1. November 2021.
- Tuberkulose. RKI-Ratgeber für Ärzte. Robert Koch-Institut, abgerufen am 13. November 2011.
- RKI-Bericht zur Epidemiologie der Tuberkulose in Deutschland für 2011. (PDF) Robert Koch-Institut, abgerufen am 18. März 2013.
- Keine Entwarnung bei der Tuberkulose. In: Deutsches Ärzteblatt, 18. März 2013.
- Epidemiologisches Bulletin des RKI Nr. 3/2020 (PDF; 2,5 MB) 16. Januar 2020
- Nationale Referenzzentrale für Tuberkulose. (PDF; 1,6 MB) Jahresbericht 2018. Bundesministerium Arbeit, Soziales, Gesundheit und Kosumentenschutz, abgerufen am 1. November 2021.
- Zahlen zu Infektionskrankheiten. Tuberkulose. Bundesamt für Gesundheit, abgerufen am 1. November 2021.
- A. Koul u. a.: The challenge of new drug discovery for tuberculosis. In: Nature. Band 469, Nr. 7331, 2011, S. 483–490, PMID 21270886.
- R. Riley: Aerial dissemination of pulmonary tuberculosis. In: Am Rev Tuberc. Band 76, Nr. 5980, 1957, S. 931–941, PMID 13488004.
- Deutsche Gesellschaft für Pädiatrische Infektiologie e. V. (DGPI) (Hrsg.): Handbuch Infektionen bei Kindern und Jugendlichen. 4. Auflage. Futuramed, München 2003, ISBN 3-923599-90-0.
- Walter Schaich: Die Tuberkulose. 1961, S. 282 (Das Tuberkulom der Lunge.).
- J. L. Flynn, M. M. Goldstein, J. Chan u. a.: Tumor necrosis factor-alpha is required in the protective immune response against Mycobacterium tuberculosis in mice. In: Immunity. Band 2, Nr. 6, Juni 1995, S. 561–572, PMID 7540941.
- S. T. Cole u. a.: Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. In: Nature. Nr. 393, London 1998, S. 537–554. PMID 9634230.
- Walter Schaich: Die Tuberkulose. 1961, S. 251–254.
- T. Ulrichs u. a.: Immunologie der Tuberkulose und neue Impfstoffansätze. In: Monatsschrift Kinderheilkunde. Nr. 154, Springer, Berlin 2006, ISSN 0026-9298, S. 132–141.
- Walter Schaich: Die Tuberkulose. 1961, S. 233 f. und 265 f.
- Berthold Jany, Tobias Welte: Pleuraerguss des Erwachsenen – Ursachen, Diagnostik und Therapie. In: Deutsches Ärzteblatt. Band 116, Nr. 21, (Mai) 2019, S. 377–385, hier: S. 379–383.
- K. Magdorf: Tuberkulose im Kindesalter. Pathogenese, Prävention, Klinik und Therapie. In: Monatsschrift Kinderheilkunde. Nr. 154, Springer, Berlin 2006, ISSN 0026-9298, S. 124–132.
- Karl Wurm, A. M. Walter: Infektionskrankheiten. 1961, S. 131.
- Karl Wurm, A. M. Walter: Infektionskrankheiten. 1961, S. 131.
- Walter Schaich: Die Tuberkulose. 1961, S. 281 f.
- Ludwig Heilmeyer, Wolfgang Müller: Die rheumatischen Erkrankungen. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. Auflage ebenda 1961, S. 309–351, hier: S. 322.
- A. Poncet: Polyarthrite tuberculeuse simulant des lésions rhumatismales chroniques déformantes. In: Gaz. Hôp. Band 70, (Paris) 1897, S. 1219.
- Barbara I. Tshisuaka: Poncet, Antonin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1175.
- Walter Schaich: Die Tuberkulose. 1961, S. 286–289.
- Gerald Metz: Das Archiv der Würzburger Universitätsklinik für Haut- und Geschlechtskrankheiten und seine Bestände. In: Würzburger medizinhistorische Mitteilungen. Band 9, 1991, S. 37–55, hier: S. 47, 50.
- Walter Schaich: Die Tuberkulose. 1961, S. 291 f.
- S. Jodra, C. Alvarez: Images in clinical medicine. Pott’s disease of the thoracic spine. In: N Engl J Med. 368(8), 2013, S. 756. doi:10.1056/NEJMicm1207442. PMID 23425168.
- Rüdiger Döhler, Loukas Konstantinou: Die Skelett-Tuberkulose – eine der ältesten Erkrankungen der Menschheit. In: Chirurgische Allgemeine. 16. Jahrgang, 10. Heft (2015), S. 556–558.
- Walter Schaich: Die Tuberkulose. 1961, S. 283–285.
- Walter Schaich: Die Tuberkulose. 1961, S. 289 f.
- A. Müller, R. W. Schlecht, Alexander Früh, H. Still Der Weg zur Gesundheit: Ein getreuer und unentbehrlicher Ratgeber für Gesunde und Kranke. 2 Bände, (1901; 3. Auflage 1906, 9. Auflage 1921) 31. bis 44. Auflage. C. A. Weller, Berlin 1929 bis 1931, Band 2 (1929), S. 266 f.
- Walter Schaich: Die Tuberkulose. 1961, S. 285 f.
- Ravikran Orgole: Textbook of Oral Medicine, Oral Diagnosis and Oral Radiology, Elsevier Health Services, 2014, S. 215.
- A. Detjen u. a.: Immunologische Diagnostik der Tuberkulose – Interferon-γ-Tests. In: Monatsschrift Kinderheilkunde. Nr. 154, Springer, Berlin 2006, ISSN 0026-9298, S. 152–159.
- D. D. Singh, M. Vogel u. a.: TB or not TB? Difficulties in the diagnosis of tuberculosis in HIV-negative immigrants to Germany. In: European journal of medical research. Band 16, Nr. 9, Sept. 2011, S. 381–384. PMID 22024436.
- Handlungsempfehlung für den Umgang mit Patienten mit vermuteter Tuberkulose der GPR
- H. J. Zar u. a.: Induced sputum versus gastric lavage for microbiological confirmation of pulmonary tuberculosis in infants and young children, a prospective study. In: The Lancet. Vol. 365, Nr. 9454, London 2005, S. 130–134. PMID 15639294.
- M. Pwiwitzer u. a.: Falsch-positiver Interferon-γ-Test? In: Pneumologie. 2007.
- Nina Pollock u. a.: Screening Health Care Workers with Quantiferon-Gold: Possible False Negative Results in Individuals with High Pre-Test Probability of Latent Tuberculosis Infection. In: Chest. 2007.
- Matthew P. R. Berry, Christine M. Graham, Finlay W. McNab, Zhaohui Xu, Susannah A. A. Bloch u. a.: An interferon-inducible neutrophil-driven blood transcriptional signature in human tuberculosis. In: Nature. Vol. 466, 19. August 2010, S. 973–977 (Abstract als html).
- J. van Ingen, R. E. Aarnoutse u. a.: Why Do We Use 600 mg of Rifampicin in Tuberculosis Treatment? In: Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. Band 52, Nr. 9, Mai 2011, S. e194–e199. doi:10.1093/cid/cir184, PMID 21467012 (Review).
- R. Tasneen, S. Y. Li u. a.: Sterilizing activity of novel TMC207- and PA-824-containing regimens in a murine model of tuberculosis. In: Antimicrobial Agents and Chemotherapy. Band 55, Nr. 12, Dez. 2011, S. 5485–5492. doi:10.1128/AAC.05293-11. PMID 21930883. PMC 3232786 (freier Volltext).
- Tuberkulose – Merkblatt für Ärzte. (Memento vom 29. September 2007 im Internet Archive) Robert Koch-Institut
- Marianne Abele-Horn (2009), S. 239.
- M. Lee, J. Lee u. a.: Linezolid for treatment of chronic extensively drug-resistant tuberculosis. In: The New England Journal of Medicine. Band 367, Nummer 16, Oktober 2012, S. 1508–1518. doi:10.1056/NEJMoa1201964. PMID 23075177. PMC 3814175 (freier Volltext).
- S. Heinzl: Antibiotikatherapie der Tuberkulose: Linezolid bei hochresistenten Erregern. In: Dtsch Arztebl. 109(49), 2012, S. A-2467 / B-2020 / C-1976.
- FDA advisory panel backs J&J TB drug, Reuters, 29. November 2012.
- K. Williams, A. Minkowski u. a.: Sterilizing activities of novel combinations lacking first- and second-line drugs in a murine model of tuberculosis. In: Antimicrobial agents and chemotherapy. Band 56, Nummer 6, Juni 2012, S. 3114–3120. doi:10.1128/AAC.00384-12. PMID 22470112. PMC 3370712 (freier Volltext).
- Summary of the European public assessment report (EPAR) for Sirturo – Bedaquiline, EPAR der EMA, abgerufen am 7. April 2014.
- World TB Day – three new medicines recommended in last six months for patients with multidrug-resistant tuberculosis, Meldung der EMA anlässlich des World TB Day am 21. März 2014, abgerufen am 7. April 2014.
- Deltyba – Delamanid, Meldung der EMA anlässlich des positiven Votums des CHMP am 21. November 2013, abgerufen am 7. April 2014.
- Para-aminosalicylic acid Lucane, Meldung der EMA anlässlich des positiven Votums des CHMP am 21. November 2013, abgerufen am 7. April 2014.
- Summary of the European public assessment report (EPAR) for Deltyba delamanid, EPAR der EMA, abgerufen am 22. Mai 2014.
- Summary of the European public assessment report (EPAR) for Para-aminosalicylic acid Lucane, EPAR der EMA, abgerufen am 22. Mai 2014.
- S. Yaldiz, S. Gursoy u. a.: Surgery offers high cure rates in multidrug-resistant tuberculosis. In: Ann Thorac Cardiovasc Surg. Band 17, Nr. 2, April 2011, S. 143–147. PMID 21597410.
- L. Amaral, A. Martins, G. Spengler, A. Hunyadi, J. Molnar: The Mechanism by which the Phenothiazine Thioridazine Contributes to Cure Problematic Drug-Resistant Forms of Pulmonary Tuberculosis: Recent Patents for „New Use“. In: Recent patents on anti-infective drug discovery. [elektronische Veröffentlichung vor dem Druck] Dezember 2013, PMID 24320229.
- L. Amaral, M. Viveiros: Why thioridazine in combination with antibiotics cures extensively drug-resistant Mycobacterium tuberculosis infections. In: International journal of antimicrobial agents. Band 39, Nummer 5, Mai 2012, S. 376–380. doi:10.1016/j.ijantimicag.2012.01.012. PMID 22445204.
- S. Sharma, A. Singh: Phenothiazines as anti-tubercular agents: mechanistic insights and clinical implications. In: Expert opinion on investigational drugs. Band 20, Nummer 12, Dezember 2011, S. 1665–1676. doi:10.1517/13543784.2011.628657. PMID 22014039.
- K. Magdorf u. a.: Tuberkulose. In: Leitlinien Pädiatrie. München 2006, ISBN 3-437-22060-8.
- T. Schön, J. Idh u. a.: Effects of a food supplement rich in arginine in patients with smear positive pulmonary tuberculosis–a randomised trial. In: Tuberculosis. Band 91, Nummer 5, September 2011, S. 370–377. doi:10.1016/j.tube.2011.06.002. PMID 21813328.
- A. P. Ralph, P. M. Kelly, N. M. Anstey: L-arginine and vitamin D: novel adjunctive immunotherapies in tuberculosis. In: Trends Microbiol. Band 16, Nr. 7, Juli 2008, S. 336–344, doi:10.1016/j.tim.2008.04.003, PMID 18513971.
- L. T. Ho-Pham, N. D. Nguyen, T. T. Nguyen u. a.: Association between vitamin D insufficiency and tuberculosis in a Vietnamese population. In: BMC Infect. Dis. Band 10, 2010, S. 306, doi:10.1186/1471-2334-10-306, PMID 20973965, PMC 2978214 (freier Volltext).
- M. Fabri, S. Stenger u. a.: Vitamin D is required for IFN-gamma-mediated antimicrobial activity of human macrophages. In: Science Translational Medicine. Band 3, Nummer 104, Oktober 2011, S. 104ra102. doi:10.1126/scitranslmed.3003045. PMID 21998409. PMC 3269210 (freier Volltext).
- Tuberkulose: Vitamin D beschleunigt Antibiotikawirkung. In: Deutsches Ärzteblatt. 5. September 2012.
- A. K. Coussens, R. J. Wilkinson u. a.: Vitamin D accelerates resolution of inflammatory responses during tuberculosis treatment. In: Proceedings of the National Academy of Sciences. Band 109, Nummer 38, September 2012, S. 15449–15454. doi:10.1073/pnas.1200072109. PMID 22949664. PMC 3458393 (freier Volltext).
- S. Subbian, L. Tsenova u. a.: Phosphodiesterase-4 inhibition alters gene expression and improves isoniazid-mediated clearance of Mycobacterium tuberculosis in rabbit lungs. In: PLOS Pathogens. Band 7, Nummer 9, September 2011, S. e1002262. doi:10.1371/journal.ppat.1002262. PMID 21949656. PMC 3174258 (freier Volltext).
- K. J. Welsh, S. A. Hwang u. a.: Lactoferrin modulation of mycobacterial cord factor trehalose 6-6'-dimycolate induced granulomatous response. In: Translational research: the journal of laboratory and clinical medicine. Band 156, Nummer 4, Oktober 2010, S. 207–215. doi:10.1016/j.trsl.2010.06.001. PMID 20875896. PMC 2948024 (freier Volltext).
- McGill University: The Online TST/IGRA Interpreter. Abgerufen am 24. März 2014.
- P. Andersen, T. M. Doherty: The success and failure of BCG – implications for a novel tuberculosis vaccine. In: Nature reviews. Microbiology. Band 3, Nr. 8, August 2005, S. 656–662. doi:10.1038/nrmicro1211, PMID 16012514. (Review).
- BCG: bad news from India. In: Lancet. Band 1, Nummer 8159, Januar 1980, S. 73–74. PMID 6101419.
- L. Grode, C. A. Ganoza, C. Brohm, J. Weiner, B. Eisele, S. H. Kaufmann: Safety and immunogenicity of the recombinant BCG vaccine VPM1002 in a phase 1 open-label randomized clinical trial. In: Vaccine. 2012, doi:10.1016/j.vaccine.2012.12.053, PMID 23290835.
- MPG: Impfstoff-Kandidat gegen Tuberkulose in Phase-II/III-Studie
- M. D. Tameris, M. Hatherill, B. S. Landry, T. J. Scriba, M. A. Snowden, S. Lockhart, J. E. Shea, J. B. McClain, G. D. Hussey, W. A. Hanekom, H. Mahomed, H. McShane: Safety and efficacy of MVA85A, a new tuberculosis vaccine, in infants previously vaccinated with BCG: a randomised, placebo-controlled phase 2b trial. In: The Lancet. doi:10.1016/S0140-6736(13)60177-4.
- AERAS Developing new tuberculosis vaccines for the world
- J. C. Lorenzi, A. P. Trombone, C. D. Rocha u. a.: Intranasal vaccination with messenger RNA as a new approach in gene therapy: use against tuberculosis. In: BMC Biotechnol. Band 10, 2010, S. 77, doi:10.1186/1472-6750-10-77, PMID 20961459, PMC 2972232 (freier Volltext).
- Elisa Nemes, Hennie Geldenhuys, Virginie Rozot, Kathryn T. Rutkowski, Frances Ratangee: Prevention of M. tuberculosis Infection with H4:IC31 Vaccine or BCG Revaccination. In: New England Journal of Medicine. 11. Juli 2018, doi:10.1056/NEJMoa1714021, PMID 29996082, PMC 5937161 (freier Volltext) – (nejm.org [abgerufen am 21. Dezember 2018]).
- JT Belisle, VD Vissa, T Sievert, K Takayama, PJ Brennan, GS Besra: Role of the major antigen of Mycobacterium tuberculosis in cell wall biogenesis. In: Science. Band 276, 1997, S. 1420–1422.
- Tuberkulose: RKI-Ratgeber. Meldepflicht gemäß IfSG. In: rki.de. Robert Koch-Institut, 21. Februar 2013, abgerufen am 15. März 2020.
- Tuberkulose: RKI-Ratgeber. Benachrichtigungspflicht gemäß IfSG. In: rki.de. Robert Koch-Institut, 21. Februar 2013, abgerufen am 15. März 2020.
- Meldepflichtige Tierkrankheiten. Bundesministerium für Ernährung und Landwirtschaft (BMEL), 2. August 2019, abgerufen am 16. März 2020.
- Anzeigepflichtige Tierseuchen. Bundesministerium für Ernährung und Landwirtschaft (BMEL), 2. August 2019, abgerufen am 14. März 2020.
- Gesamte Rechtsvorschrift des Tuberkulosegesetzes in der jeweils aktuell geltenden Fassung.
- Der Schweizerische Bundesrat: Tierseuchenverordnung (TSV). In: admin.ch. Abgerufen am 16. März 2020 (Schweizer Hochdeutsch, vom 27. Juni 1995 (Stand am 1. Januar 2020)).
- Tuberkulose beim Tier und beim Menschen. Bundesamt für Lebensmittelsicherheit und Veterinärwesen BLV, 10. März 2010, abgerufen am 16. März 2020 (Schweizer Hochdeutsch): „Die Tuberkulose ist eine auszurottende und somit meldepflichtige Tierseuche. Wer Tiere hält oder betreut, muss Verdachtsfälle dem Bestandestierarzt oder der Bestandestierärztin melden. […]“
- T. A. Gous, M. C. Williams: The pathology of tuberculosis caused by Mycobacterium tuberculosis in a herd of semi-free-ranging springbok (Antidorcas marsupialis). In: Onderstepoort J. Vet. Res. Band 76, Nr. 4, Dezember 2009, S. 419–441, PMID 21344792.
- R. Murphree, J. V. Warkentin u. a.: Elephant-to-human transmission of tuberculosis, 2009. In: Emerging Infectious Diseases. Band 17, Nr. 3, März 2011, S. 366–371. PMID 21392425.
- Verordnung über anzeigepflichtige Tierseuchen in der Fassung der Bekanntmachung vom 19. Juli 2011 (BGBl. I S. 1404), geändert durch Artikel 3 der Verordnung vom 3. Mai 2016 (BGBl. I S. 1057)
- Meldepflichtige Tierkrankheiten auf der Webseite des Bundesministeriums für Ernährung und Landwirtschaft, abgerufen am 19. März 2020
- Anlage zu § 1 der Verordnung über meldepflichtige Tierkrankheiten (TKrMeldpflV) in der Fassung der Bekanntmachung vom 11. Februar 2011 (BGBl. I S. 252), zuletzt geändert durch Artikel 381 der Verordnung vom 31. August 2015 (BGBl. I S. 1474)
- Chemisches und Veterinäruntersuchungsamt (CVUA) Stuttgart: Pseudotuberkulose- (Corynebacterium pseudotuberculosis) Infektionen im Vormarsch.
- J. Kappelman, M. C. Alçiçek u. a.: First Homo erectus from Turkey and implications for migrations into temperate Eurasia. In: American journal of physical anthropology. Band 135, Nr. 1, Januar 2008, S. 110–116. doi:10.1002/ajpa.20739, PMID 18067194.
- Stefan Weller: Ältester Tuberkulose-Nachweis beim Menschen? Universitätsmedizin Göttingen – Georg-August-Universität, Pressemitteilung vom 23. April 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 20. Dezember 2014.
- I. Hershkovitz, H. D. Donoghue u. a.: Detection and molecular characterization of 9,000-year-old Mycobacterium tuberculosis from a Neolithic settlement in the Eastern Mediterranean. In: PloS one. Band 3, Nr. 10, 2008, S. e3426. doi:10.1371/journal.pone.0003426, PMID 18923677. PMC 2565837 (freier Volltext).
- Bruce M. Rothschild, Larry D. Martin, Galit Lev, Helen Bercovier, Gila Kahila Bar-Gal, Charles Greenblatt, Helen Donoghue, Mark Spigelman, David Brittain: Mycobacterium tuberculosis Complex DNA from an Extinct Bison Dated 17,000 Years before the Present. In: Clin Infect Dis. 33 (3), 2001, S. 305–311. doi:10.1086/321886.
- Evert Dirk Baumann: De phthisi antiqua. In: Janus 34, 1930, S. 209–225 und 253–272.
- Hippocrates: Epidemien.
- Walter von Brunn: Paracelsus und seine Schwindsuchtlehre. Leipzig 1941.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 7.
- Martin Risch: Todesursachen-Statistik der Gemeinde Triesen von 1831 bis 1930. In: Jahrbuch des Historischen Vereins für das Fürstentum Liechtenstein. Band 36, 1936, S. 54.
- Christoph Weißer: Thoraxchirurgie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1397.
- Zur Kollapstherapie der Lungentuberkulose vgl. auch Walter Schaich: Die Tuberkulose. 1961, S. 305–307.
- Barbara I. Tshisuaka: Tuffier, Théodore. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1424.
- Albrecht Scholz: Lupus vulgaris. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 872 f., hier: S. 873.
- Ferdinand Sauerbruch, Hans Rudolf Berndorff: Das war mein Leben. Kindler & Schiermeyer, Bad Wörishofen 1951; zitiert: Lizenzausgabe für Bertelsmann Lesering, Gütersloh 1956, S. 180–286.
- Vgl. zu den Aktivitäten der Kommunen Quellensammlung zur Geschichte der deutschen Sozialpolitik 1867 bis 1914, III. Abteilung: Ausbau und Differenzierung der Sozialpolitik seit Beginn des Neuen Kurses (1890–1904), 7. Band, Armenpflege und kommunale Wohlfahrtspolitik, bearbeitet von Wilfried Rudloff, Darmstadt 2016.
- Md Abdul Kuddus, Emma S. McBryde, Oyelola A. Adegboye: Delay effect and burden of weather-related tuberculosis cases in Rajshahi province, Bangladesh, 2007–2012. In: Scientific Reports. Band 9, Nr. 1, 3. September 2019, ISSN 2045-2322, S. 12720, doi:10.1038/s41598-019-49135-8 (nature.com [abgerufen am 19. September 2020]).
- tb-archiv.de
- Eckart Roloff, Karin Henke-Wendt: Alte Krankheit mit neuen Problemen. (Das Deutsche Tuberkulose-Archiv und Museum) In: Besuchen Sie Ihren Arzt oder Apotheker. Eine Tour durch Deutschlands Museen für Medizin und Pharmazie. Band 2: Süddeutschland. Verlag S. Hirzel, Stuttgart 2015, ISBN 978-3-7776-2511-9, S. 51–53.
- Stop TB Partnership. The missed three million. Meldung zum Welttuberkulosetag am 24. März 2014; abgerufen am 8. April 2014.