Flammenfärbung
Die Flammenfärbung, auch Flammprobe genannt, ist eine Methode zur Analyse von chemischen Elementen oder deren Ionen (Nachweisreaktion). Die Methode beruht darauf, dass die Elemente oder Ionen in einer farblosen Flamme Licht spezifischer Wellenlängen abgeben, die für jedes Element charakteristisch sind. Die Flammenfärbung entsteht durch Energieumwandlung von Wärmeenergie zu Strahlungsenergie. Die Umwandlung kommt durch Valenzelektronen zustande, die durch die Wärmeenergie in einen angeregten Zustand gehoben werden und unter der Abgabe von Licht wieder zurückfallen. Es findet dabei jedoch keine chemische Reaktion im eigentlichen Sinne einer Elektronenbindung statt. Stoffe, mit denen Flammenfärbung möglich ist, finden aufgrund dieser Eigenschaft in der Pyrotechnik Anwendung.

Bei der Flammenfärbung wird die Stoffprobe meist einfach auf einem Platindraht oder einem Magnesiastäbchen in die farblose Flamme eines Bunsenbrenners gehalten. Aufgrund der Farbe kann nun auf die Ionen in der Probe rückgeschlossen werden, allerdings überdeckt die sehr intensive gelbe Flammenfärbung des Natriums oft alle anderen Flammenfärbungen. Mit Sicherheit kann nur mit Hilfe eines Spektroskops entschieden werden, welche Elemente in der Probe vorliegen, zumal beispielsweise die Flammenfärbungen von Kalium und Rubidium recht ähnlich sind.
Zu unterscheiden ist die Flammenfärbung von der Lichtabgabe der Edelgase, die auch auf einem angeregten Zustand basiert, welche aber durch Strom, nicht durch eine Flamme herbeigeführt wird.
Die Brennprobe, bei der auch der Geruch geprüft wird, ist ein weiteres Verfahren zur Bestimmung eines unbekannten Werkstoffes, insbesondere für Faserstoffe und Kunststoffe.
Physikalische Ursachen
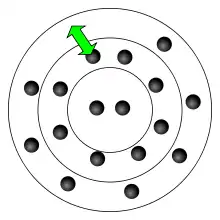
Alle Elemente senden bei hohen Temperaturen Licht aus. Doch für Elemente, die eine Flammenfärbung aufweisen, geschieht dies schon bei den Temperaturen, die in einer Flamme herrschen.
Die Elektronen eines Atoms werden durch Zufuhr von Wärmeenergie, die in diesem Fall durch eine Verbrennung entsteht, auf ein vom Atomkern weiter entferntes Energieniveau – in einen angeregten Zustand – gehoben. Diese Elektronen besitzen nun eine höhere potentielle Energie. Die negativ geladenen Elektronen fallen aber meist in Sekundenbruchteilen wieder auf das energieärmere Ausgangs-Energieniveau zurück. Die beim Zurückfallen frei werdende Energie wird als Photon abgegeben. Man spricht von einem Quant. Es ist durch eine genau definierte Energie und somit auch mit einer einzigen Wellenlänge gekennzeichnet.
Das Zurückfallen der Elektronen auf energieärmere Energieniveaus kann auch stufenweise erfolgen. Bei jedem Zurückfallen dieses Elektrons auf ein energieärmeres Energieniveau gibt es nun Licht einer ganz bestimmten Wellenlänge, und damit einer ganz bestimmten Farbe und Energie, ab.
Die freigegebene Lichtenergie hängt von der Differenz der Energieniveaus ab. Diese Differenz ist für jedes Element unterschiedlich. Die Energie der Photonen bestimmt ihre Frequenz und damit die Farbe.
Weist ein Element eine spezifische Flammenfärbung auf, dann weisen auch viele Verbindungen seiner Ionen diese Flammenfärbung auf. Dies ist jedoch nicht immer der Fall. Bariumsulfat z. B. weist eine grünliche Flammenfärbung auf, Bariumphosphat nicht. Sehr viele Elemente senden bei hohen Temperaturen sichtbare Spektrallinien aus. Einige Elemente wurden sogar nach der Farbe ihrer bei der Flammenfärbung beobachteten Spektrallinien benannt: Caesium (lateinisch: himmelblau), Rubidium (lateinisch: dunkelrot) und Indium (indigoblaue Spektrallinie).
Beispiele
Alkalimetalle
Alkalimetalle und ihre Salze besitzen eine spezifische Flammenfärbung:[1]
- Lithium und seine Salze färben die Flamme rot (671 nm).
- Natrium und seine Salze färben die Flamme gelb (589 nm).
- Kalium und seine Salze färben die Flamme violett (768 und 404 nm).
- Rubidium und seine Salze färben die Flamme rot (780 und 421 nm).
- Caesium und seine Salze färben die Flamme blauviolett (458 nm).
Erdalkalimetalle
Die typischen Erdalkalimetalle und ihre Salze besitzen eine spezifische Flammenfärbung:[1]
- Calcium und seine Salze färben die Flamme orange-rot (622 und 553 nm).
- Strontium und seine Salze färben die Flamme rot (675 und 606 nm).
- Barium und seine Salze färben die Flamme grün (524 und 514 nm).
Verwendung
Die Flammenfärbung kann für die Beilsteinprobe verwendet werden.
Moderne Techniken
Bessere Möglichkeiten als die klassische Flammenfärbung mit Hilfe des Auges bieten die spektroskopischen Verfahren der Atomspektroskopie, die eine Art Weiterentwicklung dieser mit Hilfe von Messinstrumenten darstellen. Das Auge wird hier durch das Spektrometer ersetzt, welches die Lage der Spektrallinien sehr viel besser auflöst, sowie auch die nicht sichtbaren Bereiche des elektromagnetischen Spektrums je nach Spektroskopieart (z. B. IR- oder UV/VIS-Spektroskopie) zur Analyse nutzt. Außerdem ist das Spektrometer anders als beim subjektiven Eindruck durch das Auge in der Lage, die Stärke der Spektrallinien zu bestimmen, wodurch eine quantitative Analyse möglich wird.
Literatur
- W. Biltz, W. Fischer, Ausführung qualitativer Analysen anorganischer Stoffe, 16. Auflage, Harri Deutsch, Frankfurt am Main, 1976.
- G. Jander, E. Blasius, Einführung in das anorganisch chemische Grundpraktikum, 14. Auflage, S. Hirzel Verlag, Stuttgart, 1995, ISBN 3-7776-0672-3.
Weblinks
- Spektrallinien der Alkalimetalle (Memento vom 4. März 2008 im Internet Archive)
Einzelnachweise
- Duden Learnattack GmbH: Flammenfärbung

