Ammoniumchlorid
Ammoniumchlorid ist das Ammoniumsalz der Salzsäure. Es ist ein farbloser, kristalliner Feststoff mit der chemischen Formel NH4Cl.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
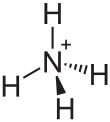 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Ammoniumchlorid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | NH4Cl | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
G04BA01 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 53,49 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,52 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
gut in Wasser (372 g·l−1 bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 3 mg·m−3 (gemessen als alveolengängiger Staub)[5] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−314,6 kJ·mol−1[7] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen
Natürlich vorkommendes Ammoniumchlorid ist als Mineral Salmiak bekannt. Das Mineral ist ein Feststoff, der nicht mit einer wässrigen Lösung von Ammoniak, dem Salmiakgeist, verwechselt werden sollte.
Gewinnung und Darstellung
Ammoniumchlorid kann durch Neutralisation von wässriger Ammoniaklösung mit Salzsäure oder durch die Reaktion von gasförmigem Ammoniak mit gasförmigem Chlorwasserstoff gewonnen werden.
Ammoniumchlorid fällt als Nebenprodukt bei der Gewinnung von Soda nach dem Solvay-Verfahren an:
Eigenschaften
Ammoniumchlorid ist ein farbloses, gut wasserlösliches Salz, welches kubische Kristalle bildet. Wässrige Lösungen reagieren wie auch Lösungen von anderen Ammoniumsalzen mit Anionen starker Säuren wegen der sog. Salzhydrolyse des Ammoniumkations leicht sauer – der pH-Wert einer 1%igen Lösung beträgt etwa 5,5. Ammoniumchlorid ist schlecht in Ethanol löslich und extrem schwer löslich in Aceton und Ether.
Mit steigender Temperatur dissoziiert Ammoniumchlorid nach
zunehmend zu Ammoniak und Chlorwasserstoff. Die Zersetzungstemperatur, die bei Normaldruck 338 °C beträgt, steigt entsprechend dem Prinzip vom kleinsten Zwang mit dem Druck, bis das Salz bei 34,4 bar und 520 °C schmilzt. Beim Versetzen von Ammoniumchlorid mit starken Basen (wie zum Beispiel Natron- oder Kalilauge) wird gasförmiges Ammoniak freigesetzt, beim Versetzen mit schwerflüchtigen konzentrierten Säuren (etwa Schwefel- oder Phosphorsäure) Chlorwasserstoff.
Verwendung
Verwendung findet Ammoniumchlorid heute unter anderem zur Herstellung von Kältemischungen, in der Färberei und Gerberei. Ebenfalls findet es Anwendung beim Verzinnen, Verzinken oder Löten, da es die Fähigkeit besitzt, mit Metalloxiden leicht rauchende und schwach anhaftende Chloride zu bilden und somit die Metalloberfläche zu reinigen. Des Weiteren wird es als Elektrolyt in Zink-Kohle-Batterien eingesetzt.
Ammoniumchlorid dient in der Medizin als Hustenlöser (Expektorans). Dazu ist es z. B. in Salmiak-Lakritz (Salmiakpastillen) enthalten. In Deutschland ist der Zusatz von Ammoniumchlorid zu Schnupf- und Kautabak laut Tabakverordnung erlaubt.
Mit Ammoniak versetzte Ammoniumchlorid-Lösungen können auch als chemischer Puffer verwendet werden. Es ist auch häufig in weißem Rauchpulver vorhanden. Zusammen mit Alkalinitraten dient es als Komponente in Wettersprengstoffen.[8] Auch zum Entrußen von Kaminen, Kachel-, Kohle- und Ölöfen findet es Verwendung.
 Ammoniumchlorid-kristalle
Ammoniumchlorid-kristalle Ammoniumchlorid auf einem Uhrglas
Ammoniumchlorid auf einem Uhrglas Ammoniakdämpfe reagieren mit Salzsäuredämpfen zu Ammoniumchlorid
Ammoniakdämpfe reagieren mit Salzsäuredämpfen zu Ammoniumchlorid
Toxikologie
Tägliche Dosen von acht Gramm Ammoniumchlorid führten in einem berichteten Einzelfall nach mehreren Wochen zu einer Azidose, die auch bei höheren Dosen die Symptomatik bestimmt. Bei bestehender Leber- oder Nierenerkrankung oder Kaliummangel ist entsprechend Vorsicht geboten.[9]
Literatur
- Helga Dittberner: Zur Geschichte des Salmiaks in der islamischen und vorislamischen Chemie, Rete 1 (1972), S. 347–363.
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, New York 2002 ISBN 0-07-049439-8.
- Julius Ruska: Sal ammoniacus, nusâdir und Salmiak, Sitzungsberichte der Heidelberger Akademie der Wissenschaften: phil.-historische Klasse, 14 (1923), 5, S. 3–23.
Weblinks
Einzelnachweise
- Eintrag zu AMMONIUM CHLORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
- Eintrag zu Ammoniumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Februar 2017. (JavaScript erforderlich)
- Eintrag zu Ammonium chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 12125-02-9 bzw. Ammoniumchlorid), abgerufen am 2. November 2015.
- Eintrag zu Ammonium chloride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021.
- PAETEC Formelsammlung Ausgabe 2003, S. 116.
- J. Köhler, R. Meyer, A. Homburg: Explosivstoffe, 10. Auflage, Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- Ammonium chloride acidosis. In: British medical journal Band 2, Nummer 5249, August 1961, S. 441; PMC 1969339 (freier Volltext).
