Kohlenhydrate
Kohlenhydrate oder Saccharide bilden eine biochemisch bedeutsame Stoffklasse. Kohlenhydrate kommen im Stoffwechsel aller Lebewesen vor. Als Produkt der Photosynthese machen Kohlenhydrate etwa zwei Drittel der weltweiten Biomasse aus.[1] Kohlenhydrate sind die am häufigsten vorkommende Klasse von Biomolekülen.[2] Die Wissenschaft, die sich mit der Biologie der Kohlenhydrate und dem Kohlenhydratstoffwechsel beschäftigt, heißt Glycobiologie. Kohlenhydrate werden oftmals mit dem Suffix „-ose“ gekennzeichnet.
Etymologie
Kohlenhydrate sind keine Hydrate
Da viele Saccharide die Bruttoformel Cn(H2O)m aufweisen, wurde fälschlicherweise angenommen, dass es sich um Hydrate des Kohlenstoffs handle, weshalb Carl Schmidt 1844 den Begriff Kohlehydrate prägte,[3] der bis heute als Kohlenhydrate in abgewandelter Form verwendet wird. Vertreter dieser Stoffklasse können jedoch erheblich von dieser Bruttoformel abweichen und weitere funktionelle Gruppen und Heteroatome wie Stickstoff oder Schwefel enthalten, während andere Verbindungen derselben Formel nicht zu den Kohlenhydraten gehören, da sie keine Hydroxyaldehyde oder Hydroxyketone sind. Allgemein liegen Kohlenhydrate vor, wenn in einem Stoff mindestens eine Aldehydgruppe bzw. Ketogruppe und mindestens zwei Hydroxygruppen zu finden sind. Für unverzweigte Polysaccharide, die aus demselben Monosaccharid mit der Summenformel C6H12O6 (Glucose, Fructose, Galactose etc.) aufgebaut sind, gilt die Formel:
Die Bezeichnung Saccharid stammt vom griechischen Wort σάκχαρον (sákkharon) für Zucker.[4]
Geschichte

Bereits im Jahr 1811 machte Constantin Kirchhoff die Entdeckung, dass sich beim Kochen von Stärkemehl mit Säure Traubenzucker bildet.[5] Auf Anregung von Johann Wolfgang Döbereiner wurde 1812 während der Kontinentalsperre eine Stärkezuckerfabrik errichtet. Henri Braconnot entdeckte 1819, dass durch Einwirkung von konzentrierter Schwefelsäure auf Cellulose Zucker entsteht.[6] William Prout gab nach chemischen Analysen des Zuckers, der Stärke durch Joseph Louis Gay-Lussac und Thénard dieser Stoffgruppe den Gruppennamen Sacharine.[7] Chemiker, die bei der Erforschung der Kohlenhydrate mitgewirkt haben, sind unter anderem Emil Fischer (1852–1919), Burckhardt Helferich (1887–1982), Bernhard Tollens (1841–1918), Walter Norman Haworth (1883–1950) und Wilhelm Koenigs (1851–1906) mit seinem Mitarbeiter Eduard Knorr (1867–1926) (Koenigs-Knorr-Methode).
Emil Fischer erhielt 1902 den Nobelpreis für Chemie für seine Arbeiten zu Zuckern und Purinen.[8] Für die Entdeckung des Stoffwechsels der Glucose erhielt Otto Meyerhof 1922 den Nobelpreis für Physiologie oder Medizin.[9] Hans von Euler-Chelpin erhielt zusammen mit Arthur Harden im Jahr 1929 den Nobelpreis für Chemie „für ihre Forschung über die Zuckervergärung und deren Anteil der Enzyme an diesem Vorgang“.[10][11] Im Jahr 1947 erhielten sowohl Bernardo Houssay für seine Entdeckung der Rolle der Hypophyse im Stoffwechsel von Kohlenhydraten als auch Carl und Gerty Cori für ihre Entdeckung der Umwandlung des Glycogens den Nobelpreis für Physiologie oder Medizin.[12][13][14] Für die Entdeckung der Zucker-Nukleotide bei der Biosynthese von Kohlenhydraten erhielt Luis Leloir im Jahr 1970 den Nobelpreis für Chemie.[15]
Eigenschaften
Ein Kohlenhydrat besitzt die allgemeine Summenformel CnH2nOn mit n ≥ 3.[2] Alternativ können Kohlenhydrate definiert werden als Polyhydroxyaldehyde und -ketone und Moleküle, die nach Hydrolyse solche ergeben – allerdings werden auch deren Abkömmlinge wie Desoxyribose als Kohlenhydrate bezeichnet, welche eine andere Summenformel aufweisen.[16] Die IUPAC definiert Kohlenhydrate einschließlich der Zuckeralkohole, Zuckersäuren, Desoxyzucker, Aminozucker, Thiozucker und ähnlicher Verbindungen.[17]
Systematik
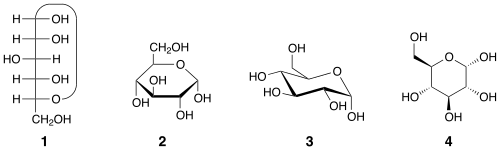
Kohlenhydrate kommen in unterschiedlicher Kettenlänge (auch als Polymere) vor und werden daher in Mono-, Di-, Tri-, Oligo- und Polysaccharide unterteilt. Die Monosaccharide (Einfachzucker, z. B. Traubenzucker, Fruchtzucker), Disaccharide (Zweifachzucker, z. B. Kristallzucker, Milchzucker, Malzzucker) und Oligosaccharide (Mehrfachzucker, mit < 10 Monosaccharideinheiten,[18] z. B. Stachyose, Raffinose) sind wasserlöslich, haben einen süßen Geschmack und werden im engeren Sinne als Zucker bezeichnet. Die Polysaccharide (Vielfachzucker, z. B. Stärke (Amylose und Amylopektin), Cellulose, Chitin und in Tieren Glycogen) sind hingegen oftmals schlecht oder gar nicht in Wasser löslich und geschmacksneutral.[19] Monosaccharide mit drei C-Atomen werden als Triose bezeichnet, mit vier C-Atomen als Tetrose, mit fünf C-Atomen als Pentose, mit sechs C-Atomen als Hexose usw.[20] Polymere von Kohlenhydraten mit nur einem Grundbaustein (genauer: mit nur einem Typ Monosaccharid) werden als Homoglykane bezeichnet, während polymere Kohlenhydrate aus verschiedenen Grundbausteinen als Heteroglykane bezeichnet werden.
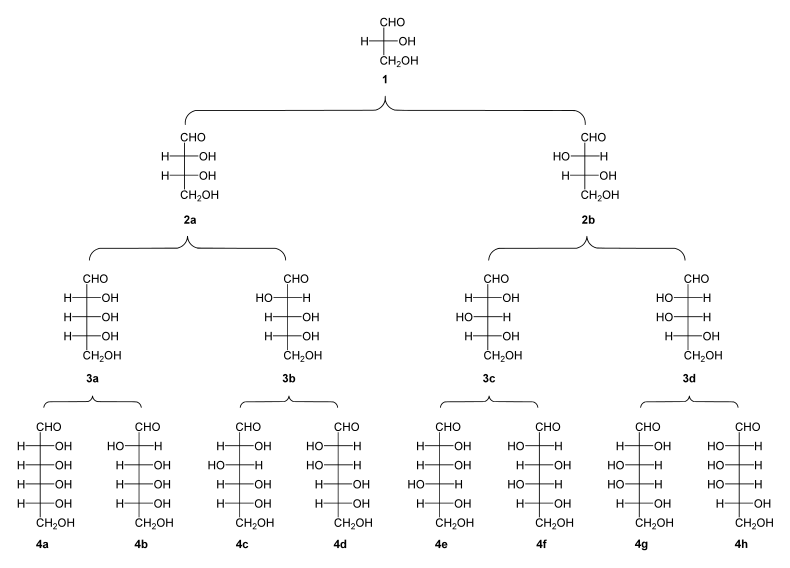
Bei den Triosen existieren zwei mögliche Strukturen, da ein Kohlenhydrat immer eine Aldehyd- oder eine Ketogruppe aufweist, jeweils in einer D- und einer L-Form: das Glycerinaldehyd (als Aldotriose) und das Dihydroxyaceton (als Triulose).[21] Die Tetrosen besitzen drei Vertreter: als Aldotetrosen die Erythrose und die Threose, als Tetrulose die Erythrulose.[21] Bei den Pentosen gibt es als Aldopentosen die Ribose, Arabinose, Xylose und Lyxose und als Pentulosen die Ribulose und die Xylulose.[21] Die Aldohexosen (also Kohlenhydrate mit 6 C-Atomen und einer Aldehydgruppe) werden in acht mögliche Vertreter unterteilt. Diese sind, nach der Fischer-Nomenklatur sortiert: Allose, Altrose, Glucose, Mannose, Gulose, Idose, Galactose und Talose.[21] Die vier möglichen Hexulosen (also Kohlenhydrate mit 6 C-Atomen und einer Ketogruppe) sind, nach der Fischer-Nomenklatur sortiert: Psicose, Fructose, Sorbose und Tagatose.[21]
Vorkommen
Kohlenhydrate kommen in allen Lebewesen vor und sind ein zentraler Bestandteil des Energiestoffwechsels. Monosaccharide sind in der Natur in höheren Konzentrationen in Früchten und in Honig zu finden.[22] Unter den Disacchariden kommt Saccharose in Zuckerrüben und Zuckerrohr vor. Das Disaccharid Lactose kommt in Milch und Milchprodukten vor, während die Maltose natürlich in Honig und künstlich in Malz und Stärkezucker vorkommt.[22] Die Raffinose und die Stachyose sind in vergleichsweise höheren Konzentrationen in Getreide, in Knollen, in Zwiebeln und in Malz vertreten.[22] Stärke und Dextrine werden gehäuft von Getreiden, Wurzeln, Knollen und Gemüsen gebildet.[22] Cellulosen, Hemicellulosen werden von allen Pflanzen gebildet.[22] Cellulose ist das am häufigsten vorkommende Biomolekül.[23] Dementsprechend ist Glucose, aus dem Cellulose aufgebaut ist, das häufigste Monosaccharid.
| Nahrungsmittel | Gesamtkohlenhydrate inkl. Ballaststoffe |
Gesamtzucker | Fructose | Glucose | Saccharose | Fructose/ Glucose Verhältnis |
Saccharose in % des Gesamtzuckers |
|---|---|---|---|---|---|---|---|
| Früchte | |||||||
| Apfel | 13,8 | 10,4 | 5,9 | 2,4 | 2,1 | 2,0 | 19,9 |
| Aprikose | 11,1 | 9,2 | 0,9 | 2,4 | 5,9 | 0,7 | 63,5 |
| Banane | 22,8 | 12,2 | 4,9 | 5,0 | 2,4 | 1,0 | 20,0 |
| Feige, getrocknet | 63,9 | 47,9 | 22,9 | 24,8 | 0,9 | 0,93 | 0,15 |
| Trauben | 18,1 | 15,5 | 8,1 | 7,2 | 0,2 | 1,1 | 1 |
| Nabelorange | 12,5 | 8,5 | 2,25 | 2,0 | 4,3 | 1,1 | 50,4 |
| Pfirsich | 9,5 | 8,4 | 1,5 | 2,0 | 4,8 | 0,9 | 56,7 |
| Birne | 15,5 | 9,8 | 6,2 | 2,8 | 0,8 | 2,1 | 8,0 |
| Ananas | 13,1 | 9,9 | 2,1 | 1,7 | 6,0 | 1,1 | 60,8 |
| Pflaume | 11,4 | 9,9 | 3,1 | 5,1 | 1,6 | 0,66 | 16,2 |
| Gemüse | |||||||
| Rote Beete | 9,6 | 6,8 | 0,1 | 0,1 | 6,5 | 1,0 | 96,2 |
| Karotte | 9,6 | 4,7 | 0,6 | 0,6 | 3,6 | 1,0 | 77 |
| Paprika | 6,0 | 4,2 | 2,3 | 1,9 | 0,0 | 1,2 | 0,0 |
| Zwiebel | 7,6 | 5,0 | 2,0 | 2,3 | 0,7 | 0,9 | 14,3 |
| Süßkartoffel | 20,1 | 4,2 | 0,7 | 1,0 | 2,5 | 0,9 | 60,3 |
| Yamswurzel | 27,9 | 0,5 | Spuren | Spuren | Spuren | – | Spuren |
| Zuckerrohr | 13–18 | 0,2 – 1,0 | 0,2 – 1,0 | 11–16 | 1,0 | hoch | |
| Zuckerrübe | 17–18 | 0,1 – 0,5 | 0,1 – 0,5 | 16–17 | 1,0 | hoch | |
| Getreide | |||||||
| Mais | 19,0 | 6,2 | 1,9 | 3,4 | 0,9 | 0,61 | 15,0 |
Chemie
Von zentraler Bedeutung in der Kohlenhydratchemie und Biochemie ist die glycosidische Bindung zwischen zwei Monosacchariden oder zwischen einem Monosaccharid und einer Hydroxygruppe, einer Aminogruppe, einer Thiolgruppe oder einer Selenogruppe eines anderen Moleküls.[25] Das hierbei gebildete cyclische Vollacetal eines Zuckers bezeichnet man als Glycosid. Kohlenhydrate sind Hydroxyaldehyde oder Hydroxyketone sowie davon abgeleitete Verbindungen, haben in ihrer offenkettigen Form also neben mindestens zwei Hydroxygruppen auch mindestens eine Aldehydgruppe oder Ketogruppe. Handelt es sich um ein Hydroxyaldehyd (Carbonylgruppe an einem terminalen C-Atom (Aldehyd)), so spricht man von einer Aldose, handelt es sich um ein Hydroxyketon (also mit Carbonylgruppe an einem internen C-Atom und Hydroxygruppen), bezeichnet man den Zucker als Ketose (synonym Ulose).[26] Die Carbonylfunktion ist eine hochreaktive funktionelle Gruppe: Zu nennen sind hier besonders die leichte Oxidierbarkeit zur Carbonsäure, die Reduktion zum Alkohol und der leichte nukleophile Angriff am Kohlenstoffatom der Carbonylgruppe. Wichtige Reaktionen beim Erhitzen von Kohlenhydraten sind die Karamellisierung und die Maillard-Reaktion.[27]
Struktur
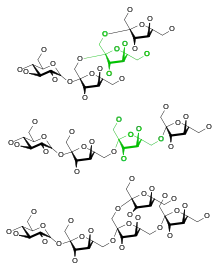
Die folgende Tabelle zeigt einige Beispiele für die Vielfalt natürlicher Kohlenhydratstrukturen. Pentosen und Hexosen können im Prinzip sowohl Fünf- als auch Sechsringe bilden, wobei ein neues Chiralitätszentrum entsteht, so dass einschließlich der offenkettigen Form bereits für ein Monosaccharid fünf Isomere existieren. Durch glycosidische Bindungen können sich Monosaccharide zu Oligo- und Polysacchariden verbinden. Dadurch potenziert sich die Anzahl möglicher Kohlenhydratstrukturen theoretisch zu einer sehr großen Vielfalt.
Das Beispiel der α-D-Glucopyranose zeigt verschiedene gleichwertige Darstellungsformen.
| Beispiele der Strukturvielfalt von Kohlenhydraten und Vergleich verschiedener Moleküldarstellungen | ||
|---|---|---|
| Strukturformeln der Fructane | verschiedene Monosaccharide | |
 |
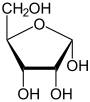 α-D-Ribofuranose |
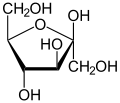 β-D-Fructofuranose |
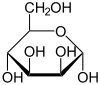 α-D-Mannopyranose |
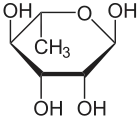 α-L-Rhamnopyranose (6-Desoxy-α-L-mannopyranose) | |
| α-D-Glucopyranose in (1) Fischer- bzw. Tollens- (2) Haworth- (3) Sessel- (4) stereochemischer Darstellung | ||
 | ||
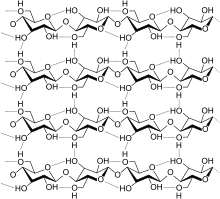
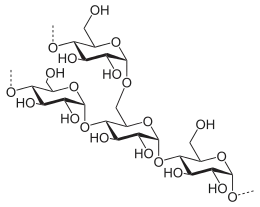
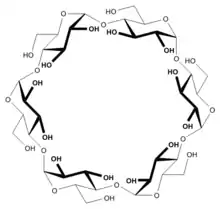
| Saccharose, ein Disaccharid | Ausschnitt aus dem Chitin-Polymer | Strukturformel für α-Cyclodextrin |
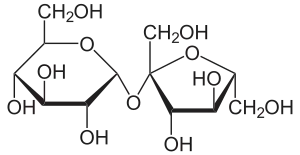 |
 |
 |
Die Pyranosen (ringförmig geschlossene Monosaccharide mit 6 Atomen im Ring) nehmen eine Wannen- oder Sesselkonformation ein.[28] Da die Kohlenstoffatome in Pyranosen sp3-hybridisiert sind, nehmen sie in Ringform bevorzugt die energetisch stabilere Sessel-Konformation und in geringerem Umfang auch die Wannen-Konformation ein.[26]
Oxidation und Reduktion
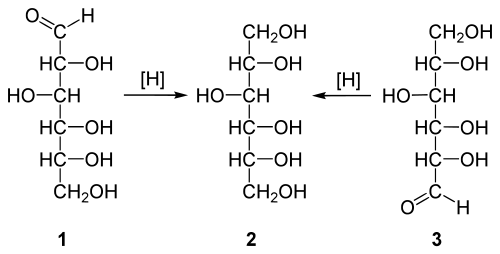
Durch Oxidationsmittel werden Aldosen bei einer Oxidation am ersten C-Atom zu Aldonsäuren oxidiert.[18] Als Beispiel entsteht aus Glucose die Gluconsäure.[18] Dies gilt unter basischen Bedingungen nicht nur für die Aldosen, sondern auch für die Ketosen, die durch die Base in einer komplexen Reaktion umgelagert werden (dabei wird die im Zuge der Keto-Enol-Tautomerie auftretende Aldose-Form stabilisiert). Bei einer Oxidation am letzten C-Atom werden Uronsäuren gebildet (z. B. Glucuronsäure) und bei stärkerer Oxidation werden die Arsäuren mit zwei Carboxygruppen gebildet, eine Form der Dicarbonsäuren, beispielsweise entsteht aus Glucose durch Oxidation bis hin zu zwei Carboxygruppen die Glucarsäure.[18]
Wird die Carbonylfunktion zur Hydroxygruppe reduziert, erhält man ein sogenanntes Alditol.
Cyclisierung zum Halbacetal und Mutarotation
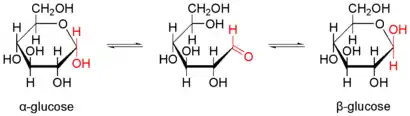
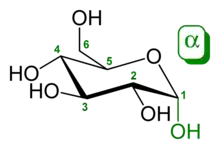
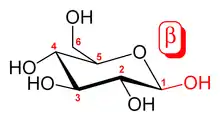
Bei in Wasser gelösten Kohlenhydraten stellt sich innerhalb von Minuten bis Stunden ein chemisches Gleichgewicht verschiedener Formen des jeweiligen Kohlenhydrats ein.[29] Durch einen intramolekularen nukleophilen Angriff einer der Hydroxygruppen auf das Carbonylkohlenstoffatom bildet sich ein cyclisches Halbacetal, welches energetisch meist sehr günstig ist. Hierbei werden überwiegend Sechsringe (pyranose Form) gebildet, die eine sehr niedrige Ringspannung aufweisen, es entstehen aber auch in geringerem Maße Fünfringe (furanose Form). Andere Ringgrößen treten nicht auf, da sie eine zu hohe Ringspannung aufweisen. Es entsteht ferner ein neues Chiralitätszentrum. Die beiden resultierenden Formen sind Diastereomere und werden mit α und β bezeichnet. In wässriger Lösung bilden α- und β-pyranose und -furanose Form eine Gleichgewichtsreaktion miteinander und mit der offenkettigen Form. Eine wässrige Lösung von reiner α-Glucopyranose wird daher nach einiger Zeit zu einer Gleichgewichtsmischung aus α- und β-Glucopyranose und -furanose (38 % α-Glcp, 62 % β-Glcp, 0 % α-Glcf, 0,14 % β-Glcf, 0,002 % offenkettig). Die hierbei messbare Veränderung des Drehwertes wird als Mutarotation bezeichnet. Dabei verändern sich die Anteile der verschiedenen Formen am anomeren Kohlenstoffatom. Während aliphatische Aldehyde bereits von Luftsauerstoff allmählich zur Carbonsäure oxidiert werden, sind Kohlenhydrate durch die Acetalbildung erheblich unempfindlicher, was zweifelsohne für eine so wichtige Biomolekülklasse von enormer Bedeutung ist. Bei glycosidisch gebundenen Monosacchariden erfolgt keine Mutarotation.[28]
Amadori-Produkte und Maillard-Reaktion
Mit Aminen (z. B. in Aminosäuren, Proteinen) reagiert der offenkettige Aldehyd des Kohlenhydrates über ein Imin reversibel zu Amadori-Produkten, welches wiederum ebenfalls mit Aminen oder Aminosäuren kondensieren kann und sich irreversibel umlagert:
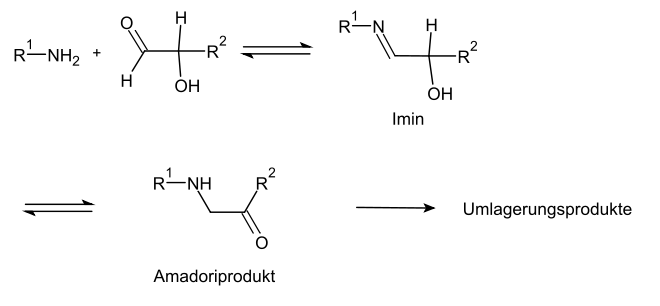
Diese nichtenzymatische Reaktion erfolgt im Organismus mit Aminosäuren und Eiweißen relativ häufig und ist einer der zentralen Vorgänge beim Altern (z. B. Altersflecken), da die Reaktionsprodukte vom Körper nicht abgebaut werden können. Ferner spielt sie eine wichtige Rolle bei der thermischen Zubereitung von Lebensmitteln, z. B. beim Braten und Kochen. Es kommt zu der typischen Bräunung, da sich konjugierte Ringsysteme bilden, die farbig sind. Diese Produkte der sogenannten Maillard-Reaktion sind auch für den Geschmack zubereiteter Lebensmittel entscheidend.[30]
Synthese
Verschiedene chemische Synthesen von Kohlenhydraten wurden beschrieben.[31] Da an einem Kohlenhydrat mehrere Hydroxygruppen vorkommen, werden diejenigen mit Schutzgruppen versehen, die nicht reagieren sollen.[31]
Biochemie
Mono-, Di- und Polysaccharide stellen zusammen mit den Fetten und Proteinen den quantitativ größten verwertbaren und nicht-verwertbaren (Ballaststoffe) Anteil an der Nahrung. Neben ihrer zentralen Rolle als Energieträger spielen sie in biologischen Signal- und Erkennungsprozessen (z. B. Zellkontakte, Blutgruppen),[20] als Schutz vor mechanischer Belastung (z. B. Glykosaminoglykane im Knorpelgewebe)[20] und, vor allem im Pflanzenreich, als Stützsubstanz eine wichtige Rolle. Alle Zellen sind auf der Außenseite ihrer Zellmembranen mit einer Schicht an Kohlenhydraten versehen, der Glykokalyx.[20] Außerhalb der Zellen von höheren Eukaryoten liegt die extrazelluläre Matrix mit hohem Anteil an Kohlenhydraten.[20] Die Gesamtheit der Kohlenhydrate in einer Zelle zu einem gegebenen Zeitpunkt wird als Glykom bezeichnet und ist vom Zustand der Zelle abhängig.[20] Die Wissenschaft zur Erforschung des Glykoms wird als Glykomik bezeichnet.[20] Die Bindung eines Proteins an ein Kohlenhydrat erfolgt über Protein-Kohlenhydrat-Interaktionen. Oligo- und Polysaccharide werden aus Monosacchariden durch Glycosyltransferasen aufgebaut und durch Glycosidasen abgebaut.
Kohlenhydrate sind nicht essentiell, da der Körper sie in der Gluconeogenese unter Energieaufwand aus anderen Nahrungsbestandteilen wie Proteinen und Glycerin selbst herstellen kann. Da insbesondere das Gehirn hochgradig von Glucose als Energieträger abhängig ist und keine Fette verwerten kann, muss der Blutzuckerspiegel in engen Grenzen gehalten werden. Dessen Regulation erfolgt durch das Zusammenspiel von Insulin und Glucagon. Bei Kohlenhydratmangel wird das Gehirn durch Ketonkörper versorgt, was sich z. B. bei einer Diät durch Acetongeruch bemerkbar macht. Eine völlig kohlenhydratfreie Ernährung wurde im Tierversuch bei Hühnern problemlos vertragen.[32] Auch eine Langzeitstudie an Kindern und jungen Erwachsenen mit der sehr kohlenhydratreduzierten ketogenen Diät zeigte gesundheitliche Unbedenklichkeit.[33]
Eine eigenständige Erkrankung des Menschen durch das Fehlen von Kohlenhydraten ist unbekannt.[34] Der Energiegehalt eines Gramms Kohlenhydrat beträgt rund 17,2 Kilojoule (4,1 Kilokalorien).[35]
Funktion
Die Monosaccharide werden für die Biosynthese verschiedener Moleküle verwendet. Die Monosaccharide Desoxyribose und Ribose werden zur Herstellung von DNA beziehungsweise RNA verwendet.[20] Glucose, Fructose und Galactose dienen der Energiegewinnung. Xylulose und Ribulose kommen im Pentosephosphatweg vor.
Oligosaccharide werden oftmals im Zuge einer Glykosylierung an Proteine[36] und Lipide angehängt,[37] dabei entstehen Glycoproteine beziehungsweise Glycolipide. Typische Monosaccharide in Glykosylierungen sind Mannose, Galactose, Xylose, Fucose und Aminozucker wie N-Acetylglucosamin, N-Acetylgalactosamin und Neuraminsäure. Daneben werden die Disaccharide Saccharose (aus Glucose und Fructose) und Lactose (aus Glucose und Galactose) als Energielieferant gebildet.
Polysaccharide sind entweder Speicherformen von Monosacchariden unter anderem für den Energiestoffwechsel oder besitzen als Strukturkohlenhydrate eine Gerüstfunktion für die Stabilität einer Zelle (Cellulose und Hemicellulose in Pflanzen und vielen Algen, Agarose in manchen Algen und Chitin in Pilzen und Arthropoden). Aus Glucose werden Glucose-Polysaccharide als Reservestoffe für den Energiestoffwechsel – Glycogen in Tieren, Amylopectin und Amylose (Bestandteile der Stärke) in Pflanzen – oder die Gerüstpolymere Cellulose und Hemicellulose gebildet. In Bakterien wurden über 100 verschiedene Monosaccharide beschrieben, die unter anderem in Lipopolysacchariden, in Polysacchariden der Bakterienkapsel oder als sezernierte Polysaccharide vorkommen.[38]
Biosynthese
Einfachzucker werden von Pflanzen im Calvin-Zyklus durch Photosynthese aus Kohlenstoffdioxid und Wasser aufgebaut. Zur Speicherung oder zum Zellaufbau werden diese Einfachzucker bei praktisch allen Lebewesen zu Mehrfachzuckern verkettet. Pflanzen synthetisieren in den Plastiden (z. B. Chloroplasten) die Polysaccharide der Stärke: Amylose und Amylopektin. Letztendlich werden fast alle Biomoleküle direkt oder indirekt durch Photosynthese gebildet,[2] sei es durch Photosynthese oder bei Bakterien, Pilzen und Tieren durch das Verdauen von pflanzlichem Material oder durch das Verdauen von Pflanzenfressern und die anschließende Biosynthese der Biomoleküle aus ursprünglichen Metaboliten der Photosynthese.
Tiere stellen Monosaccharide ebenfalls her, in Form von Glucose per Gluconeogenese aus anderen aufgenommenen Metaboliten.[39] Dabei bilden sie vor allem in der Leber und in Muskeln aus Glucose das langkettige Speicher-Polysaccharid Glycogen. Aus Glucose können auch alle anderen Monosaccharide hergestellt werden.[40] Die Energieversorgung des Gehirns und des Nierenmarks ist auf die Verstoffwechslung von Glucose als Energielieferant angewiesen, da sie Fette nicht direkt energetisch verwenden, sondern nur die aus Fetten in der Leber gebildeten Ketonkörper.[41] In Hungersituationen ohne Kohlenhydratzufuhr oder bei verstärkter Muskelarbeit wird daher unter Energieaufwand Glucose in der Gluconeogenese aus den Stoffwechselprodukten Lactat, bestimmten Aminosäuren (glucogene Aminosäuren,[42] u. a. Alanin) und Glycerin synthetisiert. Die Gluconeogenese verwendet zwar einige Enzyme der Glycolyse, dem Abbauweg der Glucose zur Erzeugung von energiereichem ATP und NADH+H+, ist aber keinesfalls als deren Umkehrung zu verstehen, da ein paar entscheidende Schritte unterschiedlich sind und mit eigenen Enzymen exergon stattfinden.[43] Die Glycolyse und die Gluconeogenese sind somit nicht reversibel. Glycolyse und Gluconeogenese sind reziprok reguliert, d. h., sie schließen einander in ein und derselben Zelle nahezu aus. Unterschiedliche Organe können jedoch sehr wohl gleichzeitig den einen und den anderen Weg beschreiten. So findet bei starker Muskelaktivität im Muskel Glycolyse und damit Lactatfreisetzung und in der Leber Gluconeogenese unter Verwendung von Lactat statt. Dadurch wird ein Teil der Stoffwechsellast in die Leber verlagert, beschrieben durch den Cori-Zyklus.[44]
Aufnahme


Im Gegensatz zu Pflanzen nehmen Bakterien, Pilze und Tiere Kohlenhydrate auf. Kohlenhydrate sind neben Fett und Eiweiß als Nährstoffe ein wesentlicher Bestandteil der Nahrung von Tieren. Beim Menschen werden 98 % der resorbierbaren Kohlenhydrate (also der Nicht-Ballaststoffe) verstoffwechselt.[45] Wichtige Grundnahrungsmittel, die einen hohen Anteil an Kohlenhydraten aufweisen, sind die verschiedenen Getreidesorten, die zu Lebensmitteln verarbeitet werden (Reis, Weizen, Mais, Hirse, Roggen, Hafer) bzw. als Viehfutter genutzt werden (vor allem Gerste, Hafer, Mais, Triticale). Die stärkehaltigen Getreideprodukte sind u. a. Brot, Nudeln, Kuchen u. v. a. m. Die Wurzelknollen der Kartoffel, eines Nachtschattengewächses, und die zu den Hülsenfrüchten gehörenden Erbsen, Bohnen und Linsen weisen ebenfalls einen hohen Kohlenhydratanteil auf.
Bei der Aufnahme (Resorption) der Glucose aus der Nahrung ist es in Situationen großen Energiebedarfs nicht egal, wie schnell das geschieht. Da die Glucose in der Nahrung meistens in mehr oder weniger oligomerisierter, bzw. polymerisierter, genauer: polykondensierter Form vorliegt, müssen die Glucoseketten im Verdauungstrakt aufgespalten werden, was je nach Länge der Ketten unterschiedlich schnell geschieht. Werden z. B. stärkehaltige Nahrungsmittel wie Brot oder Kartoffeln gegessen, so zerlegen die Verdauungsenzyme die Glucosekette der Stärke in einzelne Bruchstücke und schließlich bis zu den einzelnen Glucose-Molekülen, die nach und nach in den Blutkreislauf übergehen. Die Kohlenhydrate werden von verschiedenen Glycosidasen unter den Verdauungsenzymen in Monosaccharide gespalten. In Eukaryoten gibt es drei Gruppen von Transportproteinen für Monosaccharide: Glucosetransporter (GLUT), Natrium/Glucose-Cotransporter (SGLT) und SWEET.[46] Ein Maß für die Geschwindigkeit, mit der die Stärke zerlegt und die Glucose-Bausteine aufgenommen werden, ist der Glykämische Index (GI).
Kohlenhydrate zur strukturellen Stabilisierung von Zellen (Strukturkohlenhydrate, beispielsweise Cellulose und Chitin) können von Säugern mit einhöhligem Magen nur bedingt verdaut werden, hingegen weitgehend oder vollständig von Wiederkäuern (Ruminantia), Kamelartigen (Camelidae) (diese sind ebenfalls Wiederkäuer, allerdings nicht im systematischen Sinne, da sich bei ihnen das Wiederkäuen unabhängig entwickelt hat) und Pferdeartigen (Equidae).
Pflanzenarten, die vor allem zur Kohlenhydrataufnahme in der menschlichen Ernährung beitragen, sind in der Liste der Nutzpflanzen zusammengestellt. Nichtresorbierbare Kohlenhydrate sind Ballaststoffe. Nichtresorbierbare Oligosaccharide erhöhen den Wassergehalt im Stuhl und werden teilweise von der Darmflora fermentiert.[47] Die in der Pflanzenwelt als Stützsubstanz in großen Mengen vorkommende Cellulose ist für den Menschen unverdaulich, weil von Menschen keine Cellulase gebildet wird. Cellulose ist aber von den Wiederkäuern wie Rindern, Schafen und Ziegen verwertbar, da diese sich in ihren Vormägen (Pansen) den mikrobiellen Aufschluss durch ihre Darmflora zu Nutze machen.
Die Gesellschaften für Ernährung in Deutschland, Österreich und der Schweiz empfehlen einen Kalorienanteil von Kohlenhydraten in der Nahrung von über 50 %.[48] Die Europäische Behörde für Lebensmittelsicherheit (EFSA) empfiehlt einen Kalorienanteil von 45 – 60 %, in den USA werden 45 – 65 % empfohlen und die WHO empfiehlt einen Kalorienanteil von 55 – 75 %.[48] Die WHO empfiehlt zudem, dass nicht mehr als 10 % der täglichen Kalorienaufnahme Zucker sein sollen.[49] Kohlenhydrate mit einem hohen glykämischen Index wie Zucker begünstigen eine übermäßige Aufnahme von Kalorien und Hyperphagie.[50][51] Lösliche Kohlenhydrate erzeugen weniger Sättigungsgefühl.[52] Bei längerfristiger starker körperlicher Betätigung wird eine Aufnahme von 30 bis 60 g pro Stunde empfohlen, bei über 2,5 Stunden Dauer wird eine Aufnahme von 90 g pro Stunde empfohlen.[53]
Abbau
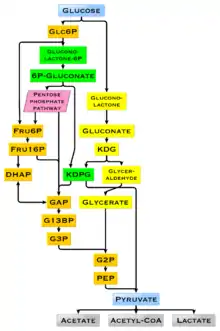
Die unmittelbare Energiewährung für biologische Prozesse ist das Adenosintriphosphat (ATP),[54] das zum Beispiel die Muskelkontraktion antreibt und an fast allen energieverbrauchenden Prozessen beteiligt ist. Es liegt jedoch in den Zellen nur in geringer Konzentration vor und muss durch aeroben und anaeroben Abbau energiereicher Verbindungen wie Fette, Kohlenhydrate oder Proteine in den Zellen nachgeliefert werden. Kohlenhydrate sind der Hauptenergielieferant für den Organismus, am häufigsten als Glucose, gefolgt von Fructose, Galactose und Mannose.[55] Diese Monosaccharide werden in der Glycolyse verstoffwechselt.[55] Sie sind im Gegensatz zu den Fetten relativ schnell verwertbar, da sie auch bei Sauerstoffmangel (anaerob) Energie liefern. Jede Körperzelle kann Glucose durch die Zellmembran aufnehmen. Die Leber kann sie bei Bedarf wieder abgeben. In den Zellen der verschiedenen Organe kann sie entweder durch Verstoffwechselung die chemische Energie für Muskelarbeit, anabole Prozesse oder Gehirnaktivität liefern oder in Form von Glucoseketten als Glycogen gespeichert werden. Der Abbau von Glycogen zu Glucose erfolgt über die Glycogenolyse.
Die physiologische Energieerzeugung aus Kohlenhydraten erfolgt im Normalfall in der nicht-oxidativen Glycolyse und in Anwesenheit von Sauerstoff im oxidativen Citrat-Zyklus.[56] Die Oxidationsschritte im Citrat-Zyklus bestehen in einer Abspaltung von Wasserstoff, der durch Wasserstoffüberträger in die Atmungskette eingespeist und dort mit Sauerstoff zu Wasser oxidiert wird. Das dabei an der Mitochondrienmembran erzeugte Membranpotential liefert mit Abstand die meiste Energie für die ATP-Synthese aus ADP. Unter Sauerstoffmangel erfolgt in Tieren die Milchsäuregärung zu Lactat und in Hefen die alkoholische Gärung zu Ethanol.[57]
Nur wenn die Versorgung der Gewebe mit Kohlenhydraten erheblich[58] größer ist als ihr Verbrauch, werden zunächst die Glykogenspeicher aufgefüllt und anschließend der Überschuss in Fett umgewandelt und als Depotfett gespeichert. Fette haben einen höheren physiologischen Brennwert als Kohlenhydrate, weil die Kohlenstoffatome von Lipiden eine höhere Oxidationszahl aufweisen.[59] Lipide haben keine Hydrathülle, weshalb sie für die langfristige Energiespeicherung platzsparender als Kohlenhydrate sind. Nebenbei bewirken sie eine bessere Wärmedämmung des Körpers.
Fettdepots werden ständig energetisch verwertet und nicht erst, wenn der Glycogenspeicher im Muskel reduziert ist. Das Adenosintriphosphat (ATP) für intensive Muskelarbeit wird durch vier Energiequellen geliefert. Daran den größten Anteil hat in der ersten Minute starker körperlicher Aktivität die Verwertung von Creatinphosphat (aus dem Proteinstoffwechsel), das ein höheres Phosphatgruppenübertragungspotential hat als ATP und dieses daher schnell nachliefern kann. Ab der zweiten Minute übernimmt die anaerobe Zuckerverwertung und die oxidative Zuckerverwertung. Den geringsten Anteil hat der Fettabbau mit etwa 23 % der Energiebereitstellung bei starker körperlicher Aktivität.[60] Je intensiver die Anstrengung ist, desto stärker nimmt der Anteil der ersten, insbesondere anaeroben Anteile zu.[60] Folglich nimmt der relative Anteil des Fettabbaus bei erhöhter Pulsfrequenz ab, die absolute Menge des verwerteten Fettes nimmt aber sehr wohl zu, da der Gesamtenergieumsatz ebenfalls zunimmt. Der mit starker Betätigung steigende Anteil des anaeroben Stoffwechsels hängt mit dem abnehmenden Sauerstoffangebot im Muskel bei starker Muskelarbeit zusammen, da der Fettabbau im Stoffwechsel ein aerober Prozess ist. Bei niedriger körperlicher Anstrengung wie Spazierengehen wird in der ersten Minute Creatinphosphat abgebaut, anschließend wird hauptsächlich Fett abgebaut und nur ein geringer Teil von etwa 12 % der Energie durch Kohlenhydrate geliefert.[60]
Untrainierten Sportlern wird oft geraten, ausdauernd und leistungsschwach anzufangen („Laufen, ohne zu schnaufen“). Es gibt jedoch die Ansicht, dass allein die Energiebilanz beim Sport entscheidend ist, da z. B. nach der Anstrengung noch ein weiterer Abbau der Fette stattfindet. Wird also während des Trainings viel Glucose umgesetzt, wird in der Erholungsphase umso mehr Fett abgebaut. Weitere Faktoren des Fettabbaus sind die Art und die Frequenz der Nahrungsaufnahme, da mit jedem Insulinausstoß der Fettabbau gehemmt wird. Mit zunehmendem Training vergrößert sich die Muskelmasse, die Sauerstoffaufnahme verbessert sich, wodurch ein erhöhter Fettabbau entsteht.[61][62] Leistungssportler trainieren vor einem Wettkampf durch den geeigneten Zeitpunkt der Nahrungsaufnahme die Optimierung ihres Glycogenspeichers, da dieser ein wichtiger Energiespeicher für kurzfristige Leistungsspitzen ist.
Bei einer Diät zur Gewichtsabnahme ist eine Minderung der Zufuhr an Kohlenhydraten genauso effektiv wie eine Minderung der Zufuhr an Fetten.[63]
Blutzucker
Die akute Energieversorgung des Körpers wird im Wesentlichen über die im Blut gelöste Glucose gewährleistet. Ihre Konzentration im Blut, der Blutzuckerspiegel, wird in engen Grenzen gehalten. Bei der Verdauung wird die Glucose im Dünndarm als Monosaccharid aus dem Nahrungsbrei aufgenommen und in das Blut abgegeben. Nach der Nahrungsaufnahme steigt der Blutzuckerspiegel daher an. Die ins Blut aufgenommene Glucose muss also erst einmal zwischengespeichert werden. Das Signal hierzu gibt das Insulin, ein Peptidhormon. Es signalisiert dem Muskel- und Lebergewebe, verstärkt Glucose aus dem Blut aufzunehmen und zu Glycogen zu verketten.
Gärung
Die Gärung ist ein Stoffwechselprozess, bei dem unter Sauerstoffabschluss (Anaerobie) Kohlenhydrate zum Energiegewinn abgebaut werden. Sie wird in der Natur vor allem von Mikroorganismen genutzt, jedoch können Pflanzen unter Sauerstoffmangel auf sie zurückgreifen. In den Muskeln findet unter Sauerstoffmangel Milchsäuregärung statt.
Gärungen werden vielfältig zur Herstellung und Veredelung von Lebensmitteln genutzt. So wird bei der Milchsäuregärung Milchzucker zu Milchsäure umgesetzt und zur Herstellung von Joghurt,[64] Quark und Buttermilch[65] genutzt. Die Herstellung von Sauerteig[66] und Silage beruhen auf der Gärung von Kohlenhydraten zu Milchsäure. Bei der Käse-Herstellung ist die Milchsäuregärung ein wichtiger Zwischenschritt.
Bei der alkoholischen Gärung werden verschiedene Zuckerarten zu Alkohol vergoren.[67] Zu nennen wäre hier u. a. Malzzucker beim Bierbrauen[68] und Traubenzucker beim Keltern von Wein.[69] Stärkehaltige Nahrungsmittel wie Kartoffeln, Getreide und Reis werden z. B. zu Schnäpsen, Früchte zu Obstwässern verarbeitet.
Im Vergleich zur Zellatmung wird bei Gärungen nur eine geringe Menge Energie gewonnen, da statt Citratzyklus und anschließender Atmungskette nur die Substratkettenphosphorylierung genutzt werden kann.
Liste wichtiger Kohlenhydrate
- Einfachzucker (Monosaccharide)
- Glucose, auch Traubenzucker oder seltener Dextrose
- Mannose, ein Epimer der Glucose
- Fructose, auch Fruchtzucker
- Ribose, Teil der Ribonukleinsäure (RNA)
- Desoxyribose, Teil der Desoxyribonukleinsäure (DNA)
- Galactose, auch Schleimzucker
- Fucose, ein L-Zucker
- Rhamnose, ein Desoxyzucker, L-Zucker
- Zweifachzucker (Disaccharide)
- Saccharose, auch Rübenzucker oder Rohrzucker (Glucose + Fructose)
- Lactose, auch Milchzucker (Galactose + Glucose)
- Lactulose (Galactose + Fructose), Umlagerungsprodukt von Lactose im alkalischer Lösung durch Lobry-de-Bruyn-van-Ekenstein-Umlagerung
- Maltose, auch Malzzucker (Glucose + Glucose), u. a. beim Stärkeabbau durch Speichelamylase im Mund
- Maltulose (Glucose + Fructose), Umlagerungsprodukt von Maltose im alkalischer Lösung durch Lobry-de-Bruyn-van-Ekenstein-Umlagerung
- Trehalose, ein nicht-reduzierender Zucker (Glucose + Glucose)
- Cellobiose (Glucose + Glucose), Abbauprodukt von Cellulose u. a. im Darm
- Dreifachzucker (Trisaccharide)
- Melezitose, Trisaccharid u. a. im Honig
- Maltotriose, Trisaccharid, u. a. beim Stärkeabbau durch Speichelamylase im Mund
- Raffinose, bleibt bei der Zucker-Raffination in der Melasse
- Umbelliferose
- Vielfachzucker (Polysaccharide)
- Stärke, wichtiger Nahrungsmittelbestandteil
- Amylose Struktur der Stärke
- Amylopectin Struktur der Stärke
- Agarose, Stützsubstanz mancher Algen
- Cellulose, Stützsubstanz im Pflanzenreich
- Glycogen, Energiespeicher in Muskeln und Leber
- Hyaluronsäure, Schutz vor mechanischer Belastung im Knorpelgewebe
- Chitin, Stützsubstanz des Exoskeletts der Gliedertiere
- Callose, Reparaturkohlenhydrat in Pflanzen
- Fructane, weiteres Speicherkohlenhydrat in Pflanzen
- Dextrane, industriell genutztes, bakterielles Polysaccharid
- Pektine, gehören zu den Ballaststoffen
- Stärke, wichtiger Nahrungsmittelbestandteil
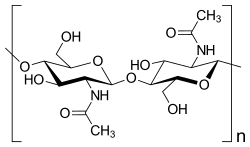
- Cyclodextrine: cyclische Oligosaccharide mit chiralem Hohlraum
- α-Cyclodextrin (Ring aus sechs Glucoseeinheiten)
- β-Cyclodextrin (sieben Glucoseeinheiten)
- γ-Cyclodextrin (acht Glucoseeinheiten)
Pathobiochemie
Die übermäßige Einnahme von Kohlenhydraten, insbesondere von Zuckern, ist mit einem erhöhten Risiko für Übergewicht, für das metabolische Syndrom und Diabetes mellitus Typ 2 assoziiert.[70][71] Durch Einnahme von Kohlenhydraten mit niedrigem glykämischem Index, von Ballaststoffen, Fetten mit ungesättigten Fettsäuren und fettarmen Proteinquellen sowie durch Minderung der Einnahme von Zuckern und Polysacchariden mit hohem glykämischem Index kann das Risiko für Typ 2 Diabetes gesenkt werden.[72] Durch die Einnahme von Zuckern kann Karies entstehen. Es wurde vermutet, dass Kohlenhydrate mit hohem glykämischen Index die Entstehung von Herz-Kreislauf-Erkrankungen[73] und Diabetes mellitus Typ 2[71] begünstigen und Kohlenhydrate mit niedrigem glykämischen Index davor schützen. Die Schutzwirkung von Kohlenhydraten mit niedrigem glykämischen Index vor Herz-Kreislauf-Erkrankungen konnte nicht bestätigt werden.[74] Zu den Störungen des Kohlenhydratstoffwechseln gehören unter anderem auch die Glykogenspeicherkrankheit Von-Gierke-Krankheit, Melliturien wie die Fructosurie, die Galaktosämie und der Diabetes renalis.[75]
Analytik
Die Isolierung von Kohlenhydraten erfolgt durch Chromatographie oder per Gelelektrophorese,[28] darunter die Größenausschlusschromatographie und die Kapillarelektrophorese.[76] Mit Lektinen kann eine Affinitätschromatographie durchgeführt werden.[28]
In konzentrierten Lösungen von Zuckern mit geringem Anteil anderer Kohlenhydrate kann ihre Konzentration mit einem Polarimeter bestimmt werden. Bei Zuckermischungen kann die Konzentration mit einem Refraktometer ermittelt werden, beispielsweise bei der Oechsle-Bestimmung im Zuge der Herstellung von Wein, bei der Bestimmung der Stammwürze beim Bierbrauen und als Imkereigerät zur Bestimmung des Wassergehalts von Honig.
Klassische Nachweise
Für Unterrichts- und Ausbildungszwecke werden aufgrund ihrer Anschaulichkeit und Farbenpracht auch heute noch über 100 Jahre alte Nachweisreaktionen verwendet, allen voran die Fehling-Probe aus dem Jahr 1848.[77] Allerdings sind viele der alten Nachweise verbesserungsbedürftig, da Stoffe wie 1-Naphthol für Schülerversuche gemäß Richtlinie zur Sicherheit im Unterricht als ungeeignet erscheinen. Für die Molisch-Probe[78] wird daher ein Ersatzverfahren mit Carvacrol anstelle von 1-Naphthol vorgeschlagen.[77] Die Unterscheidung von Monosacchariden von Di-, Oligo- oder Polysacchariden ist durch die Barfoedsche Probe möglich.[79] Aldosen und Ketosen können durch die Seliwanow-Probe mit Resorcin unterschieden werden.[80] Reduzierende Zucker können mit der Fehling-Probe nachgewiesen werden, bei der sich bei Anwesenheit von Aldehyden und reduzierenden Zuckern (Aldosen und Acyloine) rot-braunes Kupfer(I)-oxid bildet.[81] Neben der Fehling-Probe können reduzierende Zucker auch mit Hilfe des Benedict-Reagenz (durch die Farbe des ausfallenden Produkts),[82] mit Nylanders Reagenz,[83] mit 3,5-Dinitrosalicylsäure[84] oder aufgrund der Entfärbung einer Kaliumpermanganat-Lösung nachgewiesen werden. Die Unterscheidung von Pentosen und Hexosen kann durch die Mejbaum-Probe mit Orcin oder durch die Bial-Probe (ebenfalls mit Orcin) erfolgen.[85][86] Durch die Dische-Probe kann mit Diphenylamin Desoxyribose nachgewiesen werden.[87] Acetylierte Aminozucker können durch die Morgan-Elson-Reaktion nachgewiesen werden. Dabei werden unter basischen Bedingungen Furane gebildet, die anschließend mit Ehrlichs Reagenz umgesetzt werden.[88] Lactose und weitere 1,4-verknüpfte Disaccharide können mit der Wöhlk-Reaktion, Fearon's Test und dem 1,6-Diaminohexan-Verfahren nachgewiesen werden.[89] Cellulose lässt sich durch Chlorzinkiod-Lösung[90] nachweisen. Stärke und Chitin können mit der Lugol-Lösung angefärbt werden. Stärke kann auch mit Melzers Reagenz angefärbt werden.[91]
Moderne Methoden
Neuere analytische Methoden zum qualitativen und quantitativen Nachweis einzelner Kohlenhydrate in unterschiedlichen Untersuchungsmaterialien verwenden nach hinreichender Probenvorbereitung und gegebenenfalls Derivatisierung,[92] chromatographische Trennverfahren in Kopplung mit der Massenspektrometrie.[93][94][95][96][97] Ebenso wird die Kapillarelektrophorese vor einer Massenspektrometrie verwendet.[98] Für spezielle Kohlenhydrate werden auch ausgewählte TMS-Derivate eingesetzt.[99][100] Mit markierten Lektinen können bestimmte Kohlenhydrate nachgewiesen werden. Ebenso können verschiedene Kohlenhydrate per FT-Infrarotspektroskopie, FT-Raman-Spektroskopie und Kernspinmagnetresonanzspektroskopie untersucht werden.[38][101]
Industrielle Erzeugung und Verwendung

Kohlenhydrate werden für Lebensmittel meist aus agrarwirtschaftlich erzeugten Getreiden gewonnen. Kohlenhydrate gehören zu den nachwachsenden Rohstoffen. Stärke ist ein Hauptbestandteil von Mehl und von mehlhaltigen Lebensmitteln. Die kurzkettigen Kohlenhydrate (Zucker) werden als Süßungsmittel verwendet. In gereinigter Form werden Monosaccharide wie zum Beispiel Glucosesirup oder Isoglucose aus Stärke erzeugt und als Süßungsmittel bei der Herstellung von Lebensmitteln eingesetzt.[102] Saccharose wird ebenso als Süßungsmittel verwendet. Gereinigte Polysaccharide sind beispielsweise Maisstärke, Weizenstärke, Kartoffelstärke und Zellstoff. Aus Stärke wird auch Stärkekleister hergestellt.[103]
Cellulosen aus der Baumwollfaser, aus der Flachsfaser und aus verschiedenen anderen pflanzlichen Naturfasern werden aus Faserpflanzen isoliert und zur Herstellung von Textilien verwendet.[23] Cellulose wird auch als Rohstoff für Papier und Karton[104] sowie zur Herstellung von Biokraftstoffen wie Cellulose-Ethanol[105] verwendet. Textilien werden auch aus umgewandelten Cellulosen hergestellt, beispielsweise Viskose, Modal, Lyocell und Cupro.[106] Zelluloid und Zellophan sind Derivate der Cellulose. Aufgrund der vielen Hydroxygruppen werden manche Derivate von Cellulose als Klebstoffe eingesetzt, beispielsweise bei Kleistern wie Methylcellulose,[103] oder als Lacke, wie beispielsweise Kollodiumwolle in Nitrolacken.[107]
In der Medizin werden verschiedene Kohlenhydrate und deren Derivate als Arzneistoffe eingesetzt. Beispielsweise wird Glucose für Infusionslösungen verwendet.[108] Manche Kohlenhydrate werden als Ausgangsstoff bei der Herstellung von Zytostatika und Antibiotika verwendet.[109] Auch besitzen verschiedene Blutgerinnungshemmer eine Kohlenhydratstruktur, wie beispielsweise Heparin.[110]
In der Biochemie werden polymere Kohlenhydrate unter anderem als Filterpapier und als stationäre Phase bei der Chromatographie (Diethylaminoethylcellulose, Carboxymethylcellulose, vernetztes Dextran, vernetzte Agarose)[111] und bei der Immunpräzipitation verwendet. Nitrocellulose wird beim Blotting für Blotmembranen verwendet.[112]
Literatur
- Thisbe K. Lindhorst: Struktur und Funktion von Kohlenhydraten. In: Chemie in unserer Zeit. Band 34, 2000, Nr. 1, S. 38–52. doi:10.1002/1521-3781(200002)34:1<38::AID-CIUZ38>3.0.CO;2-L
- Thomas K. Ritter, Chi-Huey Wong: Kohlenhydrate in der Antibiotikaforschung – ein neuer Ansatz zur Resistenzbekämpfung. In: Angewandte Chemie. Band 113, Nr. 19, 2001, S. 3616–3641. doi:10.1002/1521-3757(20011001)113:19<3616::AID-ANGE3616>3.0.CO;2-B
- Robert V. Stick, Spencer Williams: Carbohydrates: The Essential Molecules of Life. 2. Auflage, Elsevier, 2010, ISBN 978-0-08-092702-2.
- Jochen Lehmann: Kohlenhydrate. Chemie und Biologie. Thieme, Stuttgart/ New York 1996, ISBN 3-13-532902-X.
Weblinks
Einzelnachweise
- Frieder W. Lichtenthaler: Carbohydrates, in: Ullmann's Encyclopedia of Industrial Chemistry, 7. Auflage, Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32943-4.
- Donald Voet, Judith G. Voet: Biochemistry, 4th Edition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1. S. 359.
- Annalen der Chemie. 51, 30, 1844.
- P. Avenas: Etymology of main polysaccharide names. In: P. Navard (Hrsg.): The European Polysaccharide Network of Excellence (EPNOE). Springer-Verlag, Wien 2012.
- Schweigers Journal für Chemie und Physik. 14, 389, 1814.
- Annales de chimie et des physique (2) 12, 172, 1819.
- Phil. Tr. 1827, 355.
- Emil Fischer – Facts. In: nobelprize.org. 15. Juli 1919, abgerufen am 15. Juli 2018 (englisch).
- Otto Meyerhof – Facts. In: nobelprize.org. 15. Juli 2018, abgerufen am 15. Juli 2018 (englisch).
- Hans von Euler-Chelpin – Facts. In: nobelprize.org. Abgerufen am 3. September 2018 (englisch).
- Arthur Harden – Facts. In: nobelprize.org. 17. Juni 1940, abgerufen am 3. September 2018 (englisch).
- Bernardo Houssay – Facts. In: nobelprize.org. 21. September 1971, abgerufen am 15. Juli 2018 (englisch).
- Carl Cori – Facts. In: nobelprize.org. 20. Oktober 1984, abgerufen am 15. Juli 2018 (englisch).
- Gerty Cori – Facts. In: nobelprize.org. 26. Oktober 1957, abgerufen am 15. Juli 2018 (englisch).
- Luis Leloir – Facts. In: nobelprize.org. 15. Juli 2018, abgerufen am 15. Juli 2018 (englisch).
- U. Satyanarayana: Biochemistry. Elsevier Health Sciences, 2014, ISBN 978-8-131-23713-7. S. 9.
- IUPAC: Eintrag zu molecular entity. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00820.
- H.-D. Belitz, W. Grosch, P. Schieberle: Food Chemistry. Springer Science & Business Media, 2009, ISBN 978-3-540-69933-0, S. 248, 262.
- Waldemar Ternes, Alfred Täufel, Lieselotte Tunger, Martin Zobel (Hrsg.): Lebensmittel-Lexikon. 4., umfassend überarbeitete Auflage. Behr, Hamburg 2005, ISBN 3-89947-165-2., Seiten 1606–1612.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry. 7. Auflage, Springer-Verlag, 2010, ISBN 978-1-4292-2936-4, S. 319–321.
- Steve W. Cui: Food Carbohydrates. CRC Press, 2005, ISBN 978-0-203-48528-6, S. 6, 7.
- B. Sivasankar: Food Processing and Preservation. PHI Learning Pvt. Ltd., 2002, ISBN 978-8-120-32086-4, S. 23.
- Kenji Kamide: Cellulose and Cellulose Derivatives. Elsevier, 2005, ISBN 978-0-08-045444-3, S. 1.
- Search the USDA National Nutrient Database for Standard Reference. Nal.usda.gov, abgerufen am 10. Dezember 2014.
- IUPAC Nomenclature of Carbohydrates bzw. Abschnitt 2-Carb-33: Glycosides and glycosyl compounds.
- Reginald H. Garrett: Biochemistry. Cengage Learning, 2012, ISBN 978-1-133-10629-6, S. 194, 199.
- Michael Hellwig, Thomas Henle: Backen, Altern, Diabetes: eine kurze Geschichte der Maillard-Reaktion. In: Angewandte Chemie. Band 126, Nr. 39. Wiley-Verlag, Weinheim 22. September 2014, S. 10482–10496, doi:10.1002/ange.201308808 (wiley.com [abgerufen am 20. Februar 2022]).
- Donald Voet, Judith G. Voet: Biochemistry, 4th Edition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1. S. 383.
- Michael Sinnott: Carbohydrate Chemistry and Biochemistry. Royal Society of Chemistry, 2007, ISBN 978-0-85404-256-2, S. 16.
- Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Food chemistry. Springer, Berlin 2009, ISBN 978-3-540-69935-4, S. 270–289.
- D. B. Werz: Chemical synthesis of carbohydrates and their surface immobilization: a brief introduction. In: Methods in molecular biology. Band 808, 2012, S. 13–29, doi:10.1007/978-1-61779-373-8_2, PMID 22057515.
- R. Renner, A. M. Elcombe: Metabolic effects of feeding „carbohydrate-free“ diets to chicks. In: The journal of nutrition. Band 93, 1967, S. 31–36.
- Johns Hopkins Medical Institutions: High-Fat Ketogenic Diet to Control Seizures Is Safe Over Long Term, Study Suggests. Science Daily, 17. Februar 2010, abgerufen am 4. März 2011 (englisch): „Despite its temporary side effects, we have always suspected that the ketogenic diet is relatively safe long term, and we now have proof.“
- Eric C Westman: Is dietary carbohydrate essential for human nutrition? In: Am J Clin Nutr. Band 75, Nr. 5. American Society for Clinical Nutrition, 1. Mai 2002, S. 951–953 (englisch, ajcn.org [abgerufen am 25. April 2011]). Is dietary carbohydrate essential for human nutrition? (Memento des Originals vom 21. September 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Eintrag zu Kohlenhydrate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry. 7. Auflage, Springer-Verlag, 2010, ISBN 978-1-4292-2936-4, S. 329–337.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry. 7. Auflage, Springer-Verlag, 2010, ISBN 978-1-4292-2936-4, S. 349.
- G. Widmalm: A perspective on the primary and three-dimensional structures of carbohydrates. In: Carbohydrate research. Band 378, August 2013, S. 123–132, doi:10.1016/j.carres.2013.02.005, PMID 23522728.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry. 7. Auflage, Springer-Verlag, 2010, ISBN 978-1-4292-2936-4, S. 479–491.
- Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3, S. 27.
- Florian Horn: Biochemie des Menschen. Georg Thieme Verlag, 2009, ISBN 978-3-13-130884-9, S. 146–149.
- Jan Koolman: Taschenatlas der Biochemie. Georg Thieme Verlag, 2003, ISBN 978-3-13-759403-1, S. 180.
- Reginald H. Garrett: Biochemistry. Cengage Learning, 2016, ISBN 978-1-305-88689-6, S. 757.
- Vassilis Mougios: Exercise Biochemistry. Human Kinetics, 2006, ISBN 978-0-7360-5638-0, S. 170.
- Norman N. Potter: Food Science. Springer Science & Business Media, 2012, ISBN 978-1-4615-4985-7, S. 47.
- L. Q. Chen, L. S. Cheung, L. Feng, W. Tanner, W. B. Frommer: Transport of sugars. In: Annual review of biochemistry. Band 84, 2015, S. 865–894, doi:10.1146/annurev-biochem-060614-033904, PMID 25747398.
- S. J. Shepherd, M. C. Lomer, P. R. Gibson: Short-chain carbohydrates and functional gastrointestinal disorders. In: The American Journal of Gastroenterology. Band 108, Nummer 5, Mai 2013, S. 707–717, doi:10.1038/ajg.2013.96, PMID 23588241.
- A. E. Buyken, D. J. Mela, P. Dussort, I. T. Johnson, I. A. Macdonald, J. D. Stowell, F. J. Brouns: Dietary carbohydrates: a review of international recommendations and the methods used to derive them. In: European Journal of Clinical Nutrition. [elektronische Veröffentlichung vor dem Druck] April 2018, doi:10.1038/s41430-017-0035-4, PMID 29572552.
- WHO: Joint FAO/WHO Scientific update on carbohydrates in human nutrition. In: European Journal of Clinical Nutrition, Band 61(Supplement 1), Dezember 2007.
- B. Lennerz, J. K. Lennerz: Food Addiction, High-Glycemic-Index Carbohydrates, and Obesity. In: Clinical chemistry. Band 64, Nummer 1, Januar 2018, S. 64–71, doi:10.1373/clinchem.2017.273532, PMID 29158252, PMC 5912158 (freier Volltext).
- A. Bosy-Westphal, M. J. Müller: Impact of carbohydrates on weight regain. In: Current opinion in clinical nutrition and metabolic care. Band 18, Nummer 4, Juli 2015, S. 389–394, doi:10.1097/MCO.0000000000000193, PMID 26049636.
- A. Pan, F. B. Hu: Effects of carbohydrates on satiety: differences between liquid and solid food. In: Current opinion in clinical nutrition and metabolic care. Band 14, Nummer 4, Juli 2011, S. 385–390, doi:10.1097/MCO.0b013e328346df36, PMID 21519237.
- L. M. Burke, J. A. Hawley, S. H. Wong, A. E. Jeukendrup: Carbohydrates for training and competition. In: Journal of sports sciences. Band 29 Suppl 1, 2011, S. S17–S27, doi:10.1080/02640414.2011.585473, PMID 21660838.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry. 7. Auflage, Springer-Verlag, 2010, ISBN 978-1-4292-2936-4, S. 430.
- Donald Voet, Judith G. Voet: Biochemistry, 4th Edition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1.
- Donald Voet, Judith G. Voet: Biochemistry, 4th Edition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1. S. 790.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry. 7. Auflage, Springer-Verlag, 2010, ISBN 978-1-4292-2936-4, S. 499.
- K J Acheson, Y Schutz, T Bessard, K Anantharaman, J P Flatt: Glycogen storage capacity and de novo lipogenesis during massive carbohydrate overfeeding in man. In: The American Journal of Clinical Nutrition. Band 48, Nr. 2, 1. August 1988, ISSN 0002-9165, S. 240–247, doi:10.1093/ajcn/48.2.240 (oup.com [abgerufen am 12. Dezember 2019]).
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry. 7. Auflage, Springer-Verlag, 2010, ISBN 978-1-4292-2936-4, S. 436.
- Donald MacLaren: Biochemistry for Sport and Exercise Metabolism. John Wiley & Sons, 2011, ISBN 978-1-119-96782-8, S. 7.
- Ingo Froböse: „Morgens vor dem Frühstück laufen verbrennt mehr Fett!“ Und: „Nach dem Muskeltraining soll man dehnen!“ (Memento vom 13. August 2009 im Internet Archive)
Die größten Sport-Irrtümer. Folge 1. In: ARD-Morgenmagazin. - Kurt A. Moosburger (Facharzt für Innere Medizin und Sportarzt, Institut für Biostatistik und Dokumentation, Universität Innsbruck): „Fettverbrennung“ im Sport: Mythos und Wahrheit. (Memento des Originals vom 2. Februar 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF). In: Gesünder Leben. 05/2000.
- M. E. Thompson, M. B. Noel: Issues in Nutrition: Carbohydrates. In: FP essentials. Band 452, Januar 2017, S. 26–30, PMID 28092151.
- A. Y. Tamime: Yoghurt. Woodhead Publishing, 1999, ISBN 978-1-85573-399-2, S. 11.
- Cecie Starr: Biology: Concepts and Applications. Cengage Learning, 2014, ISBN 978-1-285-42781-2. S. 123.
- Carlos Ricardo Soccol: Fermentation Processes Engineering in the Food Industry. CRC Press, 2013, ISBN 978-1-4398-8768-4, S. 60 ff.
- Michael J. Lewis: Brewing. Springer Science & Business Media, 2012, ISBN 978-1-4615-0729-1, S. 319.
- Eduardo Pires: Biochemistry of Beer Fermentation. Springer, 2015, ISBN 978-3-319-15189-2, S. 11.
- M. Victoria Moreno-Arribas: Wine Chemistry and Biochemistry. Springer Science & Business Media, 2008, ISBN 978-0-387-74118-5, S. 655.
- R. J. Johnson, T. Nakagawa, L. G. Sanchez-Lozada, M. Shafiu, S. Sundaram, M. Le, T. Ishimoto, Y. Y. Sautin, M. A. Lanaspa: Sugar, uric acid, and the etiology of diabetes and obesity. In: Diabetes. Band 62, Nummer 10, Oktober 2013, S. 3307–3315, doi:10.2337/db12-1814, PMID 24065788, PMC 3781481 (freier Volltext).
- D. C. Greenwood, D. E. Threapleton, C. E. Evans, C. L. Cleghorn, C. Nykjaer, C. Woodhead, V. J. Burley: Glycemic index, glycemic load, carbohydrates, and type 2 diabetes: systematic review and dose-response meta-analysis of prospective studies. In: Diabetes care. Band 36, Nummer 12, Dezember 2013, S. 4166–4171, doi:10.2337/dc13-0325, PMID 24265366, PMC 3836142 (freier Volltext).
- K. C. Maki, A. K. Phillips: Dietary substitutions for refined carbohydrate that show promise for reducing risk of type 2 diabetes in men and women. In: The Journal of nutrition. Band 145, Nummer 1, Januar 2015, S. 159S–163S, doi:10.3945/jn.114.195149, PMID 25527674.
- S. W. Rizkalla: Glycemic index: is it a predictor of metabolic and vascular disorders? In: Current opinion in clinical nutrition and metabolic care. Band 17, Nummer 4, Juli 2014, S. 373–378, doi:10.1097/MCO.0000000000000070, PMID 24878873.
- C. Clar, L. Al-Khudairy, E. Loveman, S. A. Kelly, L. Hartley, N. Flowers, R. Germanò, G. Frost, K. Rees: Low glycaemic index diets for the prevention of cardiovascular disease. In: The Cochrane database of systematic reviews. Band 7, 07 2017, S. CD004467, doi:10.1002/14651858.CD004467.pub3, PMID 28759107.
- Ludwig Weissbecker: Krankheiten des Kohlenhydratstoffwechsels. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1117–1119.
- S. Honda: Separation of neutral carbohydrates by capillary electrophoresis. In: Journal of chromatography. A. Band 720, Nummer 1–2, Januar 1996, S. 337–351, PMID 8601200.
- Hanne Rautenstrauch, Klaus Ruppersberg, Wolfgang Proske: Chemiedidaktik: Welcher Zucker ist in der Probe? In: Nachrichten aus der Chemie. Band 70, Nr. 2. Wiley-Verlag, 1. Februar 2022, ISSN 1439-9598, S. 15–20, doi:10.1002/nadc.20224116610 (wiley.com [abgerufen am 20. Februar 2022]).
- Hans Molisch, in: Monatsh. Chem. (1886), Band 7, S. 198.
- C. Barfoed: Über die Nachweisung des Traubenzuckers neben Dextrin und verwandten Körpern. In: Zeitschrift für Analytische Chemie. 12, Nr. 1, 1873, S. 27. doi:10.1007/BF01462957.
- Theodor Seliwanoff: „Notiz über eine Fruchtzuckerreaction“. In: Berichte der deutschen chemischen Gesellschaft, 20 (1), 1887, S. 181–182, doi:10.1002/cber.18870200144.
- H. Fehling: Quantitative Bestimmung des Zuckers im Harn. In: Archiv für physiologische Heilkunde (1848), Band 7, S. 64–73.
- Stanley Benedict: A reagent for the detection of reducing sugars. In: J. Biol. Chem., 1909, 5, S. 485–487.
- Emil Nylander: Über alkalische Wismuthlösung als Reagens auf Traubenzucker im Harne, Zeitschrift für physiologische Chemie. Band 8, Heft 3, 1884, S. 175–185 Abstract
- J. B. Sumner: Dinitrosalicylic acid: a reagent for the estimation of sugar in normal and diabetic urine. In: Journal of Biological Chemistry (1921), Band 47, S. 5.
- Wanda Mejbaum: Über die Bestimmung kleiner Pentosemengen, insbesondere in Derivaten der Adenylsäure. In: Hoppe-Seyler´s Zeitschrift für physiologische Chemie. 258, 1939, S. 117, doi:10.1515/bchm2.1939.258.2-3.117.
- M. Bial: Ueber die Diagnose der Pentosurie mit dem von mir angegebenen Reagens. In: DMW – Deutsche Medizinische Wochenschrift. 29, 1903, S. 477, doi:10.1055/s-0028-1138555.
- L. Jaenicke: Erinnerungsbild Zacharias Dische: Tausendsassa, im Gedächtnis durch obsolete Reaktion und aktuelle Realisation. In: Biospektrum. Band 1, S. 106–108. biospektrum.de (PDF).
- Michael Sinnott: Carbohydrate Chemistry and Biochemistry. Royal Society of Chemistry, 2013, ISBN 978-1-78262-632-9, S. 721, 722.
- Klaus Ruppersberg: Nachweis von Lactose (und Maltose) im Kontext Schule. In: Zentrale Hochschulbibliothek Flensburg (ZHB). Europa-Universität Flensburg, 1. November 2021, abgerufen am 20. Februar 2022 (deutsch).
- EBCONT Communications: Chlorzinkiod-Lösung. In: Roempp Chemisches Lexikon. Thieme-Verlag, abgerufen am 20. Februar 2022.
- M. V. Melzer: L'ornementation des spores de Russules. In: Bull. Soc. myc. Fr. (1924). Band 40, S. 78–81.
- A. I. Ruiz-Matute, O. Hernández-Hernández, S. Rodríguez-Sánchez, M. L. Sanz, I. Martínez-Castro: Derivatization of carbohydrates for GC and GC-MS analyses. In: Journal of Chromatography B. Band 879, Nummer 17–18, Mai 2011, S. 1226–1240, doi:10.1016/j.jchromb.2010.11.013, PMID 21186143.
- B. Zhu, F. Liu, X. Li, Y. Wang, X. Gu, J. Dai, G. Wang, Y. Cheng, C. Yan: Fast quantification of endogenous carbohydrates in plasma using hydrophilic interaction liquid chromatography coupled with tandem mass spectrometry. In: J Sep Sci. 38(1), Jan 2015, S. 34–41. PMID 25359182.
- B. Du, L. Wu, X. Xue, L. Chen, Y. Li, J. Zhao, W. Cao: Rapid Screening of Multiclass Syrup Adulterants in Honey by Ultrahigh-Performance Liquid Chromatography/Quadrupole Time of Flight Mass Spectrometry. In: J Agric Food Chem. 63(29), 29. Jul 2015, S. 6614–6623. PMID 26151590.
- D. J. Harvey: Derivatization of carbohydrates for analysis by chromatography; electrophoresis and mass spectrometry. In: J Chromatogr B Analyt Technol Biomed Life Sci. 879(17–18), 15. Mai 2011, S. 1196–1225, Review. PMID 21145794.
- M. B. Clarke, D. Z. Bezabeh, C. T. Howard: Determination of carbohydrates in tobacco products by liquid chromatography-mass spectrometry/mass spectrometry: a comparison with ion chromatography and application to product discrimination. In: J Agric Food Chem. 54(6), 22. Mar 2006, S. 1975–1981. PMID 16536564.
- D. J. Harvey: Analysis of carbohydrates and glycoconjugates by matrix-assisted laser desorption/ionization mass spectrometry: An update for 2013–2014. In: Mass spectrometry reviews. Band 37, Nummer 4, Juli 2018, S. 353–491, doi:10.1002/mas.21530, PMID 29687922.
- J. Zaia: Capillary electrophoresis-mass spectrometry of carbohydrates. In: Methods in molecular biology. Band 984, 2013, S. 13–25, doi:10.1007/978-1-62703-296-4_2, PMID 23386333, PMC 4108199 (freier Volltext).
- I. Boldizsár, Z. Füzfai, I. Molnár-Perl: Characteristic fragmentation patterns of trimethylsilyl and trimethylsilyl-oxime derivatives of plant disaccharides as obtained by gas chromatography coupled to ion-trap mass spectrometry. In: J Chromatogr A. 1218(43), 28. Okt 2011, S. 7864–7848. PMID 21924428.
- V. Ratsimba, J. M. García Fernández, J. Defaye, H. Nigay, A. Voilley: Qualitative and quantitative evaluation of mono- and disaccharides in D-fructose, D-glucose and sucrose caramels by gas-liquid chromatography-mass spectrometry. Di-D-fructose dianhydrides as tracers of caramel authenticity. In: J Chromatogr A. 844(1-2), 4. Jun 1999, S. 283–293. PMID 10399331.
- E. Wiercigroch, E. Szafraniec, K. Czamara, M. Z. Pacia, K. Majzner, K. Kochan, A. Kaczor, M. Baranska, K. Malek: Raman and infrared spectroscopy of carbohydrates: A review. In: Spectrochimica acta. Part A, Molecular and biomolecular spectroscopy. Band 185, Oktober 2017, S. 317–335, doi:10.1016/j.saa.2017.05.045, PMID 28599236.
- S.Z. Dziedzic: Handbook of Starch Hydrolysis Products and their Derivatives. Springer Science & Business Media, 2012, ISBN 978-1-4615-2159-4, S. 2, 56.
- Kurt Schönburg: Beschichtungstechniken heute. Beuth Verlag, 2013, ISBN 978-3-410-21090-0, S. 114.
- John N. Owens: Forests And Forest Plants – Volume II. EOLSS Publications, 2009, ISBN 978-1-905839-39-1, S. 159.
- Ram B. Gupta: Gasoline, Diesel, and Ethanol Biofuels from Grasses and Plants. Cambridge University Press, 2010, ISBN 978-1-139-48906-5, S. 84, 85.
- Dipa Ray: Biocomposites for High-Performance Applications. Woodhead Publishing, 2017, ISBN 978-0-08-100794-5, S. 23.
- Bernhard Schrader: Kurzes Lehrbuch der organischen Chemie. De Gruyter, 2009, ISBN 978-3-11-020360-8, S. 206.
- WHO Model List of Essential Medicines. In: World Health Organization. Oktober 2013, archiviert vom Original am 23. April 2014; abgerufen am 22. April 2014.
- C. A. A. van Boeckel: Some recent applications of carbohydrates and their derivatives in the pharmaceutical industry. In: Recueil des Travaux Chimiques des Pays-Bas (1986). Band 105, Ausgabe 2, S. 35–53. doi:10.1002/recl.19861050202.
- Berit S. Paulsen: Bioactive Carbohydrate Polymers. Springer Science & Business Media, 1999, ISBN 978-0-7923-6119-0, S. 47.
- David Sheehan: Physical Biochemistry. John Wiley & Sons, 2013, ISBN 978-1-118-68748-2. S. 21.
- G. Tripathi: Cellular and Biochemical Science. I. K. International Pvt Ltd, 2010, ISBN 978-8-188-23785-2, S. 1191.