Arsenwasserstoff
Arsenwasserstoff (Monoarsan, Arsin, Arsenhydrid) ist eine chemische Verbindung aus den Elementen Arsen und Wasserstoff mit der Summenformel AsH3. Es ist ein äußerst giftiges Gas, das bei der Auflösung von salzartigen Arseniden in Wasser und verdünnten Säuren entsteht.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Arsenwasserstoff | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | AsH3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit unangenehmem Knoblauchgeruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 77,95 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
3,52 kg·m−3 [2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−62,48 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (200 mg·l−1)[2] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,352 (16,85 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
66,4 kJ/mol[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Die Bezeichnung „Arsenwasserstoff“ wird auch häufig für die Gesamtheit aller Arsen-Wasserstoff-Verbindungen verwendet (siehe Arsane).
Geschichte
Im Ersten Weltkrieg wurde Arsenwasserstoff als Grünkreuz-Kampfstoff eingesetzt.
Gewinnung und Darstellung
Technisch wird Arsenwasserstoff in einstufiger Reaktion durch saure Hydrolyse von Arseniden hergestellt. Üblich und sehr einfach durchzuführen ist beispielsweise die Hydrolyse von Zinkarsenid in nicht-oxidierender, wässriger Säure (beispielsweise Schwefelsäure):[1]
Bei sorgfältiger Auswahl der Ausgangsstoffe lässt sich auf diesem Weg sehr reiner Arsenwasserstoff erzeugen.[9] Als Nebenprodukt entsteht das oberhalb von −100 °C instabile Diarsan. Weiterhin liefert auch die Hydrierung von Arsen(III)-chlorid (AsCl3) mittels LiAlH4 oder NaBH4 reinen Arsenwasserstoff.
Aus Arsen(III)-oxid lässt sich Arsenwasserstoff mittels naszierendem Wasserstoff gewinnen:[1]
Weiter liefern die Umsetzungen von Calcium- und Natriumarsenid mit Wasser Arsin. Wird statt regulärem Wasser Deuteriumoxid verwendet, so entsteht Arsin-d3.[10]
Sowie die Umsetzung von Natriumarsenid mit Ammoniumbromid in flüssigem Ammoniak.[11]
Auch die elektrochemische Herstellung von Arsenwasserstoff ist ein gangbarer Weg, der schnell an Bedeutung gewinnt. Die elektrochemische Synthese erlaubt die relativ gezielte Ad-hoc-Herstellung definierter Arsenwasserstoff-Mengen. Die ersten Patente zur elektrochemischen Herstellung von Arsenwasserstoff und anderen Hydriden wurden bereits zu Beginn der 1990er Jahre veröffentlicht.
Eigenschaften
Physikalische Eigenschaften

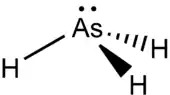
Arsenwasserstoff ist ein pyramidales Molekül mit den drei Wasserstoff-Atomen an der dreieckigen Pyramidenbasis und dem Arsen-Atom an der Pyramidenspitze. Der Bindungswinkel H–As–H ist mit 91,83° um einiges geringer als der Tetraederwinkel von 109,5°, da zum Einen das freie Elektronenpaar am Arsen eine größere elektrostatische Abstoßung ausübt als die bindenden Elektronenpaare. Zum Anderen bewirkt die Bindungslänge As-H von 0,1519 nm, dass die abstoßenden Kräfte zwischen den Schwerpunkten der elektrischen Ladung zweier As–H-Bindungen bei kleineren Bindungswinkeln im Gleichgewicht sind.
Arsenwasserstoff besitzt ein schwaches elektrisches Dipolmoment von 0,22 Debye.
Arsenwasserstoff ist gasförmig und außerordentlich giftig. Es ist farblos und riecht, durch fast immer vorhandene Verunreinigungen, leicht knoblauchartig. Die Geruchsschwelle liegt oberhalb des ehemaligen MAK Wertes von 50 ppb. Das Gas verflüssigt sich bei −62,48 °C (Siedepunkt) und geht bei −116,93 °C (Schmelzpunkt) in den festen Aggregatzustand über. Der Wert für die Standardbildungsenthalpie von +66,44 kJ/mol bei 25 °C zeigt, dass Arsenwasserstoff eine endotherme chemische Verbindung ist.[11] Das bedeutet, dass die Bildung des Moleküls mehr Energie verbraucht als bei der Reaktion frei wird. Die molare Standardentropie beträgt 222,7 J/(mol·K) bei 25 °C.[11]
Chemische Eigenschaften
Arsenwasserstoff ist eine instabile Verbindung, die durch Erhitzen leicht in ihre Bestandteile zerfällt:
Wird Arsenwasserstoff verbrannt oder durch ein auf Rotglut erhitztes Glasrohr geleitet und trifft anschließend auf ein gekühltes Porzellanschälchen, so bildet sich ein metallisch glänzender schwarzer Arsenspiegel. Diese chemische Reaktion wird zum analytischen Nachweis von Arsen verwendet (siehe Marshsche Probe).
Arsenwasserstoff verbrennt bei Anwesenheit von Luft mit fahlblauer Flamme zu Arsen(III)-oxid und Wasser:
Bei Luftmangel oder bei kühleren Verbrennungstemperaturen verbrennt nur der Wasserstoff. Arsen bleibt in Form von schwarzem Arsen zurück. Das gleiche Verhalten wird auch bei der Verbrennung von Schwefelwasserstoff beobachtet.
Arsenwasserstoff (AsH3) ist im Gegensatz zu Ammoniak (NH3) keine Base. Er wirkt in wässriger Lösung als starkes Reduktionsmittel. Bei Zugabe zu Silbernitrat-Lösung fällt metallisches Silber aus:
Bei Temperaturen unter −10 °C oder unter Druck bildet sich bei Anwesenheit von Wasser das Hexahydrat.[11]
Verwendung
Trotz seiner Vergangenheit als chemische Waffe ist Arsenwasserstoff heute ein gebräuchliches technisches Produkt. In der Halbleitertechnik wird Arsenwasserstoff als Dotiergas im großen Stil und nicht unbedeutender Menge im Rahmen der thermischen Dotierung von Silicium im Diffusionsprozess und bei der Ionenimplantation eingesetzt.
Die Entsorgung von Arsenwasserstoff-Rückständen ist sehr problematisch, da nicht nur Arsenwasserstoff selbst, sondern auch alle Arsenwasserstoff-Folgeprodukte extrem toxisch oder gesundheitsschädlich sind. Üblich ist die Adsorption an Aktivkohle. Nach Gebrauch muss die beladene Aktivkohle als Sondermüll in speziellen Tiefdeponien endgelagert werden.
Antidote bei Arsinvergiftung
Bei Vergiftung wird in Notfallkliniken Dimercaptopropansulfonsäure (DMPS): Dimaval oder Dimercaptopropansulfonat als Gegengift verabreicht. Es handelt sich dabei um (RS)-2,3-Dimercapto-1-propansulfonsäure. Von einigen Ärzten wird DMPS jedoch als wirkungslos angesehen.
Sicherheitshinweise
Arsenwasserstoff ist die toxischste Arsenverbindung. Ist man einer Konzentration von 20 mg/m³ länger als 50 Minuten ausgesetzt, so wirkt diese tödlich (letale Konzentration). 3–10 mg/m³ rufen nach mehreren Stunden Vergiftungserscheinungen hervor. Es ist insbesondere darauf zu achten, dass Notfallmaßnahmen bei Verdacht auf einen Kontakt mit Arsenwasserstoff sofort durchgeführt werden, da die durch Arsenwasserstoff ausgelöste Hämolyse zeitverzögert auftreten kann. Notfallkliniken sind in der Regel bei der Behandlung einer sehr selten vorkommenden Arsenwasserstoffvergiftung überfordert. Die verfügbare Literatur gibt keine eindeutigen Handlungsanweisungen. Nutzer sollten sich daher unbedingt vorher mit der nächsten Notfallklinik für die Behandlung in einem Notfall abstimmen.
Vom Arsenwasserstoff abgeleitete Verbindungen
Ersetzt man beim Arsenwasserstoff AsH3 ein, zwei oder drei Wasserstoffatome durch organische funktionelle Gruppen, so entstehen organische Arsane.
Siehe auch
Weblinks
- airliquide: Arsin
Einzelnachweise
- Eintrag zu Arsenwasserstoff. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Eintrag zu Arsenwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-51.
- P. G. Sennikov, V. E. Shkrunin, D. A. Raldugin, K. G. Tokhadze: Weak Hydrogen Bonding in Ethanol and Water Solutions of Liquid Volatile Inorganic Hydrides of Group IV-VI Elements (SiH4, GeH4, PH3, AsH3, H2S, and H2Se). 1. IR Spectroscopy of H Bonding in Ethanol Solutions in Hydrides. In: The Journal of Physical Chemistry. Band 100, Nr. 16, Januar 1996, S. 6415–6420, doi:10.1021/jp953245k.
- Eintrag zu Arsine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 2. November 2015.
- Eintrag zu Arsine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-5.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2nd ed., vol. 1, Academic Press 1963, S. 593–595.
- John E. Drake and Chris Riddle: Arsine and arsine-d3. In: F. A. Cotton (Hrsg.): Inorganic Syntheses. Band 13. McGraw-Hill Book Company, Inc., 1972, ISBN 07-013208-9 (defekt), S. 14–17 (englisch).
- G. O. Doak, G. Gilbert Long, Leon D. Freedman: Arsenic Compounds. In: Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc., 2000, S. 2 f., doi:10.1002/0471238961.0118190504150111.a01.




