Sublimation (Phasenübergang)
Als Sublimation, seltener auch Sublimierung (von lateinisch sublimatio bzw. sublimare, früher im Sinne von „läutern, destillieren, chemisch möglichst rein darstellen“,[1] von sublimis „hoch in der Luft befindlich, erhaben“), bezeichnet man den Prozess des unmittelbaren Übergangs eines Stoffes vom festen in den gasförmigen Aggregatzustand, ohne sich vorher zu verflüssigen.[2] Es handelt sich um einen rein physikalischen Vorgang, bei dem der Stoff chemisch unverändert bleibt.
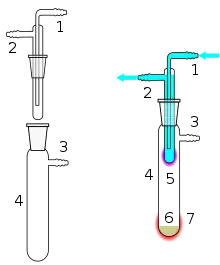
1 Eingang Kühlwasser
2 Ausgang Kühlwasser
3 Vakuumanschluss
4 Sublimationskammer
5 Sublimierter Stoff
6 Unsublimierter Stoff
7 Wärmezufuhr von außen
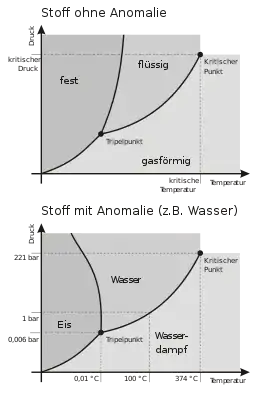
Bei den Druck- und Temperaturbedingungen, bei denen eine Sublimation auftritt, existiert kein flüssiger Aggregatzustand, wie im Phasendiagramm rechts ersichtlich. Man bezeichnet diese Bedingungen auch als Sublimationsdruck und Sublimationstemperatur, beziehungsweise zusammengenommen als Sublimationspunkt. Dieser wiederum ist ein Teil der Sublimationskurve des Phasendiagramms, die in nebenstehendem Beispiel durch die Phasengrenzlinie zwischen Feststoff und Gas unterhalb des Tripelpunktes gegeben ist.
Die Phasenumwandlung in Gegenrichtung zur Sublimation wird in der Fachsprache als Resublimation[3] oder auch als Deposition oder Desublimation bezeichnet. Der Resublimationspunkt ist bei Reinstoffen identisch mit dem Sublimationspunkt. Bei Gemischen muss man beachten, dass sich beide unterscheiden können und daher in diesem Fall auch die Richtung der Phasenumwandlung eine Rolle spielt.
Existiert bei Normaldruck eine Sublimationstemperatur, so bezeichnet man diese als Normalsublimationstemperatur und tabelliert den Stoff mit deren Wert, ohne zusätzlich den Sublimationsdruck mit anzugeben.
Jeder Stoff nimmt bei seiner Sublimation die sogenannte Sublimationsenthalpie auf, die gleich der Summe aus Schmelzenthalpie und Verdampfungsenthalpie ist.
Beispiele
- Sublimation im eigentlichen Sinne
- Bor, Kohlenstoff und Arsen, aber auch organische Verbindungen wie zum Beispiel Campher gehen bei Erhitzung unter Normaldruck direkt in Gasform über.
- Trockeneis, bei −78,5 °C gefrorenes Kohlenstoffdioxid, sublimiert bei Wärmezufuhr und tritt unmittelbar in den gasförmigen Aggregatzustand über. Dabei bildet sich unter normalen Druckbedingungen keine Flüssigkeit wie z. B. bei der Erwärmung von Wassereis: hiervon leitet sich die Bezeichnung Trockeneis ab.
- Sublimation oberhalb des Tripelpunktes
- Wasser tritt bei ausreichend kalter und trockener Luft bei Atmosphärendruck aus seinem festen Aggregatzustand Eis ebenfalls direkt in Gasform (Wasserdampf) über. Der Grund dafür ist, dass der Wasserdampfdruck ein Partialdruck der Luft ist und somit kleiner als der Atmosphärendruck der Luft. Deshalb spielt sich dieser Phasenübergang im Phasendiagramm für Wasser im Bereich der Sublimation unterhalb des Tripelpunktes ab, auch wenn es scheinbar bei Atmosphärendruck geschieht. Dank dieses Effektes trocknet feuchte Wäsche unter den entsprechenden Bedingungen bei Frost an der Außenluft schneller als in Innenräumen, deren wärmere Luft bereits mit Wasserdampf mehr oder weniger gesättigt ist.[4]
- Iod sublimiert bei Normaldruck beim Erwärmen, wobei dieses als violettes Gas besonders effektvoll ist und daher häufig als Schauexperiment genutzt wird. Tatsächlich liegt der Druck am Tripelpunkt (386,65 K, 12,1 kPa) weit unterhalb des Umgebungsdruckes (101,315 kPa). Solange jedoch die Temperatur unter dem Schmelzpunkt (113,70 °C) gehalten wird, geht Iod tatsächlich aus dem festen in den gasförmigen Zustand über. Darüber hinaus schmilzt Iod erst zu einer tief violetten bis schwarzen Flüssigkeit.[5]
Verwechslung mit Dissoziation
Die Sublimation kann mit der Dissoziation verwechselt werden. So zerfällt bspw. Ammoniumchlorid beim Erhitzen in Ammoniak und Chlorwasserstoff.
Anwendung
Bei der Werkstoffbearbeitung mittels Laserstrahlsublimierschneiden tritt mit hoher Impulsleistung des Lasers die Sublimation auf. Der Werkstoff schmilzt dabei nicht erst auf, sondern geht direkt vom festen in den gasförmigen Zustand über. Es entsteht ein sehr sauberer Schnitt ohne Schlacken und ausgefranste Ränder.
Weitere Anwendungen sind das Gefriertrocknen von Lebensmitteln, das im Vergleich zu anderen Trocknungsmethoden sehr schonend ist, sowie der Sublimationsdruck.

Die Sublimation ist auch eine Alternative zum Umkristallisieren bei der Aufreinigung von Produkten in der Synthesechemie. Gegenüber der Kristallisation bietet die Sublimation einige Vorteile: Die Produkte sind oft sehr sauber und es lassen sich auch kleinste Mengen bequem in einer Sublimationsapparatur sublimieren.[6] Ein Beispiel für die Anwendung der Sublimation kleiner Mengen im radiochemischen Feld zur radiochemischen Reinigung eines Nuklides präsentieren die Autoren im Rahmen der Halbwertszeitbestimmung von 79Se.[7][8] Die Sublimation ist vorwiegend ein Laborverfahren zur Stoffreinigung, z. B. für Ferrocen[9] und Pyrogallol. Nachteilig gegenüber der Kristallisation aus der Schmelze ist die vergleichsweise schwierige Maßstabsvergrößerung (scaling up) bei der Sublimation. In der chemischen Industrie besitzt die technische Durchführung der Sublimation als Trennmethode deshalb nur eine untergeordnete Bedeutung. Als Raffinationsverfahren für Naphthalin, Phthalsäureanhydrid, Campher, Anthrachinon, Salicylsäure, Benzoesäure, Uranhexafluorid und vieler Metalle findet die Sublimation eine technische Anwendung.[10]
Transportreaktionen
Chemische Transportreaktionen dienen der Aufreinigung von Stoffen (meist Metallen) mittels Sublimation. Hier wird jedoch der zu reinigende Stoff zuerst in chemischen Reaktionen zu einem Folgestoff umgesetzt, welcher z. B. einen niedrigeren Sublimationsdruck besitzt. Beispiele für Transportreaktionen sind das Mond-Verfahren oder das Van-Arkel-de-Boer-Verfahren.
Siehe auch
Einzelnachweise
- Wilhelm Hassenstein, Hermann Virl: Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, S. 40 (Sublimieren).
- Eintrag zu sublimation. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.S06069.
- Michael Wächter: Chemielabor – Einführung in die Laborpraxis. 1. Auflage. Wiley-VCH Verlag, Weinheim 2011, S. 76, ISBN 978-3-527-32996-0.
- jom: FRAGEN SIE NUR!: Eiskalt verdunstet. In: badische-zeitung.de, Ratgeber, Bildung & Wissen, 10. Dezember 2011 (16. Dezember 2011).
- NileRed: The Iodine Myth. Abgerufen am 13. September 2017. Gut erkennbar das Schmelzen und die tief violette Farbe des flüssigen Iodes.
- Heinz G. O. Becker et al.: Organikum, Johann Ambrosius Barth Verlag Leipzig, Berlin, Heidelberg, S. 53–54, ISBN 3-335-00343-8.
- Physikalisch-Technische Bundesanstalt: The half-life of 79Se, News 2010.
- Jörg, G., Bühnemann, R., Hollas, S., Kivel, N., Kossert, K., Van Winckel, S., Lierse v. Gostomski, Ch. Applied Radiation and Isotopes 68 (2010), 2339–2351.
- T. J. Kealy, P. L. Pauson: A New Type of Organo-Iron Compound. Nature 1951, 168, 1039. doi:10.1038/1681039b0.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 5: Pl–S. 8., neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1987, ISBN 3-440-04515-3.