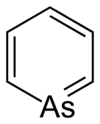
Arsabenzol
Arsabenzol ist ein aromatischer Heterocyclus, der neben Kohlenstoff und Wasserstoff ein Arsenatom enthält. Die Summenformel lautet C5H5As. Es ist somit ein schwereres Homologes von Pyridin und Phosphabenzol und zählt zu den Heterobenzolen mit der allgemeinen Formel C5H5E (E = N, P, As, Sb, Bi).[3]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Arsabenzol | ||||||||||||
| Andere Namen |
Arsinin | ||||||||||||
| Summenformel | C5H5As | ||||||||||||
| Kurzbeschreibung |
luftempfindliche Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 140,02 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Struktur
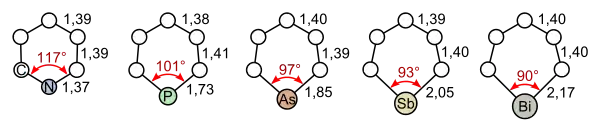
Arsabenzol ist planar. Der C–C-Bindungsabstand beträgt 139 pm, der As–C-Bindungsabstand 185 pm. Das ist 6,6 % kürzer im Vergleich zu einer „normalen“ As–C-Einfachbindung.[3]
Darstellung
Die erste Synthese eines substituierten Arsaabenzols – genauer 9-Arsaanthracen – wurde von Peter Jutzi und Friedrich Bickelhaupt beschrieben.[4]
Eine Synthese für Arsaabenzol wurde ausgehend von Arsentrichlorid beschrieben:[3]
- CH2(CHCH)2SnBu2 + AsCl3 → CH2(CHCH)2AsCl + Bu2SnCl2
- CH2(CHCH)2AsCl → C5H5As + HCl
Eigenschaften und Reaktionen
Arsabenzol ist luftempfindlich und hat einen zwiebelartigen Geruch.[1] Beim Erwärmen zersetzt es sich.[3]
Arsabenzol kann elektrophil substituiert werden und zwar in der ortho- und para-Position, so ist z. B. eine Friedel-Crafts-Acylierung möglich.[1]
Vergleich mit anderen Heterobenzolen
Allen Heterobenzolen ist ihre Aromatizität gemeinsam. Die Stabilität nimmt mit der Ordnungszahl des Heteroatoms ab. Nachfolgend sind die Bindungslängen und -winkel der Heterobenzole der 15. Gruppe des Periodensystems dargestellt (von links nach rechts: Pyridin, Phosphabenzol, Arsabenzol, Stibabenzol und Bismabenzol):[5]
Die mit steigender Ordnungszahl geringer werdende Stabilität hängt damit zusammen, dass eine [4+2]-Cycloaddition bevorzugt schon bei niedrigen Temperaturen abläuft und die Isolierung der Reinsubstanzen folglich z. T. unmöglich ist.
Arsabenzol ist weniger basisch als Pyridin und unreaktiv gegenüber Lewis-Säuren. Trifluoressigsäure protoniert Arsabenzol nicht.[4]
Eine Zusammenstellung von Eigenschaften, Synthesen und Reaktionen der Pyridin-Homologen Phosphabenzol und Arsabenzol lieferte Gottfried Märkl 1982.[6]
Einzelnachweise
- J. I. G. Cadogan, J. Buckingham, F. Macdonald: Dictionary of Organic Compounds, 6th. Auflage, Band 10, CRC Press, 1997, ISBN 0-412-54110-6, S. 491.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- C. Elschenbroich: Organometallics (deutsch). Wiley-VCH Weinheim, 2006, ISBN 3-527-29390-6, S. 229–230.
- A. J. Ashe: The Group 5 Heterobenzenes. In: Accounts of Chemical Research. 11, Nr. 4, 1978, S. 153–157. doi:10.1021/ar50124a005.
- Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner Verlag, Wiesbaden 2008 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 25. Februar 2010]).
- Gottfried Märkl: Phosphabenzol und Arsabenzol. Die höheren Elementhomologen des Pyridins, Chemie in unserer Zeit 16 (1982) 139–148, doi:10.1002/ciuz.19820160503.