Basen (Chemie)
Als Basen (zu altgriechisch βάσις basis, deutsch ‚Grundlage‘) werden in der Chemie mit enger Definition Verbindungen bezeichnet, die in wässriger Lösung in der Lage sind, Hydroxidionen (OH−) zu bilden und somit den pH-Wert einer Lösung zu erhöhen. Hydroxidionen sind chemische Verbindungen, die Protonen von einer Säure unter Bildung eines Wassermoleküls übernehmen können. Eine Base ist damit das Gegenstück zu einer Säure und vermag diese zu neutralisieren.
Daneben bestehen weitere Definitionen des Begriffs von Basen verschiedener Säure-Base-Konzepte für wesentlich breitere Paletten von chemischen Reaktionen, die über jene von Hydroxidionen in Wasser hinausreichen können. Besonders bedeutsam sind die Konzepte nach Lewis (Lewis-Base und Lewis-Säure) und das nach Pearson, der von harten und weichen Säuren und Basen spricht (HSAB-Konzept).
Historische Entwicklung des Begriffes „Base“
In der Alchemie waren einige Alkalien, wie Kalk (CaCO3, CaO und Ca(OH)2), Natron, Soda, Pottasche und Ammoniak bekannt. Bis Anfang des 18. Jahrhunderts wurde allerdings zwischen Soda und Pottasche nicht exakt unterschieden. Der Begriff „Alkalien“ wurde wenig verwendet und kein genauer Zusammenhang zwischen diesen Stoffen erkannt. Die Base (Alkalie) als Gegenpol der Säure wurde in der Chemiatrie, einem medizinisch-theoretischen Lehrgebäude von Otto Tachenius im 17. Jahrhundert postuliert.
Bis in das 18. Jahrhundert bestand eine enge Verknüpfung zwischen Alkalien und dem Feuer bzw. der „Feuermaterie“, auch wegen der bekannten exothermen Reaktionen. Der Begriff „Base“ wurde im 17. Jahrhundert von Chemikern wie Georg Ernst Stahl, Robert Boyle und Guillaume François Rouelle eingeführt, weil „basische“ Stoffe die nichtflüchtige Grundlage zur Fixierung flüchtiger Säuren bildeten und die (ätzende) Wirkung von Säuren aufheben können. Grundlegende Schritte in die Chemie gelangen Antoine Laurent de Lavoisier. Er dachte, dass Säuren stets aus Nichtmetalloxiden und Wasser und Basen aus Metalloxiden und Wasser entstünden. Sir Humphry Davy und Justus von Liebig sahen Säuren als Wasserstoff-Verbindungen an, die sich durch Metalle in Salze überführen lassen. 1887 definierte Svante Arrhenius Basen als Stoffe, die beim Auflösen in Wasser unter Abgabe von Hydroxidionen dissoziieren, und Säuren als Stoffe, die unter Abgabe von Protonen dissoziieren. Säuren und Basen neutralisieren sich. Die Theorie war jedoch noch unzureichend, da Verbindungen ohne Sauerstoff nicht einbezogen wurden: auch Ammoniak neutralisiert eine Säure.
1923 stellte Johannes Nicolaus Brønsted sein Modell vor. Es hat sich weitgehend durchgesetzt und insbesondere in der analytischen Chemie sehr bewährt. Seiner Theorie nach wechselwirken Base und Säure in einer Protonenübertragungsreaktion. Dabei nehmen Basen Protonen von Säuren auf. Das von Gilbert Newton Lewis ebenfalls 1923 vorgestellte Modell ist hilfreich bei der Betrachtung von Reaktionsabläufen in der organischen Chemie und in der Komplexchemie und reicht über die üblichen Definitionen hinaus. Daher spricht man bevorzugt von Lewis-Base und Lewis-Säure. Viele normalerweise als Säure bezeichnete Verbindungen sind nach diesem Modell keine Säuren. Das Konzept der harten und weichen Säuren und Basen (HSAB-Konzept) entwickelte 1963 Ralph G. Pearson und erweiterte damit Betrachtungsweisen von Reaktionen in der organischen und Komplexchemie.
Was sind Basen?
Im engen Zusammenhang mit Basen stehen in der Regel und häufig ohne ausdrückliche Erwähnung die Anwesenheit und bestimmte Eigenschaften des Wassers. Reines Wasser unterliegt der sogenannten Autoprotolyse, bei der sich in sehr geringen und gleichen Konzentrationen Oxoniumionen (H3O+) und Hydroxidionen (OH−) bilden:
In dieser Reaktionsgleichung des Wassers zeigt sich die Eigenschaft einer Base durch Bildung von OH−-Ionen in Wasser. Gleichzeitig bilden sich H3O+-Ionen in Wasser, eine Eigenschaft, die eine Säure auszeichnet. Man bezeichnet jedoch Wasser weder als eine Base noch als eine Säure und nennt sein Verhalten neutral. Dies bezieht sich auf den pH-Wert, der die Konzentration der H3O+-Ionen in Wasser angibt. Reines Wasser hat den pH-Wert von 7, eine sehr kleine Konzentration. Diese Reaktion ist – wie alle in diesem Abschnitt beschriebenen Reaktionen – eine Gleichgewichtsreaktion: Die Bildung der Ionen, sowie deren Vereinigung zu Wasser findet ständig und mit gleicher Häufigkeit statt.
Viele Verbindungen, die Basen genannt werden, verfügen über Hydroxid-Ionen (OH−) und dissoziieren im Wasser in Metall- und Hydroxid-Ionen. Die Lösung wird häufig als alkalische Lösung oder Lauge bezeichnet. So bildet der Feststoff Natriumhydroxid (NaOH) in Wasser die sogenannte Natronlauge und Kaliumhydroxid (KOH) die Kalilauge.
Andere Verbindungen verfügen selbst über keine OH−-Ionen, bilden sie aber in einer Reaktion mit Wasser. Sie reagieren alkalisch durch Übernahme eines Protons H+ von einem H2O-Molekül und lassen damit ein OH−-Ion zurück. So bildet beispielsweise das Salz Trinatriumphosphat (Na3PO4) oder auch das Salz Natriumcarbonat (Na2CO3) in wässriger Lösung Hydroxidionen. Auf gleichem Weg reagieren auch organische Verbindungen wie Salze der Carbonsäuren und Amine als Abkömmlinge des Ammoniaks. Die ätzende Wirkung aller dieser Basen ist im Wesentlichen auf die Bildung von OH−-Ionen zurückzuführen.
Basische Reaktionen
| Allgemein | |||
| Beispiele | |||
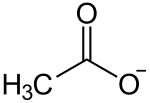 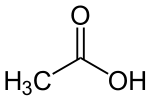 |
Bei schwachen und mittelstarken Basen liegen in den Gleichgewichtsreaktionen alle an der Reaktion beteiligten Komponenten in der Lösung vor. Je zwei der Reaktanten unterscheiden sich nur durch die Anwesenheit oder Abwesenheit eines Protons (H+). Sie bilden ein korrespondierendes Säure-Base-Paar. Teilchen, die über ein geeignetes Proton verfügen, werden Protonendonatoren genannt; Teilchen, welche die Fähigkeit besitzen, ein Proton aufzunehmen, werden Protonenakzeptoren genannt. Die gesamte Reaktion wird als Protolyse bezeichnet. Die Stärke einer Base wird durch die Lage des Gleichgewichts (der Basenkonstante) beschrieben.
Bei starken und sehr starken Basen liegen die Gleichgewichtsreaktionen vollständig auf der Seite der OH−-Ionen. Dies ist beispielsweise bei der Reaktion von Alkalihydroxiden mit Wasser der Fall:
Das Kation Na+ spielt dabei keine Rolle. Das Hydroxid-Ion ist hier die eigentliche Base und Wasser der Protonendonator:
Aufgrund dieses Gleichgewichts lassen sich starke von sehr starken Basen (wie z. B. Natriumethanolat und andere Superbasen) in wässriger Lösung durch ihre Alkalität nicht mehr unterscheiden. Hier spricht man vom nivellierenden Effekt (von französisch niveler ‚gleichmachen‘) des Wassers. Um auch sehr starke Basen bezüglich der Stärke unterscheiden zu können, bestimmt man Gleichgewichtskonstanten in nichtwässrigen Lösungen und überträgt diese annäherungsweise auf das Lösungsmittel Wasser.
Wasser spielt in Säure-Base-Reaktionen eine wichtige Rolle. Neben der oben beschriebenen Protolyse ist Wasser zu der sogenannten Autoprotolyse fähig. Es kann Protonen abgeben und OH− bilden, oder Protonen aufnehmen und H3O+ bilden. Dies ist einmal eine Reaktion als Base und das andere eine Reaktion als Säure. Man bezeichnet Wasser deswegen als Ampholyt.
Typen
Bestimmte Verbindungen werden wegen ihrer besonderen chemischen Eigenschaft als Basen bezeichnet. Die breite Palette dieser Chemikalien lässt sich nach verschiedenen Merkmalen in Gruppen einordnen. Man kann Basen nach ihrer ionischen Ladung in neutrale, anionische oder kationische Basen einteilen. Ammoniak (NH3) trägt keine ionische Ladung und ist somit eine neutrale Base. Als anionische Base kann man Natriumhydrogencarbonat bezeichnen, da in Lösung das Anion HCO3− vorliegt. Auch das Hydroxid-Anion (OH−) selbst kann man als anionische Base bezeichnen.
Ein anderer Weg zur Einteilung ist die Unterteilung in einwertige oder zweiwertige Basen. Natriumhydroxid (NaOH) bildet in Lösung pro Na ein OH− und ist einwertig, Calciumhydroxid (Ca(OH)2) bildet pro Ca zwei OH− und ist damit zweiwertig.
Als Basenbildner kann man Verbindungen bezeichnen, bei denen vor der basischen Reaktion noch eine weitere chemische Reaktion vorgelagert ist. Als Basenbildner kann man die Metalloxide bezeichnen, welche beim Lösen in Wasser die entsprechenden Hydroxide bilden. So bildet Calciumoxid (CaO) mit Wasser die Base Ca(OH)2. Unedle Metalle wie die Alkalimetalle können zuvor durch Einwirkung des Wassers oxidiert werden. Bei der heftigen Reaktion von Natrium entwickelt sich neben der Natronlauge auch Wasserstoff. Auch amphotere Oxide können Basenbildner darstellen. Elektronendonatoren der Basenbildner befinden sich im linken Teil des Periodensystem.[1]
| Typen | Beispiel | Reaktion |
|---|---|---|
| neutrale Basen | Ammoniak (NH3) | |
| anionische Basen | Natriumhydrogencarbonat (NaHCO3) | |
| kationische Basen | [Al3+(OH)−(H2O)5] in wässriger Lösung | |
| einwertige Basen | Natriumhydroxid (NaOH) Kaliumhydroxid (KOH) |
|
| zweiwertige Basen | Calciumhydroxid (Ca(OH)2) |
|
| Basenbildner | unedle Metalle, wie die Alkalimetalle | |
| Calciumoxid (CaO) Bariumoxid (BaO) |
||
Eigenschaften von Basen

- Viele Basen sind in Wasser löslich (z. B. Natriumhydroxid, Ammoniak), jedoch nicht alle (z. B. Aluminiumhydroxid)
- Sie sind ätzend und haben auf organische Stoffe zerstörende Wirkung.
- Aus Ölen und Fetten bilden sie Seifen und Glycerin.
- Es gibt starke und schwache Basen.
- Basen kann man mit Wasser verdünnen, dabei wird ihre Wirkung je nach Verdünnung deutlich schwächer.
- Die basischen Lösungen führen zu einer Rötung von Phenolphthalein und färben rotes Lackmus-Papier blau.
- Die „Gegenspieler“ der Basen (Basenlösung = Lauge) sind die Säuren (vgl. Abbildung). Sie können Basen neutralisieren. Auch Säuren sind ätzend und greifen viele andere Stoffe an, die mit Basen nicht unbedingt reagieren.
- Kleidung, Haut und Augen sind bei Kontakt in Gefahr. Es ist darauf zu achten, eine Schutzbrille zu tragen, da Verätzungen immer vorkommen können.
Neutralisation
Die Grundlage der Neutralisation beruht auf der Tatsache, dass sich die Wirkungen einer Säure beim Mischen mit einer Base nicht addieren, sondern aufheben. So kann eine Base mit einer geeigneten Menge einer Säure neutralisiert werden. Dabei reagieren Basen und Säuren unter Bildung von Wasser.
Reaktion von Natriumhydroxid in und mit Wasser zu Natronlauge:
Reaktion von Chlorwasserstoff in und mit Wasser zu Salzsäure:
Reaktion einer Natronlauge mit Salzsäure (Neutralisation):
- Natronlauge + Salzsäure reagiert zu gelöstem Natriumchlorid und Wasser.
Der entscheidende Prozess ist die Reaktion zwischen dem Hydroxid- und dem Oxoniumion:
Säure-Base-Gleichgewicht
Die Stärke einer Base bezeichnet man als ihre Basizität und beschreibt sie durch die Basenkonstante. Die Basenkonstante (Kb) beschreibt die Lage des Gleichgewichts in der Reaktion zwischen einem Säure-Base-Paar in wässriger Lösungen. Häufig wird der negative dekadische Logarithmus von Kb, der sogenannte pKb-Wert angegeben.
Bei der Reaktion
Ist die Basenkonstante Kb folgendermaßen definiert:
- , mit c(X) = Konzentration von X
Der pKb-Wert ist dementsprechend:
- .
Säure-Base-Reaktionen ohne Wasser
Analog zu den Säure-Base-Reaktionen die in wässrigen Lösungen und unter Beteiligung des Wassers ablaufen, existieren Reaktionen in anderen Medien. In wasserfreiem Ethanol findet mit Chlorwasserstoff eine Reaktion statt, bei dem Ethanol die Rolle einer Base übernimmt:
In der Gasphase reagieren die Gase Ammoniak und Chlorwasserstoff unter Bildung des Salzes Ammoniumchlorid.
In Säure-Base-Reaktionen können neben Wasser auch andere hinreichend polare Lösungsmittel als Reaktionspartner wirken. Ein gutes Beispiel ist die Autoprotolyse des flüssigen Ammoniaks:
Weblinks
Einzelnachweise
- Springer Fachmedien Wiesbaden GmbH: Chemie : Grundlagen, technische Anwendungen, Rohstoffe, Analytik und Experimente. 11., überarbeitete und erweiterte Auflage. Wiesbaden, ISBN 978-3-658-27502-0.