Adsorption
Als Adsorption (von lateinisch adsorptio, von adsorbere „(an)saugen“) bezeichnet man die Anreicherung von Stoffen aus Gasen oder Flüssigkeiten an der Oberfläche eines Festkörpers, allgemeiner an der Grenzfläche zwischen zwei Phasen.
Davon unterscheidet sich die Absorption, bei der die Stoffe in das Innere eines Festkörpers oder einer Flüssigkeit eindringen. Der Oberbegriff für Adsorption und Absorption lautet Sorption.
Adsorbieren zwei oder mehr Spezies an eine Oberfläche, so nennt man dies Koadsorption. Dies spielt vor allem bei Katalysatoren eine wichtige Rolle, bei denen die verschiedenen Atomsorten auf der gleichen Oberfläche adsorbiert werden und dort reagieren.[1]
Abgrenzung
Im allgemeinen Sinn ist Adsorption ein physikalischer Prozess, bei dem Stoffe (in der Regel Moleküle) auf der Oberfläche eines anderen Stoffes haften bleiben und sich auf dessen Oberfläche anreichern. Die Kräfte, die die Anhaftung verursachen sind keine chemischen Bindungen, sondern nur Van-der-Waals-Kräfte. Daher wird diese Form der Adsorption exakter physikalische Adsorption oder Physisorption genannt. Die physikalische Adsorption umfasst grundsätzlich auch den umgekehrten Prozess, die Desorption, da ein System immer ein Gleichgewicht zwischen dem Adsorbieren und Desorbieren eines Stoffes anstrebt. Die Oberfläche, auf der die Adsorption stattfindet, kann die Oberfläche eines Feststoffes oder die Oberfläche einer Flüssigkeit sein. Allgemein nennt man die Oberflächen Grenzflächen. Die Phase, aus der der Stoff auf die Grenzfläche gelangt, kann eine Gasphase oder eine Flüssigkeit (Lösung) sein. Die Teilchen gelangen durch ihre ungerichtete, thermisch getriebene Molekularbewegung zur Grenzfläche. In den folgenden Abschnitten wird jedoch hauptsächlich die Adsorption von Gasen auf feste Oberflächen beschrieben. Die Physisorption ist neben der Absorption ein alltäglicher Prozess und findet an fast allen Oberflächen statt, die Gasen (Luft) oder Flüssigkeiten (Wasser) ausgesetzt sind.
Bei dem speziellen Fall einer chemischen Adsorption, auch Chemisorption genannt, werden Stoffe durch chemische Bindungen auf die Oberfläche eines Feststoffes gebunden. Die Chemisorption kann erhebliche Konsequenzen für den adsorbierten Stoff haben und unterscheidet sich damit von einer Physisorption. Durch Brechen und Knüpfen chemischer Bindungen können sich andere Stoffe bilden und ein desorbierter Stoff (Desorbat) kann ein Produkt einer chemischen Reaktion sein. In der Regel treten bei der Chemisorption hohe Reaktionswärmen auf, was als ein Kriterium zur Unterscheidung zwischen Physisorption und Chemisorption genutzt werden kann. Chemisorption ist oft keine Gleichgewichtsreaktion, also irreversibel, findet unter Umständen nur bei hohen Temperaturen statt und führt häufig nicht zu einer Anreicherung von Stoffen auf der Oberfläche. Chemisorptionen sind wichtige Schritte, die bei Prozessen der heterogenen Katalyse auftreten.
Im Allgemeinen sollte der Begriff Adsorption nur für die alltäglichen Prozesse der Physisorption verwendet werden. Spezielle Adsorptionen mit chemischen Prozessen sollten explizit als Chemisorption bezeichnet werden.
Physikalische Adsorption
| Physikalische Adsorption | |
| Monolage | Adsorptionsenergie |
 |
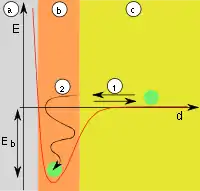 |
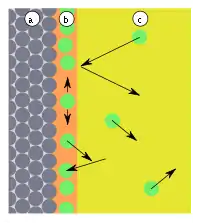
| Abb.1: a) Adsorbens, b) Adsorbat an der Grenzfläche, c) Gasphase bzw. Lösung mit Adsorptiv | Abb.2: a) Adsorbens, b) Adsorbat, c) Gasphase, d-Abstand, E-Energie, Eb-Adsorptionsenergie, (1) Reflexion, (2) Adsorption |
| Monolage und Kondensat | Selektivität |
 |
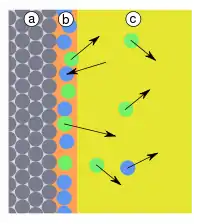 |
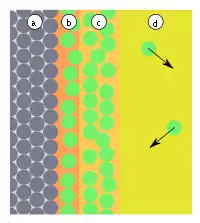
| Abb.3: a) Adsorbens, b) Adsorbat, c) Kondensat d) Gasphase bzw. Lösung mit Adsorptiv | Abb.4: a) Adsorbens, b) Adsorbat, c) Gasphase bzw. Lösung mit verschiedenen Adsorptiv: Moleküle in blau werden hier bevorzugt adsorbiert |
| Raue Oberfläche | Innere Oberfläche |
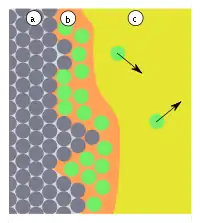 |
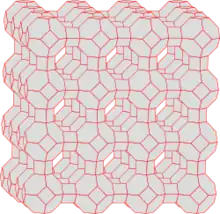 |
| Abb.5: a) Adsorbens mit rauer Oberfläche b) Adsorbat, c) Gasphase bzw. Lösung mit Adsorptiv | Abb.6: Struktur von Zeolith A mit einer großen inneren Oberfläche |
Die physikalische Adsorption (Physisorption) eines Stoffes auf einer Oberfläche ähnelt einer chemischen Gleichgewichtsreaktion. Der adsorbierte Stoff (Adsorbat) bildet jedoch mit der Oberfläche keine chemische Bindung aus, sondern haftet durch schwächere Kräfte ähnlich der Adhäsion. So treten in der Regel nur Van-der-Waals-Kräfte auf. Die Adsorptionsenergie liegt bei der Physisorption im Bereich von 4 bis 40 kJ/mol. Chemische Bindungen innerhalb eines adsorbierten Teilchens bleiben bestehen, werden jedoch polarisiert. Für diese Gleichgewichtsreaktion kann man eine Reaktionsgleichung zwischen dem Stoff, der adsorbiert wird (Adsorptiv), der Oberfläche des Festkörpers (Adsorbens) und dem Adsorbat aufstellen:
Wobei gilt:
- – Teilchen in der Gasphase bzw. in Lösung (Adsorptiv)
- – Teilchen auf der Oberfläche (Adsorbat)
- – freie Oberflächenplätze des Adsorbens
Treffen Teilchen auf die Oberfläche (Abb. 1), werden diese entweder reflektiert oder adsorbiert. Adsorption tritt auf, wenn die Teilchen ihre kinetische Energie und die Adsorptionsenergie (Eb) abgeben können, die in Form von Wärme frei wird (Abb. 2). Die Reaktion ist also exotherm. Die Adsorption ist reversibel, da die Teilchen mit ähnlich viel Energie die Oberfläche wieder verlassen können, da diese Reaktionen in der Regel nicht durch Übergangszustände gehemmt werden. Die Aktivierungsenergie (Ea) der Reaktion ist daher gleich der Adsorptionsenergie (Eb). Adsorbierte Teilchen haben keinen fixen Bindungsort an der Oberfläche, verweilen nicht an der Stelle, wo sie adsorbiert wurden, sondern bewegen sich frei entlang der Oberfläche.
Die Lage des Gleichgewichts hängt von den Eigenschaften und Größe der Oberfläche, der Eigenschaften und Druck (bzw. Konzentration) des Adsorptivs, sowie von der Temperatur ab. Bei 300 °C und normalen Drücken liegt das Gleichgewicht oft ganz auf der linken Seite. Liegt das Gleichgewicht ganz auf der rechten Seite, bilden die Teilchen aus der Gasphase im Idealfall eine monomolekulare Schicht auf der Oberfläche aus.
Praktisch können sich nach der Bildung der Monolage weitere Lagen bilden (Abb. 3). Streng genommen zählt man nur die Bildung der ersten Schicht zur Adsorption, da nur hier Wechselwirkungen zwischen Oberfläche und Adsorptiv wirken. In den anderen Lagen bestehen nur Wechselwirkungen zwischen den Adsorbaten. Streng genommen handelt es sich dann um eine Kondensation der Adsorptive. Die Kondensationswärme (Bindungsenergie der Adsorbate untereinander) ist in der Regel deutlich geringer als die Adsorptionsenergie eines Adsorbats zum Adsorbens.
In der Regel haben die Oberflächen der Adsorbentien keine ideal ebene Struktur, sondern haben zahlreiche Defekte (Gitterfehler). Diese Defekte bilden Stellen, an denen das Adsorbat besonders fest gebunden ist (Abb. 5). Die Mobilität des Adsorbats erlaubt die Besetzung dieser Stellen unabhängig von der Stelle, wo das Adsorptiv adsorbiert wurde. Die Leistungsfähigkeit eines Adsorbens steigt daher mit der Zahl seiner Defekte. Aus diesem Grund ist die weitgehend amorph aufgebaute Aktivkohle im Vergleich zum Graphit ein besonders leistungsstarkes Adsorbens. Andere, leistungsstarke Stoffe wie Zeolithe sind nicht amorph, verfügen aber über ein sehr enges Kanalsystem (Abb. 6), eine so genannte innere Oberfläche, in dem nur wenige Moleküle (Adsorptive) nebeneinander Platz finden. Bei solchen Stoffen lassen sich Adsorption und Kondensation kaum noch unterscheiden. Gelegentlich nennt man solche Prozesse auch Kapillarkondensation (siehe Kapillarität).
Oberflächen sind unter normalen Bedingungen immer durch Stoffe belegt. Auf der Oberfläche von Feststoffen in Kontakt mit Lösemitteln sitzen Lösemittelmoleküle. Oberflächen in Kontakt mit Luft sind z. B. mit Wassermolekülen belegt. Praktisch geeignete Adsorbentien zeichnen sich durch eine Selektivität aus (Abb. 4). Aus Lösungen verdrängen gelöste Stoffe die Lösemittel und aus der Luft verdrängen bestimmte Stoffe das Wasser von der Oberfläche, da sie stärker gebunden werden (Adsorptionsverdrängung). Diese Anreicherung bestimmter Stoffe auf der Oberfläche erlaubt die Herstellung von Gasfiltern (z. B. in Atemschutzfiltern) und Verfahren der Adsorptionschromatografie.
Adsorptionsisotherme
| Adsorptionsisotherme | |
| monomolekulare Schicht | |
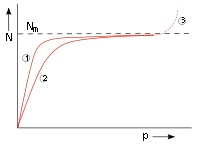 | |
| Abb. 7: N: Zahl der adsorbierten Teilchen, p: Druck, Nm: Zahl der Teilchen bei voller Belegung der Oberfläche, (1) und (2) Adsorptionsisotherme für zwei Temperaturen; höhere Temp. bei (2), (3) Kondensation | |
| Kapillarkondensation | |
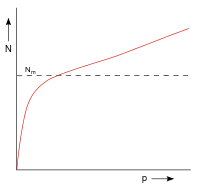 | |
| Abb. 8: Adsorptionsverhalten vom großporigen/grobporigen Materialien, wie Silicagel | |
Für die Adsorption von monomolekularen Schichten lässt sich ein Belegungsgrad der Oberfläche definieren:
- , mit
- : Zahl der adsorbierten Moleküle
- : Zahl der Moleküle bei voller Belegung
Der Belegungsgrad in einem System Gas – Festkörperoberfläche ist abhängig vom Partialdruck des Gases und der Temperatur .
Für die Charakterisierung (Messung) der Oberflächen von Stoffen werden bevorzugt sogenannte Adsorptionsisothermen aufgenommen, bei denen die Temperatur konstant gehalten wird. Als Adsorbat werden oft Gase wie Stickstoff oder Edelgase verwendet. Die Lage des Gleichgewichts eines Systems ist dann nur noch abhängig vom Druck.
Eine praktisch wichtige Isotherme ist die Langmuir-Isotherme, die in dieser Form dargestellt werden kann:
Die Größe kann man als Verhältnis der Geschwindigkeitskonstanten der Desorption und Adsorption eines Systems betrachten. Die Abbildung 7 zeigt den Verlauf der Belegung. Für kleine () verläuft die Adsorptionsisotherme proportional zu . Für große () nähert sich die Kurve der monomolekularen Belegung . Bei höheren Drücken kommt es zur Kondensation, die jedoch durch die Langmuir-Isotherme nicht beschrieben wird.
Neben der langmuirschen Adsorptionsisotherme kann auch mit der freundlichschen Gleichung die chemische Adsorption beschrieben werden.[2]
Materialien mit rauer oder inneren Oberfläche zeigen oft ein anderes Adsorptionsverhalten, welches sich nicht durch Langmuir-Isotherme beschreiben lässt. Häufig wird auf die Isotherme nach Brunauer, Emmett und Teller (BET-Isotherme) zurückgegriffen:
- , mit a als systemspezifische Konstante.
Adsorptionsisothermen von Materialien wie Silicagel zeigen bei niedrigem Druck einen steilen Anstieg (Abb. 8), haben jedoch nur eine Tendenz sich anzunähern und übersteigen diesen Wert früh. Hier kommt die Kapillarkondensation zum Tragen, die energetisch nahe bei der Adsorptionswärme einer monomolekularen Belegung liegt.
Konkurrierende Adsorption
Belegen Moleküle einer Komponente die Oberfläche eines Adsorbens, das für die Abscheidung einer anderen Komponente gedacht war, so wird von konkurrierender Adsorption gesprochen. Dies ist bei technischen Trennaufgaben von Bedeutung, da in vielen Fällen Stoffgemische auftreten (z. B. ein Kohlenwasserstoff und Wasserdampf). In solchen Fällen ist die Selektivität des Adsorbens von großer Bedeutung.[3] Konkurrierende Adsorption kann durch Messung von Durchbruchskurven mit zwei oder mehr Adsorptiven beobachtet und quantifiziert werden.
Chemische Adsorption
| Chemische Adsorption | |||||||||||||||
| Monolage | |||||||||||||||
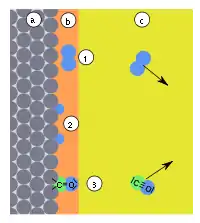 | |||||||||||||||
| Abb. 9: a) Adsorbens, b) Adsorbat, c) Gasphase mit Adsorptiv, (1) Physisorption, (2) dissoziative Chemisorption (3) gerichtete Chemisorption | |||||||||||||||
| Adsorptionsenergie | |||||||||||||||
| |||||||||||||||
Die chemische Adsorption (Chemisorption) ist eine Anlagerung von Stoffen auf die Oberfläche von Feststoffen, die chemischen Bindungskräften gleicht. Während bei der physikalischen Adsorption die Bindungskräfte bis ca. 40 kJ/mol wirken, liegen Reaktionswärmen bei chemischen Adsorption im Bereich von 40 bis 420 kJ/mol. Bei der Chemisorption werden Bindungen zu der Oberfläche geknüpft und die elektronische Struktur innerhalb des Adsorbats verändert. Durch die direkten Bindungen zur Oberfläche können sich maximal monomolekulare Schichten bilden. Trotz einer chemischen Bindung zur Oberfläche kann sich das Adsorbat – wie bei einer Physisorption – meist entlang der Oberfläche bewegen.
Die Chemisorption kann erhebliche Konsequenzen für den adsorbierten Stoff haben, die von den Eigenschaften des Adsorbats, des Adsorbens und der Temperatur des Systems abhängen. Chemisorption ist ein grundlegender Prozess bei der Katalyse mit festen Katalysatoren, die so genannte heterogene Katalyse. Bindungen innerhalb des adsorbierten Stoffes können geschwächt werden. Chemische Reaktionen mit anderen Reaktionspartnern können nun leichter ablaufen; man spricht von einer katalytischen Aktivierung der Reaktion.
Unter Umständen können Bindungen innerhalb des Adsorbats gebrochen werden, was zu einem Zerfall des Adsorbats in zwei oder mehr Teilchen führen kann (dissoziative Chemisorption). So dissoziiert z. B. Wasserstoff (H2) auf Metallen wie Eisen- Platin- und Palladium zu einzeln gebundenen Wasserstoffatomen (Abb. 9, (2)). Dissoziative Chemisorptionen können dazu führen, dass andere Teilchen desorbiert werden, als adsorbiert wurden. Die Chemisorption hat dann eine chemische Reaktion ausgelöst (Katalyse).
Kohlenstoffmonoxid (CO) dissoziiert bei Adsorption auf die oben genannten Metalle nur bei hohen Temperaturen. In der Regel findet eine so genannte gerichtete Chemisorption statt: CO bindet über das C-Atom auf die Metallfläche (Abb. 9, (3)), analog zur Bindungsrichtung die bei Metallcarbonylen vorliegt.
Die Adsorption ist eine exotherme Reaktion, die jedoch über energetisch ungünstig hohe Übergangszustände verlaufen kann (aktivierte Adsorption). Bei aktivierten Adsorptionen erfolgt Adsorption – im Gegensatz zur Physisorption – erst bei höheren Temperaturen und die Geschwindigkeit steigt mit zunehmender Temperatur.
Im Gegensatz zur Physisorption ist die Aktivierungsenergie der Desorption oft ungleich der Aktivierungsenergie der Adsorption. Die Aktivierungsenergie der Desorption resultiert aus den Veränderungen am Adsorbat. Während einige adsorbierte Teilchen (z. B. H2 oder O2) dissoziiert sind, haben andere Teilchen (z. B. CO2) ihre räumliche Konfiguration geändert. Die Größe der Aktivierungsenergien und der Adsorptionswärmen hängen neben der Art der adsorbierten Teilchen bzw. deren Reaktionsprodukten stark von der chemischen Zusammensetzung und der (elektronischen) Struktur des Adsorptivs ab (Tabelle „Adsorptionsenergie“). Bei Chemisorption kann die Adsorption irreversibel sein, wenn für die Desorption bestimmter Teilchen eine (zu) hohe Aktivierungsenergie erforderlich ist. Tritt solche Chemisorption bei Katalysatoren auf, führt dies zur Deaktivierung und man spricht von Katalysatorgift.
Anwendungen
Physisorption
Da bei der Adsorption Wärme freigesetzt und bei der Desorption Wärme aufgenommen wird, werden auf der Adsorption basierende Wärmepumpen (Adsorptionskältemaschinen) gebaut. Beim Betrieb von Adsorptionskältemaschinen wird der Aggregatzustand des Fluids geändert.
Physisorption in der Gasphase
Als Adsorbenzien kommen beispielsweise Aktivkohle, Aktivkoks, Silicagel oder Molekularsiebe (Zeolithe) in Form von Schüttungen oder in strukturierter Form zum praktischen Einsatz. Auf Physisorption beruhen Gasfilter, wie Atemschutzfilter und Verfahren zur Trocknung feuchter Luft (Adsorptionstrocknung).
Adsorptive Verfahren werden häufig zur Abgasreinigung verwendet. Sie dienen zur Rückhaltung von Kohlenwasserstoffen z. B. in Form von Lösungsmitteln[5] oder Benzindämpfen.[6] Weiterhin werden Adsorptionsverfahren zur Beseitigung von Geruchsstoffen[7], Schwefelwasserstoff[8] und Schwefeldioxid[9] eingesetzt. Auch zur Glättung von Konzentrationsspitzen vor Oxidations-Katalysatoren findet die Adsorption Anwendung.[10]
Viele Verfahren zur Trennung bzw. Reinigung sowie der Analyse von Stoffgemischen beruhen auf chromatografischen Methoden, der Adsorptionschromatografie. Alle diese Verfahren nutzen die stoffspezifische Gleichgewichtsreaktion der Physisorption zwischen einer Grenzfläche und einer mobilen Phase.
Bei technischer Trennung und von Gasgemischen wird Physisorption genutzt, da Gase druck- und temperaturabhängig unterschiedlich stark an der Oberfläche eines Adsorbens anlagern. Man unterscheidet die Betriebsarten Temperaturwechsel- und Druckwechsel-Adsorption. So kann beispielsweise aus Synthesegas hochreiner Wasserstoff gewonnen werden. Eine weitere Anwendung zur technischen Trennung von Gasgemischen ist das Entfernen von CO2 aus Biogas.[11]
Physisorption in der Flüssigphase
Zur Reinigung vieler Naturstoffe[12] und heute vor allem in der Wasseraufbereitung, Abwasserreinigung, Grundwassersanierung sowie in der Industriewasserwirtschaft wird die Adsorption zur Entfernung von schädlichen Wasserinhaltsstoffen oder zur Stoffrückgewinnung verwendet.[13]
Chemisorption
Chemisorption ist der grundlegende Prozess bei der heterogenen Katalyse. Katalysatoren sind hierfür geeignete Feststoffe. Für die Hydrierung von C=C-Doppelbindungen wird Wasserstoff und als Katalysator Raney-Nickel oder Nickel-Aluminium-Legierungen verwendet. Die Chemisorption von Wasserstoff auf Katalysatoren spielt auch beim Haber-Bosch-Verfahren zur Gewinnung von NH3 eine wesentliche Rolle. Die Chemisorption von Kohlenmonoxid und Wasserstoff ermöglicht bei der Fischer-Tropsch-Synthese die Synthese von Kohlenwasserstoffen. Auch Fahrzeugkatalysatoren beruhen auf einer heterogenen Katalyse.
Literatur
- Wilhelm Schwieger, Helge Toufar: Anorganisch-poröse Materialien: Präparation, Verarbeitung und Industrielle Herstellung. Springer, Berlin 2007, ISBN 978-3-540-23649-8.
- Dieter Bathen, Marc Breitbach: Adsorptionstechnik. Springer, Berlin 2001, ISBN 978-3-540-41908-2.
- L. W. Bruch, Milton W. Cole, Eugene Zaremba: Physical Adsorption: Forces and Phenomena. Dover Pubn Inc, 2007, ISBN 978-0-486-45767-3.
- Stephen Brunauer: The Adsorption of Gases and Vapors Vol I – Physical Adsorption. Dodo Press, 2007, ISBN 978-1-4067-5030-0.
- VDI 3674:2013-04 Abgasreinigung durch Adsorption; Prozessgas- und Abgasreinigung (Waste gas cleaning by adsorption; Process gas and waste gas cleaning). Beuth Verlag, Berlin. (Zusammenfassung und Inhaltsverzeichnis online )
Einzelnachweise
- Peter W. Atkins, Julio de Paula: Physikalische Chemie. 4. Auflage. Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8, S. 1026.
- R. Brdicka; In: Grundlagen der Physikalischen Chemie; VEB Deutscher Verlag der Wissenschaften, Berlin 1958, S. 482.
- VDI 3674:2013-04 Abgasreinigung durch Adsorption; Prozessgas- und Abgasreinigung, S. 14–15.
- Römpp Lexikon Chemie
- Heinz Kuschel: Adsorptive Entfernung eines Lösungsmittelgemisches aus der Abluft eines folienverarbeitenden Betriebes. Staub – Reinhalt. Luft, ISSN 0949-8036, 36 (1976) Nr. 7, S. 303–306.
- VDI 3674:2013-04 Abgasreinigung durch Adsorption; Prozessgas- und Abgasreinigung, S. 51–62.
- Rolf Germerdonk: Adsorption von Geruchs- und anderen problematischen Stoffen. Staub – Reinhalt. Luft, ISSN 0949-8036, 36 (1976) Nr. 7, S. 306–311.
- Kurt Hedden, L. Huber, B.R. Rao: Adsorptive Reinigung von schwefelwasserstoffhaltigen Abgasen. Staub – Reinhalt. Luft, ISSN 0949-8036, 36 (1976) Nr. 7, S. 313–317.
- Karl Knoblauch, R. Noack: Betriebserfahrungen mit dem Bergbau-Forschungsverfahren zur Rauchgasentschwefelung. Staub – Reinhalt. Luft, ISSN 0949-8036, 36 (1976) Nr. 7, S. 318–323.
- VDI 3476 Blatt 2:2010-01 Abgasreinigung; Verfahren der katalytischen Abgasreinigung; Oxidative Verfahren (Waste gas cleaning; Catalytic waste gas cleaning methods; Oxidative processes). Beuth Verlag, Berlin, S. 28.
- VDI 3896:2015-10 Emissionsminderung; Aufbereitung von Biogas auf Erdgasqualität (Emission Control; Preparation of biogas to natural gas quality). Beuth Verlag, Berlin, S. 15.
- Otto Westphal, Theodor Wieland, Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), S. 118–122.
- Gabi Förtsch, Heinz Meinholz: Handbuch Betrieblicher Immissionsschutz. 2013, Springer Spektrum, ISBN 978-3-658-00005-9, S. 286–293.