Serotonin
Serotonin, auch 5-Hydroxytryptamin (5-HT) oder Enteramin, ist ein Gewebshormon und Neurotransmitter. Es kommt unter anderem im Zentralnervensystem, Darmnervensystem, Herz-Kreislauf-System und im Blut vor. Der Name dieses biogenen Amins leitet sich von seiner Wirkung auf den Blutdruck ab: Serotonin ist eine Komponente des Serums, die den Tonus (Spannung) der Blutgefäße reguliert und zur Blutgerinnung beiträgt. Es wirkt außerdem auf die Magen-Darm-Tätigkeit und die Signalübertragung im Zentralnervensystem.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-1H-indol-5-ol_200.svg.png.webp) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Serotonin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Kurzbeschreibung |
hygroskopische, lichtempfindliche Kristalle (Serotonin·Hydrochlorid)[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 176,22 g·mol−1 (Serotonin) | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
10,4[2] | |||||||||||||||||||||
| Löslichkeit |
löslich in Wasser (20 g·l−1 bei 27 °C)[3] und Ethanol (3 g·l−1) (Serotonin·Hydrochlorid)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte

Das Vorkommen eines Stoffes im Blut, der die Blutgefäße kontrahiert, wurde bereits Mitte des 19. Jahrhunderts von Carl Ludwig angenommen.[5] Vittorio Erspamer isolierte in den 1930er Jahren einen Stoff aus der Schleimhaut des Magen-Darm-Trakts, der die glatte Muskulatur kontrahieren lässt. Er nannte ihn „Enteramin“. 1948 isolierten Maurice Rapport, Arda Green und Irvine Page eine Blutgefäße kontrahierende Substanz und gaben ihr den Namen „Serotonin“.[6] Die Struktur dieser Substanz, die Maurice Rapport vorschlug,[7] konnte 1951 durch chemische Synthese bestätigt werden.[8] Kurz darauf konnte Vittorio Erspamer zeigen, dass das von ihm gefundene Enteramin und Rapports Serotonin identisch sind.[9] Irvine Page und Betty Twarog gelang 1953 mit dem Nachweis von Serotonin im Gehirn eine weitere wichtige Entdeckung.[10]
Nach der Entdeckung des Serotonins wurden die für seine Wirkung verantwortlichen Rezeptoren intensiv untersucht. John Gaddum führte eine erste Unterscheidung in „D“- und „M“-Rezeptoren ein.[11] Doch erst mit der Etablierung molekularbiologischer Methoden in den 1990er Jahren wurde offensichtlich, dass beim Menschen mindestens 14 verschiedene Serotonin-Rezeptoren existieren, die für die vielfältigen Wirkungen des Serotonins verantwortlich sind.[12]
Vorkommen
Serotonin ist in der Natur weit verbreitet. Bereits einzellige Organismen wie Amöben können Serotonin produzieren.[14] Als Produzenten gelten ebenso Pflanzen und höhere Pilze.[15][16] In den Brennhaaren der Brennnessel ist Serotonin für deren bekannte Wirkung mitverantwortlich. Zu den serotoninreichsten pflanzlichen Lebensmitteln zählen Walnüsse, die über 300 µg/g Serotonin enthalten können. Aber auch Kochbananen, Ananas, Bananen, Kiwis, Pflaumen, Tomaten, Kakao und daraus hergestellte Produkte wie beispielsweise Schokolade, enthalten mehr als 1 µg/g Serotonin.[13][17] Der ungewöhnlich hohe Serotoningehalt, speziell bei Walnüssen, wird mit einem spezifischen Abbaumechanismus von entstehendem Ammoniak zu erklären versucht.[18] Serotonin-Derivate treten gelegentlich auch als Nebeninhaltsstoff in psychoaktiven pflanzlichen Drogen auf, wie z. B. DMT, 5-MeO-DMT und Bufotenin in Yopo, einem psychoaktiven Rauschmittel aus der Pflanze Anadenanthera peregrina.[19] Für weitere Abkömmlinge des Serotonins, wie Feruloylserotonin und 4-Cumaroylserotonin, wird eine Funktion als Phytoalexin zum Schutz vor Mikroorganismen angenommen.[20]
Im Tierreich ist Serotonin in nahezu allen Spezies anzutreffen. Es ist hier einer der phylogenetisch ältesten Neurotransmitter und kommt, wie auch seine Rezeptoren, im Nervensystem bereits so einfacher Vertreter wie dem Fadenwurm C. elegans vor.[21] Es wird vermutet, dass das Serotoninsystem, bestehend aus Serotonin und seinen Rezeptoren, bereits im Präkambrium vor über 700 Millionen Jahren entstand.[22]
| Körperflüssigkeit | Konzentration (nmol/l) |
|---|---|
| Gehirn-Rückenmarks-Flüssigkeit | <4[23] |
| Thrombozytenarmes Plasma | 4–15[23] |
| Thrombozytenreiches Plasma | 1000–2500[23] |
| Blutserum | 300–900[23] |
| Vollblut | 1200[24] |
| Urin | 900–1300[23] |
Im menschlichen Organismus kommt die größte Menge an Serotonin im Magen-Darm-Trakt vor. Hier werden etwa 95 % der gesamten Serotoninmenge des Körpers, die auf 10 mg geschätzt wird, gespeichert. Etwa 90 % des Serotonins des Magen-Darm-Trakts werden in den enterochromaffinen Zellen gespeichert, die übrigen 10 % sind in den Nervenzellen (Neuronen) des Darmnervensystems zu finden.[25] Das Serotonin des Bluts ist fast ausschließlich auf die Thrombozyten (Blutplättchen) verteilt.[24] Dieses Serotonin wird von den enterochromaffinen Zellen des Magen-Darm-Trakts produziert und nach Abgabe in das Blut von den Thrombozyten aufgenommen. Auch basophile Granulozyten und Mastzellen können, zumindest bei Nagetieren, Serotonin speichern und freisetzen.[26][27] Im Zentralnervensystem befindet sich Serotonin insbesondere in den Neuronen der Raphe-Kerne. Eine pathologisch vermehrte Produktion, Speicherung und Freisetzung von Serotonin kann häufig bei neuroendokrinen Tumoren des Magen-Darm-Trakts, den Karzinoiden, beobachtet werden und ist für deren charakteristische Begleitsymptomatik verantwortlich.[28]
Chemie
Chemische Eigenschaften
Serotonin gehört – wie auch das Tryptamin – zur Gruppe der Indolamine bzw. Tryptamine. Serotonin ist wegen seiner primären aliphatischen Aminogruppe eine schwache Base. Seine Säurekonstante pKS von 10,4 ist mit der des Tryptamins vergleichbar. Daher liegt Serotonin unter physiologischen Bedingungen in überwiegend protonierter Form vor. In seiner protonierten Form ist Serotonin zur Fluoreszenz befähigt. Diese Eigenschaft wird auch zu seinem Nachweis genutzt. Das Absorptionsmaximum liegt bei 309 nm und das Emissionsmaximum bei 336 nm.[2]
Synthese
Für die synthetische Herstellung von Serotonin sind zahlreiche Wege beschrieben. Zu den grundlegenden Strategien der Serotoninsynthese zählen insbesondere die Ergänzung des Indolkörpers um die β-Ethylamin-Komponente, die Hydroxylierung von Tryptamin und die Synthese eines Indolgrundgerüsts aus verschiedenen möglichen Vorläufersystemen.
Synthesewege, die auf der Einführung der β-Ethylamin-Komponente basieren, beginnen mit 5-Hydroxyindol, dessen Hydroxygruppe entweder vorzugsweise mit einer Benzyl-Gruppe oder seltener mit einer Methyl-Gruppe geschützt ist. Das Erstere wird hydrogenolytisch gespalten, das Letztere bevorzugt mit Bortribromid. Die erste Laborsynthese, im Jahr 1951 von Hamlin und Fischer durchgeführt, bedient sich der Mannich-Reaktion zur Herstellung des entsprechenden Gramins in einem ersten Syntheseschritt.[29] Dieses wird dann zur Kettenverlängerung mit Cyanid in wässrigem Alkohol und anschließender Hydrolyse zu 5-Benzyloxyindol-3-acetamid umgesetzt. Nach Reduktion des Amids und anschließender Etherspaltung lässt sich das Serotonin isolieren.[8]
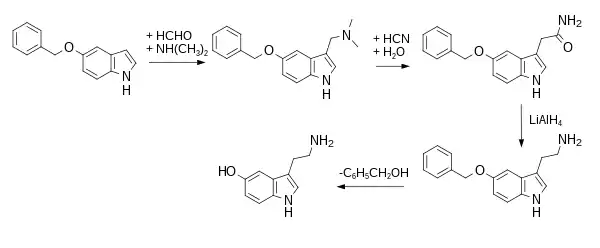
Gemäß einer fast zeitgleichen Veröffentlichung von Merrill E. Speeter und Mitarbeitern wird zunächst 3-(5-Benzyloxy)indolyl-magnesiumiodid als Grignard-Reagenz hergestellt und dann mit Chloracetonitril zum entsprechenden 3-Acetonitrilindol umgesetzt.[30] Das Nitril wird reduziert und der Ether gespalten.[31] Eine mit den vorstehenden Verfahren verwandte Variante mit verbesserten Ausbeuten beschreibt die Herstellung von radioaktiv markiertem [11C]-Serotonin für Positronen-Emissions-Tomographieuntersuchungen. Dabei wird 5-Methoxygramin an N2 zur quartären Ammoniumverbindung umgesetzt und mit [11C]-Cyanwasserstoff zu 5-Methoxy-3-acetonitrilindol nukleophil substituiert. Es folgt eine Etherspaltung und schließlich eine Reduktion.[32] Eine Methode, die sich auf zwei Reaktionsschritte beschränkt, besteht in der Addition von Nitroethylen an 5-Benzyloxyindol mit nachfolgender Hydrierung.[33] Das Nitrovinylindol, das als Zwischenprodukt auftritt, ist alternativ über eine Aldolkondensation des Indol-3-carbaldehyds mit Nitromethan zugänglich.[34] Ferner existiert noch der probate Weg über die Friedel-Crafts-Acylierung mit Oxalylchlorid. Das auf solche Weise gewonnene 5-Benzyloxy-3-Indol-glyoxylylchlorid verbindet sich mit Dibenzylamin zum Amid, das reduziert und debenzyliert wird.[35]
Eine andere Synthesestrategie beruht auf der Hydroxylierung von Tryptamin zum Serotonin. Nach dem Schutz der Aminfunktion zum N-Methoxycarbonyltryptamin wird dieses mit Triethylsilan zum entsprechenden Indolin reduziert. Die Oxidation desselben mittels Wasserstoffperoxid in Gegenwart von Natriumwolframat-Dihydrat bildet das Zwischenprodukt 1-Hydroxy-N-methoxycarbonyltryptamin. Die regioselektive nukleophile Hydroxylierung in 5-Position gelingt mit 85%iger Ameisensäure. Abschließende Hydrolyseschritte wie die alkalische Entschützung liefern das Serotonin.[36]
Ein weiteres Herstellungsverfahren basiert auf einer Indolsynthese als abschließenden Schritt. 2,5-Dimethoxybenzaldehyd unterwirft man der Knoevenagel-Reaktion mit Cyanoacetat und addiert an den entstandenen Michael-Akzeptor Blausäure. Die Succinonitril-Verbindung wandelt man durch Hydrierung und Etherspaltung zum 1,4-Diamino-2-(2,5-dihydroxyphenyl)butan, welches dann mit Ferricyanid oxidativ in das Endprodukt überführt wird. Dieser Schlussschritt dürfte über das Chinon verlaufen, das intramolekular zum Imin kondensiert und zum Indol aromatisiert.[37]
Abseits der erwähnten Pfade wurde der Aufbau eines Tryptolin-1-ons beschrieben, dessen Ringöffnung Serotonin hervorbringt.[38] Auch gibt es den Aufbau einer zunächst aliphatischen bicyclischen Verbindung, die im späteren Verlauf zum Indol aromatisiert wird.[39]
Biochemie und Pharmakokinetik
Aufnahme
Nach oraler Gabe wird Serotonin zu etwa 75 % in den Blutkreislauf aufgenommen und später nach Verstoffwechslung über den Urin ausgeschieden.[40] Ähnliche Werte werden für die Aufnahme von Serotonin aus Lebensmitteln wie Bananen gefunden.[41]
Biosynthese
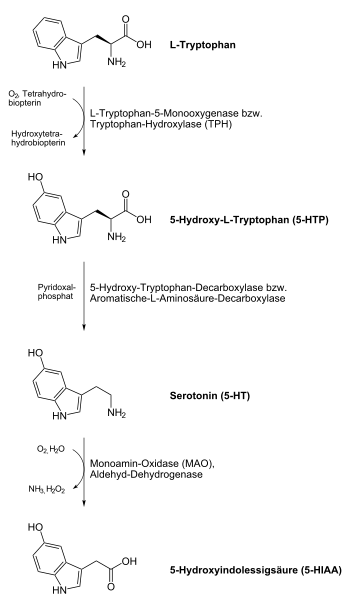
Beim Menschen und bei Tieren wird Serotonin aus der Aminosäure L-Tryptophan in einer Zwei-Schritt-Reaktion unter Beteiligung der Enzyme Tryptophanhydroxylase und Aromatische-L-Aminosäure-Decarboxylase aufgebaut. Im ersten Schritt entsteht als Zwischenprodukt die nicht-proteinogene Aminosäure 5-Hydroxytryptophan (5-HTP). Im zweiten Schritt erfolgt eine Decarboxylierung zum Endprodukt Serotonin. Der wichtigste Produktionsort sind die enterochromaffinen Zellen der Darmschleimhaut. Von hier aus wird das produzierte Serotonin über die Blutplättchen transportiert. Eine Passage der Blut-Hirn-Schranke ist jedoch nicht möglich, sodass Serotonin auch im Zentralnervensystem produziert werden muss. Den Stellenwert der neuronalen Serotoninproduktion zeigt die Anwesenheit einer zweiten paralogen Tryptophanhydroxylase im Gehirn, die bereits vor der Entwicklung der Wirbeltiere durch Genverdopplung aus der ersten Isoform hervorging.[42]
Die Biosynthese von Serotonin in Pflanzen weicht in der Reihenfolge ihrer Schritte von der in Tieren ab. Unter Beteiligung der Tryptophandecarboxylase wird im ersten Schritt L-Tryptophan zum Zwischenprodukt Tryptamin decarboxyliert. Im zweiten Schritt erfolgt eine Hydroxylierung mit Hilfe der Tryptamin-5-Hydroxylase zum Endprodukt Serotonin.[15]
Abbau
Das Serotonin der Nervenzellen wird nach seiner Freisetzung in den synaptischen Spalt aktiv mit Hilfe des Serotonin-Transporters (SERT), einem Transportprotein, rückresorbiert und wiederverwertet. Das aus den enterochromaffinen Zellen produzierte Serotonin wird rasch nach seiner Freisetzung über das gleiche Transportprotein in den Epithelzellen der Darmschleimhaut und in den Thrombozyten gebunden. Der Abbau von Serotonin erfolgt vorrangig über das Enzym Monoaminooxidase (MAO) vom Typ A und in einem deutlich geringeren Maß über MAO Typ B. Das Produkt 5-Hydroxy-Indolyl-Acetaldehyd wird von der Aldehyd-Dehydrogenase weiter zu 5-Hydroxyindolylessigsäure (5-HIES) abgebaut. 5-Hydroxyindolylessigsäure, die im Urin nachgewiesen werden kann, ist das Hauptausscheidungsprodukt von Serotonin.
Ein weiterer Stoffwechselweg führt ausgehend vom Serotonin zum Zirbeldrüsen-Hormon Melatonin, wobei nach einer Acetylierung der Aminogruppe des Serotonins unter Beteiligung der Serotonin-N-Acetyltransferase und des Acetyl-Coenzym A und einer anschließenden Methylierung mit Hilfe der Acetylserotonin-O-Methyltransferase und S-Adenosylmethionin Melatonin gebildet wird. Dieser Stoffwechselweg wird entscheidend über eine Steuerung der Enzymaktivität der Acetyltransferase durch das Tageslicht reguliert.[43]
Funktionen
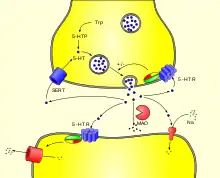
Im menschlichen Organismus besitzt Serotonin vielfältige Wirkungen insbesondere auf das Herz-Kreislauf-System, den Magen-Darm-Trakt und das Nervensystem. Auf molekularer Ebene werden die Funktionen des Serotonins über die mindestens 14 verschiedenen Serotonin-Rezeptoren (5-HT-Rezeptoren) vermittelt, die in 7 Familien zusammengefasst werden: 5-HT1 bis 5-HT7. Die 5-HT3-Rezeptoren bestehen aus Ionenkanälen, alle übrigen bekannten 5-HT-Rezeptoren sind G-Protein-gekoppelte Rezeptoren.[44] Dank dieser Vielzahl an Serotonin-Rezeptoren, die zudem gewebe-, zelltyp- und konditionsabhängig verteilt sind, ist der Organismus in der Lage, auf unterschiedliche Serotonin-Konzentrationen zu reagieren und verschiedenartige Signaltransduktionswege zu starten. Diese sind die Hauptursache für die oft gegensätzlichen Funktionen von Serotonin im Organismus. Darüber hinaus vermag Serotonin intrazellulär über eine als Serotonylierung bezeichnete Modifikation von Proteinen Signaltransduktionsprozesse zu steuern.[45]
Herz-Kreislauf-System
Die Wirkungen von Serotonin auf das Herz-Kreislauf-System sind komplex und umfassen sowohl das Zusammenziehen (Kontraktion) als auch die Entspannung (Relaxation) der glatten Muskulatur von Blutgefäßen. Während in der Lunge und in den Nieren des Menschen die blutgefäßverengende Wirkung im Vordergrund steht, dominiert in der Skelettmuskulatur die blutgefäßerweiternde Wirkung. Eine Injektion von Serotonin in den Blutkreislauf verursacht eine triphasische Veränderung des Blutdrucks. Nach einem anfänglichen Blutdruckabfall kommt es nach wenigen Sekunden zu einem Blutdruckanstieg, um letztendlich in einer langanhaltenden Hypotonie zu enden.[46]
Für diese Effekte sind die Rezeptoren 5-HT1B, 5-HT2A, 5-HT2B und 5-HT7 hauptverantwortlich.[47] Je nach Blutgefäß führen sie zu einer direkten Kontraktion (über 5-HT1B, 5-HT2A und 5-HT2B) oder Relaxation der Blutgefäße (über 5-HT7). Alternativ können Blutgefäße indirekt über die Beteiligung des Endothels (über 5-HT1B und 5-HT2B) und einer Freisetzung von blutgefäßerweiternden Botenstoffen, wie beispielsweise Stickstoffmonoxid (NO), relaxiert werden.[48]
Neben diesen unmittelbaren Effekten auf die Blutgefäße vermag Serotonin über das Zentralnervensystem den Blutdruck und den Blutgefäßtonus auf komplexe Weise zu steuern.[49]
Blutgerinnung
Serotonin hat sowohl mittelbare als auch unmittelbare Auswirkungen auf die Blutgerinnung. Die Thrombozyten, auch Blutplättchen genannt, deren Zusammenballung (Aggregation) wichtig für die Blutgerinnung ist, dienen nicht nur der Speicherung und Freisetzung von Serotonin, sondern tragen selbst Serotoninrezeptoren des Typs 5-HT2A. Dank dieser führt Serotonin zu einer Entleerung der Granula der Thrombozyten und verstärkt die durch andere Botenstoffe wie beispielsweise Adenosindiphosphat oder Thrombin hervorgerufene Thrombozytenaggregation und fördert so die Blutgerinnung. In kleineren Blutgefäßen trägt es zudem durch Vasokonstriktion und somit durch einen reduzierten Blutstrom zur Wundheilung bei.[50]
Magen-Darm-System
Im Magen-Darm-Trakt hat Serotonin verschiedene motorische und sensorische Funktionen. Dabei reagiert das Verdauungssystem einerseits auf Serotonin, das aus den enterochromaffinen Zellen freigesetzt wird, andererseits fungiert Serotonin als Neurotransmitter im Darmnervensystem. An der Vermittlung der Wirkung des Serotonins im Magen-Darm-Trakt sind insbesondere die Serotonin-Rezeptoren 5-HT3 und 5-HT4 beteiligt.[51]
Serotonin, das in die Lamina propria der Darmschleimhaut freigesetzt wird, führt über eine Aktivierung verschiedener Serotoninrezeptoren zu einer Aktivierung primärer Neurone des Darmnervensystems. Diese Neurone leiten ihre Reize einerseits über erregende Motoneurone mit dem Neurotransmitter Acetylcholin und andererseits über hemmende Motoneurone mit dem Transmitter Stickstoffmonoxid weiter. Unter dem Zusammenspiel beider Motoneurone führt Serotonin zu einer aufeinander abgestimmten, abwärts gerichteten Welle aus Kontraktion und Relaxation der Darmmuskulatur, die auch als Peristaltik bezeichnet wird.[52]
In seiner sensorischen Funktion führt freigesetztes Serotonin nach einer Signalweiterleitung unter Beteiligung des Nervus vagus in Form eines Reflexes auch zu Übelkeit und Erbrechen. Unter Beteiligung der Spinalnerven werden Beschwerden und Schmerzen aus dem Magen-Darm-Trakt in Richtung Gehirn weitergeleitet.[52]
Als Quelle des Serotonins im Magen-Darm-Trakt besitzen die enterochromaffinen Zellen die größte Bedeutung. Sie reagieren auf einen erhöhten Darminnendruck mit einer Freisetzung von Serotonin, wodurch die Peristaltik angeregt wird.[53][54] Auch Aromastoffe können zu einer Aktivierung der Serotoninausschüttung aus den enterochromaffinen Zellen und somit zu einer Anregung der Bewegung des Darms, der Darmmotilität, führen.[55] Eine Nebenwirkung zahlreicher, in der Chemotherapie von Krebserkrankungen verwendeter Zytostatika, das sogenannte Zytostatika-Erbrechen, lässt sich mit einer massiven Freisetzung von Serotonin aus den enterochromaffinen Zellen erklären.[56]
Auge
Im menschlichen Auge reguliert Serotonin über eine Aktivierung verschiedener Serotoninrezeptoren den Augeninnendruck über Nerven, welche unter anderem Serotonin als Neurotransmitter nutzen. Als mögliche Mechanismen kommen eine Steuerung der Kammerwasserproduktion im Auge und eine Öffnung oder Schließung des Pupillenverengermuskels Musculus sphincter pupillae in Frage.[57][58] Auch eine Nebenwirkung sogenannter Selektiver Serotonin-Wiederaufnahmehemmer (SSRI), das gehäufte Auftreten eines Glaukoms, kann mit einer Wirkung von Serotonin auf den Augeninnendruck erklärt werden.[57]
Zentralnervensystem
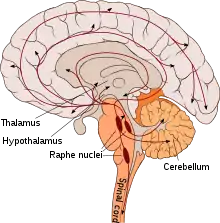
Serotonin, das sich im Zentralnervensystem in den Zellkörpern, den Somata serotoninerger Nervenbahnen in den Raphe-Kernen befindet, deren Axone in alle Teile des Gehirns ausstrahlen, beeinflusst unmittelbar oder mittelbar fast alle Gehirnfunktionen. Zu den wichtigsten Funktionen des Serotonins im Gehirn, das die Blut-Hirn-Schranke nicht überwinden kann und daher vor Ort gebildet werden muss, zählen die Steuerung oder Beeinflussung der Wahrnehmung, des Schlafs, der Temperaturregulation, der Sensorik, der Schmerzempfindung und Schmerzverarbeitung, des Appetits, des Sexualverhaltens und der Hormonsekretion. Serotonin fungiert dabei einerseits als Neurotransmitter im synaptischen Spalt, andererseits wird es diffus über freie Nervenendungen ausgeschüttet und wirkt als Neuromodulator.[59]
Stimmung
Zu den bekanntesten Wirkungen des Serotonins auf das Zentralnervensystem zählen seine Auswirkungen auf die Stimmungslage. Es gibt uns das Gefühl der Gelassenheit, inneren Ruhe und Zufriedenheit. Dabei dämpft es eine ganze Reihe unterschiedlicher Gefühlszustände, insbesondere Angstgefühle, Aggressivität, Kummer und das Hungergefühl. Depressive Verstimmungen lassen sich neurochemisch häufig auf einen Mangel an Serotonin oder seiner Vorstufe, der Aminosäure Tryptophan, zurückführen. Eine Überdosierung, z. B. durch Serotonin-Wiederaufnahmehemmer oder fehlerhafte Kombination mehrerer Medikamente, kann zu starken körperlichen Beschwerden, welche auch tödlich enden können, und Halluzinationen führen (sog. Serotoninsyndrom).
Serotonin führt über eine Stimulation bestimmter Regionen der Großhirnrinde, die für die emotionale Regulation verantwortlich sind, im Wesentlichen zu einer Hemmung der Impulsivität und des aggressiven Verhaltens. Insbesondere Serotoninrezeptoren vom Typ 5-HT1A und 5-HT1B haben einen hemmenden Einfluss. Im Umkehrschluss führen niedrige Serotoninspiegel zu einer erhöhten Impulsivität und Aggressivität.[60] Für die euphorisierende und halluzinogene Wirkung von Serotoninagonisten wie beispielsweise LSD ist eine Aktivierung von 5-HT2A-Rezeptoren verantwortlich.[61]
Serotonin wird – neben Dopamin, Oxytocin und Endorphinen – auf Grund seiner Wirkungen auf die Stimmungslage im Volksmund oft als „Glückshormon“ bezeichnet. Ein Konsum tryptophanreicher Lebensmittel, wie beispielsweise Schokolade oder Bananen, führt einerseits wegen des enthaltenen Tryptophans zu einer stimmungsaufhellenden Wirkung, da es – im Gegensatz zu Serotonin – die Blut-Hirn-Schranke überwinden kann. Zusätzlich bewirken auch die aufgenommenen Kohlenhydrate eine vermehrte Produktion und Ausschüttung von Neurotransmittern (u. a. Serotonin) im Gehirn, die zu dieser Wirkung führen.[1]
Schlaf-Wach-Rhythmus
Eine mögliche Rolle des Serotonins bei der Regulierung der Schlaf-Wach-Rhythmik ist seit den 1950er Jahren bekannt. Die Befunde zur Modulation der Schlaf-Wach-Rhythmik durch Serotonin waren lange Zeit teils widersprüchlich.[62] Nach heutigem Kenntnisstand bewirkt Serotonin im Wesentlichen die Beförderung des Wachzustands.[63] Dabei sind die serotoninhaltigen Neurone der Raphe-Kerne, welche mit dem Nucleus suprachiasmaticus (SCN) des Hypothalamus, dem Sitz der Hauptuhr der Säugetiere, verbunden sind, während des Wachzustands aktiv. Im Tiefschlaf hingegen reduzieren sie ihre Tätigkeit, und während des REM-Schlafs stellen sie diese praktisch ein.[64][65] Zugleich steuert der Nucleus suprachiasmaticus unter anderem die Produktion und Freisetzung des an der zeitlichen Steuerung des Schlafs beteiligten Hormons Melatonin aus der Zirbeldrüse.[66]
Appetit
Serotonin ist ein Neurotransmitter, dessen Ausschüttung im Gehirn indirekt mit der Nahrung in Verbindung steht. Ein Faktor ist die Konzentration an freiem Tryptophan im Blutplasma. Kohlenhydrat- und zugleich eiweißreiche Kost führt über eine Ausschüttung von Insulin zu einer Steigerung der Tryptophanaufnahme ins Gehirn, welche mit einer gesteigerten Serotoninsynthese assoziiert wird.[67]
Serotonin wird insbesondere mit einer appetithemmenden Wirkung in Verbindung gebracht. Bei übergewichtigen Menschen sind der Tryptophanspiegel im Blutplasma und der Serotoninspiegel im Gehirn verringert. Arzneistoffe, welche – wie die selektiven Serotonin-Wiederaufnahmehemmer – die Serotoninkonzentration im Gehirn erhöhen, führen zu einer Appetitlosigkeit als Nebenwirkung. Eine selektive Aktivierung von Serotoninrezeptoren des Subtyps 5-HT1A, die vorrangig als Autorezeptoren die Serotoninfreisetzung kontrollieren, führt über eine Hemmung der Serotoninausschüttung aus den Nervenenden zu einer Appetitsteigerung. Die eigentliche appetitsenkende Wirkung des Serotonins ist insbesondere auf die Serotoninrezeptoren 5-HT1B oder 5-HT2C zurückzuführen.[68]
Schmerz
Serotonin, das beispielsweise aus verletzten Nervenzellen freigesetzt wird, ist ein direkter Aktivator eines Schmerzreizes. Von größerer Bedeutung ist die Wirkung von Serotonin, über absteigende serotoninerge Neurone in das Hinterhorn des Rückenmarks Schmerzreize zu verstärken oder abzuschwächen.
Sexualverhalten
Serotonin, das unter anderem zum Zeitpunkt der Ejakulation in den Hypothalamus ausgeschüttet wird, zeigt primär eine hemmende Wirkung auf das Sexualverhalten und die Sexualfunktionen. Serotonin fungiert dabei als Gegenspieler des Dopamins.[69] Arzneistoffe wie die selektiven Serotonin-Wiederaufnahmehemmer, welche die Serotoninkonzentration im Gehirn erhöhen, können, neben einer Reduktion des Sexualbedürfnisses beim Mann, insbesondere zu einer eingeschränkten Fähigkeit zur Erektion oder zu einer Hemmung der Ejakulation führen.[70] Eine gestörte Serotoninproduktion führt im Experiment mit Mäusen zu bisexuellem Sexualverhalten, das sich durch Serotoningaben in heterosexuelles zurückführen lässt.[71] Eine Untersuchung aus dem Jahr 2015 spricht sich jedoch gegen diese Daten aus, da die Mäuse mit gestörter Serotoninproduktion bei gleichzeitiger Anwesenheit von männlichen und weiblichen Tieren im Versuch immer die Weibchen bevorzugten.[72]
Temperaturregulation
Serotonin ist im Zentralnervensystem an der Regulation der Körpertemperatur beteiligt. Je nach involviertem Gehirnareal und je nach beteiligten Rezeptoren führt Serotonin zu einem Anstieg (Hyperthermie) oder einer Absenkung der Körpertemperatur (Hypothermie).[73] Die hypotherme Wirkung des Serotonins wird insbesondere mit einer Aktivierung von Serotoninrezeptoren des Subtyps 5-HT7 in Verbindung gebracht.[74]
Pathophysiologie
Neuroendokrine Tumoren
_Endoscopic_resection.jpg.webp)
Serotonin spielt häufig bei neuroendokrinen Tumoren, das heißt bei gut- oder bösartigen Tumoren mit Eigenschaften von Nervenzellen (Neurone) und hormonproduzierenden (endokrinen) Drüsen, eine zentrale Rolle. Das Karzinoid, eine Sammelbezeichnung für neuroendokrine Tumoren des Magen-Darm-Trakts, ist durch die Überproduktion von Gewebshormonen, insbesondere Serotonin, geprägt. Im Gegensatz zu den meisten anderen Tumoren sind die charakteristischen Symptome des Karzinoids nicht auf eine Verdrängung von gesundem Gewebe, sondern insbesondere auf die Wirkungen des erhöhten Serotoninspiegels zurückzuführen. Ein erster Hinweis auf eine karzinoidbedingte Erhöhung des Serotoninspiegels im Magen-Darm-Trakt sind anhaltende Durchfälle und Bauchkrämpfe. Bei einer erhöhten Serotonin-Produktion außerhalb des Magen-Darm-Trakts, beispielsweise nach Metastasierung, sind systemische Serotonin-Wirkungen, wie das Flush-Syndrom, zu beobachten.[28] Ist der Serotoninspiegel karzinoidbedingt über eine längere Zeit erhöht, treten als Folge der hypertrophischen Wirkung des Serotonins Fibrosen, insbesondere der Trikuspidalklappen und Pulmonalklappen des Herzes, auf.[75]
Pulmonale Hypertonie
Störungen des Serotonin-Systems werden als eine mögliche Ursache für die Entstehung der seltenen pulmonal-arteriellen Hypertonie betrachtet. Arzneistoffe, die den Serotonintransporter hemmen und die freie Serotoninkonzentration erhöhen, können die Entstehung einer pulmonalen Hypertonie begünstigen.[76] Ein Polymorphismus des Serotonintransporter-Gens und eine Mutation des Serotoninrezeptors 5-HT2B wurden als weitere mögliche Ursachen einer pulmonale Hypertonie gefunden.[77][78]
Migräne
Neben anderen Neurotransmittern spielt Serotonin eine zentrale Rolle in der Pathophysiologie der Migräne. Im Vorfeld einer Migräne und während einer Migräneattacke können charakteristische Schwankungen des Serotoninspiegels beobachtet werden. Ein niedriger Serotoninspiegel in den betreffenden Gehirnarealen wird dabei mit einer Ausbreitung sogenannter trigeminovaskulärer Schmerzreize als Ursache der Migräne in Verbindung gebracht.[79]
Depression
1969 stellten gleichzeitig Alec Coppen, Izyaslav Lapin und Gregory Oxenkrug die Hypothese auf, dass ein Mangel an Serotonin ursächlich für die Entstehung von Depressionen sei.[80][81] Sie basiert auf früheren Beobachtungen, dass die Konzentration des Serotonin-Abbauprodukts 5-Hydroxyindolylessigsäure in der Gehirnflüssigkeit bei depressiven Patienten reduziert sei.[82][83] Eine klare Korrelation zwischen 5-Hydroxyindolylessigsäure-Konzentration und dem Schweregrad einer Depression besteht dennoch nicht, da die Konzentration des Metaboliten nur ein indirektes Maß für die Serotonin-Konzentration ist.[84] Beobachtungen nach einem pharmakologisch induzierten Serotoninmangel oder der Anwendung von Serotoninwiederaufnahmehemmern stützen die Serotonin-Hypothese der Depression.[85] Nach der Beobachtung, dass bei depressiven Patienten die Aufnahmefähigkeit von Serotonin in Blutplättchen und in das Gehirn reduziert ist, wurde der Serotonintransporter und ein genetischer Polymorphismus der Promotorregion seines Gens (5-HTTLPR) als ein Vulnerabilitätsfaktor für das Auftreten einer Depression vermutet. Da die Ergebnisse wissenschaftlicher Untersuchungen über die Beteiligung von Serotonin zum Teil widersprüchlich sind, ist die Serotonin-Hypothese der Depression nicht unumstritten.[86]
Da insbesondere der biochemische Weg unklar bleibt, auf dem eine Erhöhung des Serotoninspiegels im Gehirn zu einer Besserung depressiver Symptome führen soll, werden jetzt auch alternative Hypothesen diskutiert.
Pharmakologie
Serotonin selbst findet keine therapeutische Anwendung. Demgegenüber werden Arzneistoffe, welche die Freisetzung, die Wirkung, die Wiederaufnahme und den Abbau von Serotonin beeinflussen, in vielfältiger Weise zur Behandlung und Vorbeugung von Krankheiten eingesetzt. Das mengenmäßig größte Einsatzgebiet von Arzneistoffen mit einer Wirkung auf das Serotonin-System sind psychische Erkrankungen. Auch andere psychotrope Substanzen, die keine arzneiliche Wirkung entfalten, wirken auf Serotoninrezeptoren. Ebenso entfalten manche Nahrungsmittel und Nahrungsergänzungsmittel Wirkungen im Serotoninsystem des Gehirns.
Antidepressiva
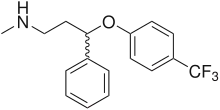
In der Behandlung von Depressionen besitzen selektive Serotonin-Wiederaufnahmehemmer (SSRI) wie beispielsweise Fluoxetin, Fluvoxamin, Paroxetin, Sertralin und Citalopram einen hohen Stellenwert. Sie sind Hemmstoffe des Serotonintransporters und führen zu einer erhöhten Konzentration und einem verlängerten Verbleib von Serotonin im synaptischen Spalt. Auch die Wirkung der älteren trizyklischen Antidepressiva beruht – zumindest zum Teil – auf einer Hemmung des Serotonintransporters. Die ebenfalls als Antidepressiva genutzten MAO-Hemmer wie Tranylcypromin und Moclobemid verdanken ihre Wirksamkeit einer Hemmung des serotoninabbauenden Enzyms Monoaminooxidase.
Neuroleptika
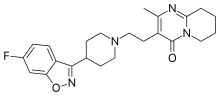
Die von den klassischen Neuroleptika abweichenden klinischen Eigenschaften zahlreicher atypischer Neuroleptika werden mit einer über eine Hemmung von Dopaminrezeptoren hinausgehenden zusätzlichen Hemmung von Serotoninrezeptoren des Subtyps 5-HT2A erklärt (Dopamin-Serotonin-Hypothese). Atypische Neuroleptika wie beispielsweise Clozapin, Olanzapin und Risperidon haben eine im Wesentlichen verbesserte Wirkung auf die Negativsymptome der Schizophrenie sowie eine reduzierte Häufigkeit extrapyramidal-motorischer Nebenwirkungen und Spätdyskinesien. Das Verhältnis aus der Affinität eines Neuroleptikums zu 5-HT2A-Rezeptoren zu seiner Affinität zu D2-Rezeptoren, auch Meltzer-Index genannt, dient in diesem Zusammenhang der Vorhersage atypisch-neuroleptischer Eigenschaften.[87]
Die Verwendung von Reserpin, einem Arzneistoff, der zu einer sogenannten „Entspeicherung“ von Neurotransmittern und somit unter anderem zu einer verminderten Konzentration von Serotonin im synaptischen Spalt führt, gilt als ein Meilenstein für die Entwicklung der modernen Psychiatrie. Heute ist Reserpin nur noch von historischer Bedeutung.[88]
Hypnotika (Schlafmittel)
Auf Grund der Wirkungen des Serotonins auf den Schlaf werden die Serotonin-Vorstufen Tryptophan und 5-Hydroxytryptophan unter anderem als milde Schlafmittel eingesetzt. Sie sind Prodrugs, die nach Aufnahme in den Körper die Blut-Hirn-Schranke passieren können und unter anderem im Gehirn zu Serotonin verstoffwechselt werden. Beide Substanzen kamen in den 1990er Jahren vorübergehend in Verruf auf Grund einer Kontamination mit dem Neurotoxin Tryptamin-4,5-dion und dem Auftreten des zum Teil tödlichen Eosinophilie-Myalgie-Syndroms als Folge.[89]
Tranquillanzien
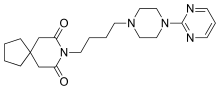
Auch Buspiron, ein Partialagonist des 5-HT1A-Rezeptors, findet als Psychopharmakon zur Behandlung generalisierter Angststörungen Anwendung. In seiner Wirkung unterscheidet sich Buspiron von anderen Angstlösern (Anxiolytika), die vorrangig nicht das Serotoninsystem, sondern die Rezeptoren des Neurotransmitters γ-Aminobuttersäure (GABA) zum Ziel haben.
Appetitzügler
Die appetithemmende Wirkung des Serotonins wurde auf verschiedene Weise für Appetitzügler ausgenutzt. Viele dieser Arzneistoffe, wie beispielsweise Lorcaserin und Fenfluramin, zeigen eine direkte stimulierende Wirkung auf den 5-HT2C-Rezeptor, die mit einem appetithemmenden Effekt assoziiert wird.[90][91] Auch die schweren Nebenwirkungen der früher verwendeten Appetitzügler Aminorex und Fenfluramin, welche Herzklappenfehler und pulmonale Hypertonie einschließen, werden mit einer Wirkung auf das Serotonin-System, insbesondere der Aktivierung von 5-HT2B-Rezeptoren, in Verbindung gebracht.
Ein weiterer Wirkmechanismus einiger Appetitzügler wie beispielsweise Sibutramin ist die Konzentrationserhöhung von Serotonin an seinen Rezeptoren durch Hemmung des Serotonintransporters.
Migränetherapeutika
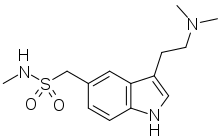
In der Therapie akuter Migräneattacken finden insbesondere 5-HT1B/1D-Rezeptoragonisten aus der Gruppe der Triptane wie beispielsweise Sumatriptan Anwendung. In der Migräneprophylaxe wurden hingegen, zumindest bis zum Siegeszug der Betablocker, Serotoninantagonisten wie Methysergid und Pizotifen genutzt.
Antihypertensiva (Blutdrucksenker)
Als Antihypertensiva finden der 5-HT2A-Antagonist Ketanserin und der 5-HT1A-Agonist Urapidil zur Behandlung erhöhten Blutdrucks Anwendung. Ihre blutdrucksenkende Wirkung wird jedoch nicht vorrangig mit einer Interaktion mit Serotoninrezeptoren, sondern vielmehr mit einer zusätzlichen Wechselwirkung mit Adrenozeptoren erklärt.[92]
Blutgerinnungshemmer
Der 5-HT2A-Antagonist Sarpogrelat wird als Thrombozytenaggregationshemmer eingesetzt. Als solcher findet der Wirkstoff zur Behandlung von Schlaganfällen, Herzinfarkten und anderen Durchblutungsstörungen Anwendung. Seine Wirkung wird auf eine Blockade von 5-HT2A-Rezeptoren auf der Blutplättchenoberfläche und damit verbunden einer Hemmung der durch Serotonin vermittelten Verstärkung der Zusammenballung der Blutplättchen zurückgeführt.[93]
Antiemetika
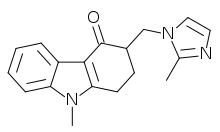
Als Antiemetika zur Behandlung von Übelkeit und Erbrechen werden Setrone wie Ondansetron, Granisetron, Tropisetron und Palonosetron eingesetzt. Ihre größte Wirksamkeit zeigen sie bei der Behandlung des akuten Erbrechens nach einer Chemotherapie von Tumorerkrankungen mit mäßig oder hochgradig brechreizauslösenden Zytostatika wie beispielsweise Cisplatin. Die Kombinationstherapie von Palonosetron mit dem Glucocorticoid Dexamethason ist darüber hinaus beim verzögerten Zytostatikaerbrechen erfolgversprechend.[94] Des Weiteren kommen sie bei der Therapie von postoperativer Übelkeit und Erbrechen zum Einsatz.[95]
Ihre Wirksamkeit verdanken die Setrone einer Hemmung der Serotoninwirkung an 5-HT3-Rezeptoren, die sowohl im Darmnervensystem als auch im Brechzentrum des Hirnstammes in besonders hoher Dichte zu finden sind. Auch die brechreizhemmende Wirkung von Metoclopramid beruht zumindest zum Teil auf einer antagonistischen Wirkung auf diese Rezeptoren.[96] Der 5-HT3-Rezeptorantagonist Alosetron findet darüber hinaus in der Behandlung des Reizdarmsyndroms Anwendung.[97]
Prokinetika
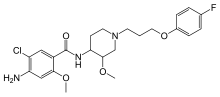
Auf einer serotoninanalogen Stimulierung von 5-HT4-Rezeptoren beruht die Darmperistaltik anregende Wirkung der Prokinetika. Arzneistoffe mit einer auf einer Aktivierung von 5-HT4-Rezeptoren beruhenden prokinetischen Wirkung wie beispielsweise Cisaprid und Metoclopramid werden zur Behandlung verschiedener Magen-Darm-Störungen, einschließlich Bauchschmerzen, Verstopfung, Blähungen und Erbrechen, eingesetzt. Der 5-HT4-Rezeptorenagonist Tegaserod wurde in den USA zur Therapie des Reizdarmsyndroms zugelassen, aber nach kurzer Zeit auf Grund von Sicherheitsbedenken wieder vom Markt genommen.
Die therapeutische Verwendung von Aromastoffen, welche die enterochromaffinen Zellen zur Serotoninfreisetzung stimulieren, wurde als eine Option für die Entwicklung neuer Arzneimittel postuliert.[55]
Entaktogene und Empathogene
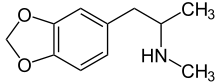
Als Entaktogene (Adjektiv entaktogen, „das Innere berührend“, aus griechisch en, „innen“, lateinisch tactus „berührt“) und Empathogene (empátho; altgriechisch ἐμπάθω, „mitfühlen“; vergleiche Empathie; -gen von altgriechisch γένεσις, génesis, „Entstehung“) werden psychoaktive Substanzen bezeichnet, unter deren Einfluss die eigenen Emotionen intensiver wahrgenommen werden. Der Terminus Entaktogen wurde von dem US-amerikanischen Chemiker David E. Nichols in den 1980er Jahren eingeführt.[98] Zu jener Zeit wurden diese Substanzen auch in der umstrittenen psycholytischen Psychotherapie eingesetzt, da sich der Patient seiner eigenen Psyche besser bewusst wird und somit der Zugang zu seinem Unterbewussten erleichtert wird. Beide Termini werden synonym verwendet. Viele Entaktogene, wie z. B. 3,4-Methylendioxyamphetamin (MDA), 3,4-Methylendioxy-N-methylamphetamin (MDMA), 3,4-Methylendioxy-N-methylcathinon (bk-MDMA, MDMC) wirken als Releaser (Ausschütter) der endogenen Monoamin-Neurotransmitter Serotonin und Noradrenalin, was zu einem unüblich erhöhten Spiegel dieser Botenstoffe im Gehirn führt.[99]
Psychedelika und Halluzinogene
Als Psychedelika (zusammengesetzt aus altgriechisch ψυχη psychḗ‚ Seele‘ und δῆλος dẽlos ‚offenkundig, offenbar‘) werden psychotrope Substanzen bezeichnet, die als potente Agonisten der Serotonin-Rezeptoren 5-HT2A/2C wirksam sind.[100][101] Der Begriff ging 1956 aus einem Briefwechsel des Psychiaters Humphry Osmond mit dem Schriftsteller Aldous Huxley hervor.[102] Der Duden definiert psychedelisch wie folgt: „das Bewusstsein verändernd; einen euphorischen, tranceartigen Gemütszustand hervorrufend“.[103] Der Beipackzettel des Psychedelikums Delysid (LSD), welches 1949 auf den Markt kam, wies auf die Möglichkeit der Anwendung als Psycholytikum und Psychotomimetikum hin. Textauszug Indikation: „(a) In der analytischen Psychotherapie zur Förderung seelischer Entspannung durch Freisetzung verdrängten Materials. (b) Experimentelle Studien über das Wesen der Psychose: Indem der Psychiater selbst Delysid einnimmt, wird er in die Lage versetzt, eine Einsicht in die Welt der Ideen und Wahrnehmungen psychiatrischer Patienten zu gewinnen.“[104] Die Intoxikation mit psychedelischen Zuständen wird Trip genannt, der klinische Überbegriff der Psychedelika wird Halluzinogene genannt; mögliche medizinische Anwendungen werden diskutiert.[105][106][107] Zu den Psychedelika gehören:
- halluzinogene Tryptamine: z. B. Psilocybin, Dimethyltryptamin (DMT), 5-MeO-DMT, AMT, 4-HO-DIPT etc.
- halluzinogene Phenylethylamine: z. B. Mescalin, 2C-B, 2C-I, 25I-NBOMe, DOB, DOM, TMA, Bromo-DragonFLY etc.
- halluzinogene Lysergsäureamide: z. B. LSD und seine Analoga, LSH, Ergin (LSA) etc.



 Mescalinhaltiger Kaktus (Peyote)
Mescalinhaltiger Kaktus (Peyote) DOB-Blotter
DOB-Blotter
Einzelnachweise
- Eintrag zu Serotonin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- A. Chattopadhyay, R. Rukmini, S. Mukherjee: Photophysics of a neurotransmitter: Ionization and spectroscopic properties of serotonin. In: Biophys J. Band 71, 1996, S. 1952–1960.
- Eintrag zu Serotonin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021.
- Datenblatt Serotonin hydrochloride bei Sigma-Aldrich, abgerufen am 8. Mai 2017 (PDF).
- C. Ludwig, A. Schmidt: Das Verhalten der Gase, welche mit dem Blut durch den reizbaren Säugethiermuskel strömen. In: Arbeiten aus der Physiologischen Anstalt zu Leipzig. 1868, S. 1–61 (Online).
- M. M. Rapport, A. A. Green, I. H. Page: Serum vasoconstrictor, serotonin; isolation and characterization. In: Journal of Biological Chemistry. Band 176, Nr. 3, Dezember 1948, S. 1243–1251, PMID 18100415 (englisch).
- M. M. Rapport: Serum vasoconstrictor (serotonin) the presence of creatinine in the complex; a proposed structure of the vasoconstrictor principle. In: Journal of Biological Chemistry. Band 180, Nr. 3, Oktober 1949, S. 961–969, PMID 18139191 (englisch).
- K. E. Hamlin, F. E. Fischer: The synthesis of 5-hydroxytryptamine. In: J. Am. Chem. Soc. Band 73, Nr. 10, 1951, S. 5007–5008, doi:10.1021/ja01154a551.
- V. Erspamer, B. Asero: Identification of enteramine, the specific hormone of the enterochromaffin cell system, as 5-hydroxytryptamine. In: Nature. Band 169, Nr. 4306, Mai 1952, S. 800–801, PMID 14941051 (englisch).
- B. M. Twarog, I. H. Page: Serotonin content of some mammalian tissues and urine and a method for its determination. In: American Journal of Physiology. Band 175, Nr. 1, Oktober 1953, S. 157–161, PMID 13114371 (englisch).
- J. H. Gaddum, Z. P. Picarelli: Two kinds of tryptamine receptor. In: British Journal of Pharmacology and Chemotherapy. Band 12, Nr. 3, September 1957, S. 323–328, PMID 13460238, PMC 1509685 (freier Volltext) – (englisch).
- S. J. Peroutka: 5-Hydroxytryptamine receptors in vertebrates and invertebrates: why are there so many? In: Neurochemistry International. Band 25, Nr. 6, Dezember 1994, S. 533–536, PMID 7894329 (englisch).
- J. M. Feldman, E. M. Lee: Serotonin content of foods: effect on urinary excretion of 5-hydroxyindoleacetic acid. In: American Journal of Clinical Nutrition. Band 42, Nr. 4, Oktober 1985, S. 639–643, PMID 2413754 (englisch).
- K. McGowan, A. Kane, N. Asarkof, J. Wicks, V. Guerina, J. Kellum, S. Baron, A. R. Gintzler, M. Donowitz: Entamoeba histolytica causes intestinal secretion: role of serotonin. In: Science. Band 221, Nr. 4612, August 1983, S. 762–764, PMID 6308760 (englisch).
- K. Kang, S. Kang, K. Lee, M. Park, K. Back: Enzymatic features of serotonin biosynthetic enzymes and serotonin biosynthesis in plants. In: Plant Signaling & Behavior. Band 3, Nr. 6, Juni 2008, S. 389–390, PMID 19704574, PMC 2634310 (freier Volltext) – (englisch).
- B. Muszyńska, K. Sułkowska-Ziaja, H. Ekiert: Indole compounds in fruiting bodies of some selected Macromycetes species and in their mycelia cultured in vitro. In: Pharmazie. Band 64, Nr. 7, Juli 2009, S. 479–480, PMID 19694188 (englisch).
- T. Herraiz: Tetrahydro-beta-carbolines, potential neuroactive alkaloids, in chocolate and cocoa. In: Journal of Agricultural and Food Chemistry. Band 48, Nr. 10, Oktober 2000, S. 4900–4904, doi:10.1021/jf000508l, PMID 11052752 (englisch).
- P. Schröder, C. Abele, P. Gohr, U. Stuhlfauth-Roisch, W. Grosse: Latest on enzymology of serotonin biosynthesis in walnut seeds. In: Advances in Experimental Medicine and Biology. Band 467, 1999, S. 637–644, PMID 10721112 (englisch).
- David B. Repke, M. Torres Constantino: Anadenanthera: visionary plant of ancient South America. Haworth Herbal Press, New York 2006, ISBN 0-7890-2642-2, The chemistry of the genus Anadenanthera, S. 95–142.
- E. Tanaka, C. Tanaka, N. Mori, Y. Kuwahara, M. Tsuda: Phenylpropanoid amides of serotonin accumulate in witches’ broom diseased bamboo. In: Phytochemistry. Band 64, Nr. 5, November 2003, S. 965–969, PMID 14561512.
- D. L. Chase, M. R. Koelle: Biogenic amine neurotransmitters in C. elegans. In: WormBook. 2007, S. 1–15, doi:10.1895/wormbook.1.132.1, PMID 18050501 (englisch).
- S. J. Peroutka, T. A. Howell: The molecular evolution of G protein-coupled receptors: focus on 5-hydroxytryptamine receptors. In: Neuropharmacology. Band 33, Nr. 3–4, 1994, S. 319–324, PMID 7984268.
- J. Chauveau, V. Fert, A. M. Morel, M. A. Delaage: Rapid and specific enzyme immunoassay of serotonin. In: Clin. Chem. Band 37, Nr. 7, Juli 1991, S. 1178–1184, PMID 1855288.
- E. Flachaire, C. Beney, A. Berthier, J. Salandre, C. Quincy, B. Renaud: Determination of reference values for serotonin concentration in platelets of healthy newborns, children, adults, and elderly subjects by HPLC with electrochemical detection. In: Clin. Chem. Band 36, Nr. 12, Oktober 1990, S. 2117–2120, PMID 2253357.
- D. Y. Kim, M. Camilleri: Serotonin: a mediator of the brain-gut connection. In: Am. J. Gastroenterol. Band 95, Nr. 10, Oktober 2000, S. 2698–2709, doi:10.1111/j.1572-0241.2000.03177.x, PMID 11051338.
- E. P. Benditt, R. L. Wong, M. Arase, E. Roeper: 5-Hydroxytryptamine in mast cells. In: Proc. Soc. Exp. Biol. Med. Band 90, Nr. 1, Oktober 1955, S. 303–304, PMID 13273431.
- H. Tamir, T. C. Theoharides, M. D. Gershon, P. W. Askenase: Serotonin storage pools in basophil leukemia and mast cells: characterization of two types of serotonin binding protein and radioautographic analysis of the intracellular distribution of [3H]serotonin. In: J. Cell Biol. Band 93, Nr. 3, Juni 1982, S. 638–647, PMID 7118996, PMC 2112151 (freier Volltext).
- I. M. Modlin, M. Kidd, I. Latich, M. N. Zikusoka, M. D. Shapiro: Current status of gastrointestinal carcinoids. In: Gastroenterology. Band 128, Nr. 6, Mai 2005, S. 1717–1751, PMID 15887161.
- A. Ek, B. Witkop: The Synthesis of Labile Hydroxytryptophan Metabolites. In: J. Am. Chem. Soc. Band 76, Nr. 22, 1954, S. 5579–5588, doi:10.1021/ja01651a001.
- R. Majiama, M. Kotake: Synthetische Versuche in der Indol-Gruppe, VI.: Eine neue Synthese von β-Indolyl-alkylaminen. In: Chem. Ber. Band 58, 1925, S. 2042–2046, doi:10.1002/cber.19250580917.
- M. E. Speeter, R. V. Heinzelmann, D. I. Weisblatt: The synthesis of the blood serum vasoconstrictor principle serotonin creatinine sulfate. In: J. Am. Chem. Soc. Band 73, Nr. 11, 1951, S. 5514–5515, doi:10.1021/ja01155a580.
- K. H. Matzke, G. J. Meyer, A. Osterholz, G. Coates, G. Firnau: Synthesis of 11C-labeled 5-hydroxytryptamine for the measurement of pulmonary endothelial cell function. In: International Journal of Radiation Applications and Instrumentation. Part A. Applied Radiation and Isotopes. Band 42, Nr. 4, 1991, S. 401–404, doi:10.1016/0883-2889(91)90145-Q.
- W. E. Noland, R. A. Hovden: A new synthesis of serotonin. In: J. Org. Chem. Band 24, Nr. 6, 1959, S. 894–895, doi:10.1021/jo01088a632.
- E. H. P. Young: The synthesis of 5-hydroxytryptamine (serotonin) and related tryptamines. In: J. Chem. Soc. 1958, S. 3493–3496, doi:10.1039/JR9580003493.
- M. E. Speeter, W. C. Anthony: THE ACTION OF OXALYL CHLORIDE ON INDOLES: A NEW APPROACH TO TRYPTAMINES. In: J. Am. Chem. Soc. Band 76, Nr. 23, 1954, S. 6208–6210, doi:10.1021/ja01652a113.
- M. Somei, F. Yamada, T. Kurauchi u. a.: The chemistry of indoles. CIII. Simple syntheses of serotonin, N-methylserotonin, bufotenine, 5-methoxy-N-methyltryptamine, bufobutanoic acid, N-(indol-3-yl)methyl-5-methoxy-N-methyltryptamine, and lespedamine based on 1-hydroxyindole chemistry. In: Chem. Pharm. Bull. Band 49, Nr. 1, Januar 2001, S. 87–96, PMID 11201232.
- John Harley-Mason, A. H. Jackson: Hydroxytryptamines. Part I. Bufotenine, 6-hydroxybufotenine, and serotonin. In: J. Chem. Soc. 1954, S. 1165–1171, doi:10.1039/JR9540001165.
- R. A. Abramovitch, D. Shapiro: Tryptamines, carbolines, and related compounds. Part II. A convenient synthesis of tryptamines and β-carbolines. In: J. Chem. Soc. 1956, S. 4589, doi:10.1039/JR9560004589.
- G. Revial, I. Jabin, S. Lim, M. Pfau: Aromatization of 1,6,7,7a-Tetrahydro-2H-indol-2-ones by a Novel Process. Preparation of Key-Intermediate Methyl 1-Benzyl-5-methoxy-1H-indole-3-acetate and the Syntheses of Serotonin, Melatonin, and Bufotenin. In: J. Org. Chem. Band 67, Nr. 7, 2002, S. 2252–2256, doi:10.1021/jo0110597.
- A. Feldstein, H. Hoagland, K. K. Wong, M. R. Oktem, H. Freeman: MAO activity in relation to depression. In: Am J Psychiatry. Band 120, Juni 1964, S. 1192–1194, PMID 14154756.
- A. Helander, T. Wikström, C. Löwenmo, G. Jacobsson, O. Beck: Urinary excretion of 5-hydroxyindole-3-acetic acid and 5-hydroxytryptophol after oral loading with serotonin. In: Life Sci. Band 50, Nr. 17, 1992, S. 1207–1213, PMID 1373788.
- Discover EggNOG 4.5.1: A database of orthologous groups and functional annotation. In: eggnog.embl.de. Abgerufen am 23. September 2018 (englisch).
- D. C. Klein: Arylalkylamine N-acetyltransferase: „the Timezyme“. In: J. Biol. Chem. Band 282, Nr. 7, Februar 2007, S. 4233–4237, doi:10.1074/jbc.R600036200, PMID 17164235.
- M. J. Millan, P. Marin, J. Bockaert, C. M. la Cour: Signaling at G-protein-coupled serotonin receptors: recent advances and future research directions. In: Trends in Pharmacological Sciences. Band 29, Nr. 9, September 2008, S. 454–464, doi:10.1016/j.tips.2008.06.007, PMID 18676031 (englisch).
- Diego J. Walther, Jens-Uwe Peter, Sandra Winter, Markus Höltje, Nils Paulmann, Maik Grohmann, Jakob Vowinckel, Victor Alamo-Bethencourt, Claudia S. Wilhelm, Gudrun Ahnert-Hilger, Michael Bader: Serotonylation of small GTPases is a signal transduction pathway that triggers platelet alpha-granule release. In: Cell. Band 115, Nr. 7, Dezember 2003, S. 851–862, doi:10.1016/S0092-8674(03)01014-6, PMID 14697203 (englisch).
- P. R. Saxena, A. Lawang: A comparison of cardiovascular and smooth muscle effects of 5-hydroxytryptamine and 5-carboxamidotryptamine, a selective agonist of 5-HT1 receptors. In: Archives Internationales de Pharmacodynamie et de Therapie. Band 277, Nr. 2, Oktober 1985, S. 235–252, PMID 2933009 (englisch).
- C. Ullmer, K. Schmuck, H. O. Kalkman, H. Lübbert: Expression of serotonin receptor mRNAs in blood vessels. In: FEBS Letters. Band 370, Nr. 3, August 1995, S. 215–221, doi:10.1016/0014-5793(95)00828-W, PMID 7656980 (englisch).
- S. W. Watts, M. L. Cohen: Vascular 5-HT receptors: pharmacology and pathophysiology of 5-HT1B, 5-HT1D, 5-HT1F, 5-HT2B und 5-HT7 receptors. In: Neurotransmissions. Band 15, 1999, S. 3–15 (englisch).
- A. G. Ramage, C. M. Villalón: 5-hydroxytryptamine and cardiovascular regulation. In: Trends in Pharmacological Sciences. Band 29, Nr. 9, September 2008, S. 472–481, PMID 19086344 (englisch).
- Josef T. Prchal, Marshall A. Lichtman, William A. Williams, Ernest Beutler, Kenneth Kaushansky, Thomas J. Kipps, Uri Seligsohn: Williams hematology. McGraw-Hill, New York 2006, ISBN 0-07-143591-3 (englisch).
- M. D. Gershon: Review article: serotonin receptors and transporters – roles in normal and abnormal gastrointestinal motility. In: Aliment. Pharmacol. Ther. 20 Suppl 7, November 2004, S. 3–14, doi:10.1111/j.1365-2036.2004.02180.x, PMID 15521849.
- M. M. Costedio, N. Hyman, G. M. Mawe: Serotonin and its role in colonic function and in gastrointestinal disorders. In: Dis. Colon Rectum. Band 50, Nr. 3, März 2007, S. 376–388, doi:10.1007/s10350-006-0763-3, PMID 17195902.
- E. Bülbring, A. Crema: The release of 5-hydroxytryptamine in relation to pressure exerted on the intestinal mucosa. In: J. Physiol. (Lond.). Band 146, Nr. 1, April 1959, S. 18–28, PMID 13655213, PMC 1356887 (freier Volltext).
- M. D. Gershon: Review article: roles played by 5-hydroxytryptamine in the physiology of the bowel. In: Aliment. Pharmacol. Ther. 13 Suppl 2, Mai 1999, S. 15–30, PMID 10429737.
- T. Braun, P. Voland, L. Kunz, C. Prinz, M. Gratzl: Enterochromaffin cells of the human gut: sensors for spices and odorants. In: Gastroenterology. Band 132, Nr. 5, Mai 2007, S. 1890–1901, doi:10.1053/j.gastro.2007.02.036, PMID 17484882.
- M. Minami, T. Endo, M. Hirafuji u.-a.: Pharmacological aspects of anticancer drug-induced emesis with emphasis on serotonin release and vagal nerve activity. In: Pharmacol Ther. Band 99, Nr. 2, August 2003, S. 149–165, PMID 12888110.
- C. Costagliola, F. Parmeggiani, F. Semeraro, A. Sebastiani: Selective serotonin reuptake inhibitors: a review of its effects on intraocular pressure. In: Curr Neuropharmacol. Band 6, Nr. 4, Dezember 2008, S. 293–310, doi:10.2174/157015908787386104, PMID 19587851, PMC 2701282 (freier Volltext).
- N. A. Sharif: Serotonin-2 receptor agonists as novel ocular hypotensive agents and their cellular and molecular mechanisms of action. In: Curr Drug Targets. Band 11, Nr. 8, August 2010, S. 978–993, PMID 20426763.
- L. Descarries, M. A. Audet, G. Doucet, S. Garcia, S. Oleskevich, P. Séguéla, J. J. Soghomonian, K. C. Watkins: Morphology of central serotonin neurons. Brief review of quantified aspects of their distribution and ultrastructural relationships. In: Annals of the New York Academy of Sciences. Band 600, 1990, S. 81–92, PMID 2252339 (englisch).
- R. J. Nelson, B. C. Trainor: Neural mechanisms of aggression. In: Nature Reviews Neuroscience. Band 8, Nr. 7, Juli 2007, S. 536–546, doi:10.1038/nrn2174, PMID 17585306 (englisch, pdf (Memento vom 11. Februar 2014 im Internet Archive)). Neural mechanisms of aggression (Memento des Originals vom 11. Februar 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- D. E. Nichols: Hallucinogens. In: Pharmacology & Therapeutics. Band 101, Nr. 2, Februar 2004, S. 131–181, doi:10.1016/j.pharmthera.2003.11.002, PMID 14761703 (englisch).
- M. Jouvet: Sleep and serotonin: an unfinished story. In: Neuropsychopharmacology. Band 21, 2 Suppl, August 1999, S. 24S–27S, doi:10.1016/S0893-133X(99)00009-3, PMID 10432485 (englisch).
- J. M. Monti: The role of dorsal raphe nucleus serotonergic and non-serotonergic neurons, and of their receptors, in regulating waking and rapid eye movement (REM) sleep. In: Sleep Med Rev. Band 14, Nr. 5, Oktober 2010, S. 319–327, doi:10.1016/j.smrv.2009.10.003, PMID 20153670.
- J. M. Monti, H. Jantos: The roles of dopamine and serotonin, and of their receptors, in regulating sleep and waking. In: Prog. Brain Res. Band 172, 2008, S. 625–646, doi:10.1016/S0079-6123(08)00929-1, PMID 18772053.
- L. P. Morin: Serotonin and the regulation of mammalian circadian rhythmicity. In: Ann. Med. Band 31, Nr. 1, Februar 1999, S. 12–33, PMID 10219711.
- D. P. Cardinali u. a.: Serotonin and Sleep: Molecular, Functional and Clinical Aspects. Hrsg.: J. M. Monti. Birkhäuser Basel, 2008, ISBN 3-7643-8560-X, Circadian control by serotonin and melatonin receptors: Clinical relevance.
- R. J. Wurtman, J. J. Wurtman: Brain serotonin, carbohydrate-craving, obesity and depression. In: Obesity Research. 3 Suppl 4, November 1995, S. 477S–480S, PMID 8697046 (englisch).
- S. E. Ohia, C. A. Opere: Obesity: epidemiology, pathophysiology, and prevention. Hrsg.: Harry G. Preuss, Debasis Bagchi. Taylor & Francis, Washington, DC 2007, ISBN 0-8493-3802-6, Role of neurotransmitters in obesity regulation, S. 71–80 (englisch).
- E. M. Hull, J. W. Muschamp, S. Sato: Dopamine and serotonin: influences on male sexual behavior. In: Physiology & Behavior. Band 83, Nr. 2, November 2004, S. 291–307, doi:10.1016/j.physbeh.2004.08.018, PMID 15488546 (englisch).
- M. D. Waldinger, B. Olivier: Selective serotonin reuptake inhibitor-induced sexual dysfunction: clinical and research considerations. In: International Clinical Psychopharmacology. 13 Suppl 6, Juli 1998, S. S27–33, PMID 9728672 (englisch).
- Yan Liu, Yun’ai Jiang u. a.: Molecular regulation of sexual preference revealed by genetic studies of 5-HT in the brains of male mice. In: Nature. Band 472, 2011, S. 95, doi:10.1038/nature09822.
- Mariana Angoa-Pérez, Nieves Herrera-Mundo u. a.: Brain Serotonin Signaling Does Not Determine Sexual Preference in Male Mice. In: PLOS ONE. Band 10, 2015, Artikel e0118603, doi:10.1371/journal.pone.0118603.
- R. D. Myers: Serotonin and thermoregulation: old and new views. In: Journal of Physiology (Paris). Band 77, Nr. 2-3, 1981, S. 505–513, PMID 6793718 (englisch).
- P. B. Hedlund, J. G. Sutcliffe: Functional, molecular and pharmacological advances in 5-HT7 receptor research. In: Trends in Pharmacological Sciences. Band 25, Nr. 9, September 2004, S. 481–486, PMID 15559250 (englisch).
- M. Druce, A. Rockall, A. B. Grossman: Fibrosis and carcinoid syndrome: from causation to future therapy. In: Nature Reviews Endocrinology. Band 5, Nr. 5, Mai 2009, S. 276–283, doi:10.1038/nrendo.2009.51, PMID 19444261.
- M. R. Maclean, Y. Dempsie: The serotonin hypothesis of pulmonary hypertension revisited. In: Adv. Exp. Med. Biol. Band 661, 2010, S. 309–322, doi:10.1007/978-1-60761-500-2_20, PMID 20204739.
- S. Eddahibi, N. Morrell, M. P. d’Ortho, R. Naeije, S. Adnot: Pathobiology of pulmonary arterial hypertension. In: Eur. Respir. J. Band 20, Nr. 6, Dezember 2002, S. 1559–1572, PMID 12503718.
- J. M. Esteve, J. M. Launay, O. Kellermann, L. Maroteaux: Functions of serotonin in hypoxic pulmonary vascular remodeling. In: Cell Biochem. Biophys. Band 47, Nr. 1, 2007, S. 33–44, PMID 17406058.
- E. Hamel: Serotonin and migraine: biology and clinical implications. In: Cephalalgia. Band 27, Nr. 11, November 2007, S. 1293–1300, doi:10.1111/j.1468-2982.2007.01476.x, PMID 17970989.
- A. J. Coppen: Biochemical aspects of depression. In: Int Psychiatry Clin. Band 6, Nr. 2, 1969, S. 53–81, PMID 5817856.
- I. P. Lapin, G. F. Oxenkrug: Intensification of the central serotoninergic processes as a possible determinant of the thymoleptic effect. In: Lancet. Band 1, Nr. 7586, Januar 1969, S. 132–136, PMID 4178247.
- S. J. Dencker, U. Malm, B. E. Roos, B. Werdinius: Acid monoamine metabolites of cerebrospinal fluid in mental depression and mania. In: J. Neurochem. Band 13, Nr. 12, Dezember 1966, S. 1545–1548, PMID 5962034.
- J. Mendels, A. Frazer, R. G. Fitzgerald, T. A. Ramsey, J. W. Stokes: Biogenic amine metabolites in cerebrospinal fluid of depressed and manic patients. In: Science. Band 175, Nr. 28, März 1972, S. 1380–1382, PMID 5059569.
- J. J. Mann: Role of the serotonergic system in the pathogenesis of major depression and suicidal behavior. In: Neuropsychopharmacology. Band 21, 2 Suppl, August 1999, S. 99S–105S, doi:10.1016/S0893-133X(99)00040-8, PMID 10432495.
- B. Shopsin, E. Friedman, S. Gershon: Parachlorophenylalanine reversal of tranylcypromine effects in depressed patients. In: Arch. Gen. Psychiatry. Band 33, Nr. 7, Juli 1976, S. 811–819, PMID 133650.
- J. R. Lacasse, J. Leo: Serotonin and depression: a disconnect between the advertisements and the scientific literature. In: PLoS Med. Band 2, Nr. 12, Dezember 2005, Artikel e392, doi:10.1371/journal.pmed.0020392, PMID 16268734, PMC 1277931 (freier Volltext).
- H. Y. Meltzer: Clinical studies on the mechanism of action of clozapine: the dopamine-serotonin hypothesis of schizophrenia. In: Psychopharmacology. 99 Suppl, 1989, S. S18–27, PMID 2682729 (englisch).
- G. Curzon: How reserpine and chlorpromazine act: the impact of key discoveries on the history of psychopharmacology. In: Trends Pharmacol. Sci. Band 11, Nr. 2, Februar 1990, S. 61–63, PMID 2180160.
- E. H. Turner, J. M. Loftis, A. D. Blackwell: Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan. In: Pharmacol. Ther. Band 109, Nr. 3, März 2006, S. 325–338, doi:10.1016/j.pharmthera.2005.06.004, PMID 16023217.
- H. E. Bays: Lorcaserin and adiposopathy: 5-HT2c agonism as a treatment for ‘sick fat’ and metabolic disease. In: Expert Rev Cardiovasc Ther. Band 7, Nr. 11, November 2009, S. 1429–1445, doi:10.1586/erc.09.123, PMID 19900026.
- G. Curzon, E. L. Gibson, A. O. Oluyomi: Appetite suppression by commonly used drugs depends on 5-HT receptors but not on 5-HT availability. In: Trends Pharmacol. Sci. Band 18, Nr. 1, Januar 1997, S. 21–25, PMID 9114726.
- P. A. van Zwieten, G. J. Blauw, P. van Brummelen: Pharmacological profile of antihypertensive drugs with serotonin receptor and alpha-adrenoceptor activity. In: Drugs. 40 Suppl 4, 1990, S. 1–8; discussion 28–30, PMID 1982649 (englisch).
- T. Nagatomo, M. Rashid, H. Abul Muntasir, T. Komiyama: Functions of 5-HT2A receptor and its antagonists in the cardiovascular system. In: Pharmacology & Therapeutics. Band 104, Nr. 1, Oktober 2004, S. 59–81, doi:10.1016/j.pharmthera.2004.08.005, PMID 15500909 (englisch).
- A. Billio, E. Morello, M. J. Clarke: Serotonin receptor antagonists for highly emetogenic chemotherapy in adults. In: Cochrane Database Syst Rev. Nr. 1, 2010, S. CD006272, doi:10.1002/14651858.CD006272.pub2, PMID 20091591.
- C. C. Apfel, P. Kranke, S. Piper u. a.: Übelkeit und Erbrechen in der postoperativen Phase. Experten- und evidenzbasierte Empfehlungen zu Prophylaxe und Therapie. In: Anaesthesist. Band 56, Nr. 11, November 2007, S. 1170–1180, doi:10.1007/s00101-007-1210-0, PMID 17726590.
- A. Rex, B. Bert, H. Fink: Pharmakologie der 5-HT3-Antagonisten. In: Pharm Unserer Zeit. Band 36, Nr. 5, 2007, S. 342–353, doi:10.1002/pauz.200700230, PMID 17722161.
- E. A. Mayer, S. Bradesi: Alosetron and irritable bowel syndrome. In: Expert Opin Pharmacother. Band 4, Nr. 11, November 2003, S. 2089–2098, doi:10.1517/14656566.4.11.2089, PMID 14596662.
- D. E. Nichols: Differences Between the Mechanism of Action of Mdma, Mbdb, and the Classic Hallucinogens. Identification of a New Therapeutic Class: Entactogens. In: Journal of Psychoactive Drugs. Band 18, Nr. 4, 1986, S. 305–313 (englisch; online auf scribd.com; doi:10.1080/02791072.1986.10472362).
- R. B. Rothman, M. H. Baumann: Therapeutic and adverse actions of serotonin transporter substrates. In: Pharm. Ther. Bd. 95, 2002, S. 73–88. PMID 12163129.
- D. E. Nichols: Hallucinogens. In: Pharmacology & therapeutics. Band 101, Nummer 2, Februar 2004, S. 131–181, doi:10.1016/j.pharmthera.2003.11.002. PMID 14761703 (Review).
- Thomas S. Ray, Olivier Jacques Manzoni: Psychedelics and the Human Receptorome. In: PLoS ONE. Band 5, 2010, S. e9019, doi:10.1371/journal.pone.0009019.
- A. Huxley, C. Palmer, M. Horowitz: Moksha: Writings on Psychedelics and the Visionary Experience (1931–1963). Stonehill, New York 1977, ISBN 0-88373-042-1, S. 107. (TO DR. HUMPHRY OSMOND [smith 744] )archive.org
- Homepage: Duden – psychedelisch, seltener psychodelisch – Rechtschreibung, Bedeutung, Definition, Herkunft. In: duden.de. Abgerufen am 28. Februar 2016.
- Albert Hofmann: LSD – mein Sorgenkind. Die Entdeckung der Wunderdroge. Stuttgart 1993, S. 55.
- C. S. Grob, A. L. Danforth, G. S. Chopra, M. Hagerty, C. R. McKay, A. L. Halberstadt, G. R. Greer: Pilot study of psilocybin treatment for anxiety in patients with advanced-stage cancer. In: Archives of general psychiatry. Band 68, Nummer 1, Januar 2011, S. 71–78, doi:10.1001/archgenpsychiatry.2010.116. PMID 20819978.
- K. W. Tupper, E. Wood, R. Yensen, M. W. Johnson: Psychedelic medicine: a re-emerging therapeutic paradigm. In: CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne. Band 187, Nummer 14, Oktober 2015, S. 1054–1059, doi:10.1503/cmaj.141124. PMID 26350908, PMC 4592297 (freier Volltext) (Review)
- Therapeutic advances in psychopharmacology. Band 4, Nummer 4, August 2014, S. 156–169, doi:10.1177/2045125314527985. PMID 25083275, PMC 4104707 (freier Volltext) (Review).
Literatur
- Kurt Heinrich (Mediziner), Hanns Hippius und Walter Pöldinger als (Hrsg.) und Autoren: Serotonin — ein funktioneller Ansatz für die psychiatrische Diagnose und Therapie?, Verlag Springer, Berlin, Heidelberg 1991, ISBN 978-3-642-77192-7.
- Julie G. Hensler: Basic neurochemistry: molecular, cellular and medical aspects. Hrsg.: George J. Siegel, R. Wayne Albers, Brady Scott, Donald D. Price. Elsevier Academic, Amsterdam 2006, ISBN 0-12-088397-X, Serotonin, S. 227–248.
- Elaine Sanders-Bush, Steven E. Mayer: Goodman & Gilman’s The pharmacological basis of therapeutics. Hrsg.: Joel G. Hardman, Lee E. Limbird, Alfred Goodman Gilman. 10. Auflage. McGraw-Hill, 2001, ISBN 0-07-135469-7, 5-Hydroxytryptamine (serotonin): Receptor agonists and antagonists, S. 269–290.
- Merton Sandler (Hrsg.): 5-Hydroxytryptamine in Psychiatry: a spectrum of ideas, [contains papers from the Collegium International Neuropsychopharmacologicum workshop, held Jan. 7 - 10, 1990, in San Juan, Puerto Rico], Oxford University Press, Oxford, New York, Tokyo 1991, ISBN 0-19-262011-8.
- Paul M. Vanhoutte, P.R. Saxena, Rodolfo Paoletti, Nicoletta Brunello: Serotonin: from cell biology to pharmacology and therapeutics. Kluwer Academic Publishers, Boston 1993, ISBN 0-7923-2518-4.
Weblinks
- Birgit Hertwig: Serotonin. In: Laborjournal Ausgabe 12. 22. Dezember 2009, abgerufen am 18. September 2018.
- Die Biochemie der Angst. In: taz – die tageszeitung vom 23. Mai 2008. Informativer Artikel zu neuer Studie, abgerufen am 25. März 2012.

