Effusion (Physik)
Als Effusion (von lat. Effusio, Ausgießung) wird in der physikalischen Chemie die Diffusion einzelner Atome oder Moleküle eines Gases (seltener einer Flüssigkeit) durch einen Feststoff bezeichnet, wenn diese sich dabei durch Öffnungen des Molekulargitters (siehe auch Kristallgitter) bewegen, die kleiner sind als die mittlere freie Weglänge (siehe auch brownsche Molekularbewegung) des effundierenden Moleküls.[1]
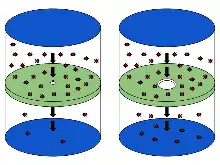
Das größere Loch auf der rechten Seite erlaubt dagegen die Diffusion, d. h. den gleichzeitigen Durchtritt mehrerer Moleküle in beiden Richtungen.
Sind die Öffnungen größer als die mittlere freie Weglänge, liegt eine gewöhnliche Undichtigkeit vor, durch welche sich Gase und Flüssigkeiten diffusiv verteilen und vermischen.
Wie bei der Diffusion und der Osmose (durch eine semipermeable Membran) folgt der Partikelstrom einer gegebenenfalls vorliegenden Potentialdifferenz (z. B. ein Druck- bzw. Konzentrationsgefälle).
Die Effusionsgeschwindigkeit eines bestimmten Gases hängt neben Temperatur, Lochgröße und gegebenenfalls vorliegenden Druckdifferenzen in erster Linie von der Molekülmasse des Gases ab. Mittels eines definierten Versuchsaufbaus kann somit die Molekülmasse unbekannter Stoffe bestimmt werden, um dann mittels Verbrennungsanalyse herauszufinden, welche chemische Summenformel die Substanz hat. Heute verwendet man stattdessen die viel genauere Massenspektrometrie, die mit minimalen Stoffmengen auskommt.
Bekannte Beispiele
- Aus der Luftschifffahrt ist bekannt, dass wasserstoffgefüllte Auftriebskörper ihre Gasfüllung allmählich verlieren. Für Heliumgas gibt es unter Normalbedingungen gar keine effusionssicheren Gefäße.
- Manche aromatische Kohlenwasserstoffe in Kraftstoffen, wie Benzin, Diesel, Kerosin, effundieren durch bestimmte Kunststoffe. Der Übergang aus Tanks oder Kanistern in die Luft, führte zur Intoxikation von Autofahrern, die ihrer Wirkung zu lange ausgesetzt waren, und was auch die Explosionsgefahr in der Nähe ungeeigneter Gefäße gefährlich erhöht.
- Bei der im Ultrahochvakuum (UHV) stattfindenden Molekularstrahlepitaxie (MBE) dienen Effusionszellen zur Bereitstellung des Materialflusses. Sie enthalten eine Schmelze, die bis über 1.000 Grad (z. B. Gallium bei GaAs-MBE) erhitzt wird. Der Partialdruck und damit der Materialfluss sind eine Funktion der Temperatur. Die Tiegel, die aus einem hochschmelzenden Material (z. B. Bornitrid) bestehen müssen, werden elektrisch beheizt und haben eine Austrittsöffnung.
- Bei der Anreicherung von Uran für die Kernspaltung kann gasförmiges Uranhexafluorid (UF6) durch Membranen getrieben werden. Da das leichtere 235UF6 minimal schneller effundiert als das 238UF6, lässt sich das leichtere Nuklid anreichern. Diese Technik wurde während des Manhattan Project in Oak Ridge angewendet; die benötigte Anlage (Codename K-25) belegte eine Fläche von 17 Hektar.
Gesetzmäßigkeiten
Das von Thomas Graham noch ohne Kenntnis von atomaren oder molekularen Strukturen und Zusammenhängen gefundene und 1833 veröffentlichte Grahamsche Gesetz sagt, dass die Ausflussgeschwindigkeiten unterschiedlicher Gase bei gleichem Druck den Quadratwurzeln aus ihren Dichten umgekehrt proportional sind.[2] Es gilt recht genau auch für die Effusion von Flüssigkeiten und Gasen, da die Dichte eine Funktion der Molekularmasse ist und diese eine gute Annäherung an den (durchschnittlichen) Moleküldurchmesser darstellt. Zudem gehorchen in der Phase des Durchgangs durch die Wand selbst Nicht-Gase und Stoffe geringster Viskosität den Gasgesetzen, weil – und solange sie sich in diesem Bereich als isolierte Atome oder Moleküle bewegen – diese im Wesentlichen ohne Nachbarn sind.
Gemäß dem Grahamschen Gesetz ergibt sich eine einfache Beziehung zwischen den Effusionsgeschwindigkeiten zweier Stoffe bei ansonsten gleichen Bedingungen:
- Rate1: Effusionsrate des Gases 1
- Rate2: Effusionsrate des Gases 2
- M1: molare Masse von Gas 1
- M2: molare Masse von Gas 2
Die Effusionsrate eines Gases berechnet sich zu[3]:
- Rate: Effusionsrate des Gases
- p: Druck
- A0: Fläche des Lochs, durch das die Effusion stattfindet
- NA: Avogadro-Konstante
- M: molare Masse
- R: universelle Gaskonstante
- T: Temperatur
In der Nähe des absoluten Nullpunkts der Temperatur herrschen besondere Bedingungen, die die Effusion u. a. durch das Fehlen thermischer Molekularbewegungen erheblich erleichtern.
Die von Evangelista Torricelli um 1644 beschriebene hydrodynamische Regel, Torricellis Theorem oder auch der Torricellische Lehrsatz genannt, beschreibt in ihrer ursprünglichen Fassung die Effusion – um die es ihm auch nicht ging – nicht korrekt, spätere Fassungen jedoch, die 'sehr dicke Wände' und 'kleine Auslassöffnungen' usw. berücksichtigen, kommen ihr relativ nahe.
Siehe hierzu auch: Ausflussgeschwindigkeit
Einzelnachweise
- K.J. Laidler und J.H. Meiser: Physical Chemistry. Hrsg.: Benjamin/Cummings. 1982, ISBN 0-8053-5682-7.
- Steven S. Zumdahl: Chemical Principles. Houghton Mifflin Harcourt Publishing Company, Boston 2008, ISBN 978-0-547-19626-8, S. 164.
- Peter Atkins: Physical Chemistry. 6. Auflage. Oxford University Press, 1998, ISBN 0-19-850101-3