Schrägbeziehung im Periodensystem
Schrägbeziehung im Periodensystem nennt man die Ähnlichkeit der Eigenschaften mehrerer Elemente, wobei die betreffenden Elemente im Periodensystem der Elemente jeweils schräg untereinander stehen. Diese Beziehung betrifft jeweils zwei Elemente der zweiten und dritten Periode. Dies sind insbesondere Lithium und Magnesium, Beryllium und Aluminium, sowie Bor und Silicium. Auch zwischen Kohlenstoff und Phosphor lassen sich einige Ähnlichkeiten feststellen, weswegen Phosphor auch als anorganischer Kohlenstoff bezeichnet wird. Außerdem gibt es auch Analogien zwischen Stickstoff und Schwefel sowie zwischen Sauerstoff und Chlor.
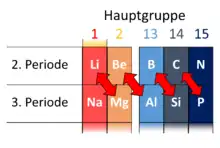
Die Ähnlichkeiten zeigen sich vorwiegend bei den Arten und Eigenschaften der gebildeten Verbindungen eines Elements. So bilden sowohl Magnesium als auch Lithium eine große Zahl metallorganischer Verbindungen mit kovalenten Bindungen, die viele ähnliche Eigenschaften besitzen. Im Vergleich dazu bildet Natrium, das direkt unter dem Lithium stehende Element, stark ionisch aufgebaute metallorganische Verbindungen.
Stärker als bei Lithium und Magnesium sind die Ähnlichkeiten zwischen Beryllium und Aluminium. Die Verbindungen dieser beiden Elemente zu vielen Nichtmetallen, so die Wasserstoffverbindungen, Oxide und Chloride, haben sehr ähnliche Eigenschaften. So sind beide Wasserstoffverbindungen kovalent und polymer aufgebaut. Magnesiumhydrid ist im Vergleich dazu ionisch.
Die Ähnlichkeiten des Phosphors zum Kohlenstoff werden z. B. in der Tendenz zu Mehrfachbindungen und aromatischen Ringen deutlich. Ein isolobales Ion zum Cyclopentadienyl-Anion ist das P5−-Ion. Vom Silicium sind solche Verbindungen noch nicht bekannt.
Der Grund für diese Ähnlichkeiten liegt in der ähnlichen Größe des Verhältnisses von Ionenradius und positiver Ladung des Atomkerns. Durch die Besetzung einer weiteren Elektronenschale kommt es zu einer Vergrößerung des Atomradius, die jedoch durch die Erhöhung der Kernladung (welche zur Erhöhung der effektiven Kernladung führt, durch die die Elektronen stärker vom Atomkern angezogen werden) um den Wert 1 gerade ausgeglichen wird.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 312.
Weblinks
- Der Begriff der Schrägbeziehung auf „Das Periodensystem der Elemente online“