Circadiane Rhythmik
Als circadiane Rhythmik (auch: circadianer Rhythmus) bezeichnet man in der Chronobiologie zusammenfassend die endogenen (inneren) Rhythmen, die eine Periodenlänge von circa 24 Stunden und bei vielen Lebewesen großen Einfluss auf die Funktionen des Organismus haben. Sie entstanden als Anpassung an die sich im Tagesrhythmus ändernden Umweltbedingungen.
Die offensichtlichste Folge bei vielen Tierarten und beim Menschen ist der Schlaf-Wach-Rhythmus. Allerdings weisen neben der Aktivität noch viele weitere physiologische Parameter eine Rhythmizität mit 24-stündiger Periode auf. Die circadiane Rhythmik lässt sich auch auf der Ebene einzelner Zellen nachweisen. Der Nobelpreis für Medizin/Physiologie wurde im Jahr 2017 an drei Chronobiologen verliehen, die bei Untersuchungen der Fruchtfliege Drosophila melanogaster molekulare Mechanismen der circadianen Rhythmik entschlüsseln konnten.[1]
Es gibt auch biologische Rhythmen, deren Periode deutlich kürzer oder länger als ein Tag ist (siehe ultradiane Rhythmik bzw. infradiane Rhythmik).
Terminologie
Das Adjektiv circadian – oder mit eingedeutschter Schreibweise zirkadian – kann als „rings um den Tag“ (lateinisch circa „um …herum“, dies „Tag“) verstanden werden.[2] Franz Halberg, der die Bezeichnung im Jahr 1959 einführte,[3] verband mit circa vor allem die Bedeutung „ungefähr“, so dass circadian in seinem Sinne mit „ungefähr einen Tag lang“ zu übersetzen wäre.[4]
Halberg gab später die Auskunft, er sei auf das Wort circadian schon vor 1951 aufmerksam geworden, als sein Freund Henry Nash Smith es verwendete. In den 1950er Jahren suchte Halberg nach einer Alternative für das zweideutige Wort diurnal, das einerseits „bei Tageslicht“ und andererseits „24-stündig“ bedeuten kann. Außerdem wollte Halberg „24-stündig“ und „ungefähr 24-stündig“ unterscheiden können, da Tagesrhythmen in Organismen nur ungefähr eine Periodenlänge von 24 Stunden haben, insbesondere wenn sie nicht vom Tageslicht synchronisiert werden. Im Jahr 1955 schlug er zunächst die Wortschöpfungen diel für „24 Stunden lang“ und dieloid für „ungefähr 24 Stunden lang“ vor, die allerdings keinen Anklang fanden. Im Jahr 1959 verwendete Halberg die Bezeichnungen dian für „24 Stunden lang“ und circadian für „ungefähr 24 Stunden lang“. Kritische Kollegen wandten daraufhin ein, dass das Nebeneinander der zwei Bezeichnungen verwirrend sei. So verzichtete Halberg auf dian – und die Bezeichnung circadian setzte sich durch.[4]
Umgangssprachlich wird die Gesamtheit circadianer Rhythmen auch als die „innere Uhr“ bezeichnet.
Grundlagen
Funktion
Aufgrund der Rotation der Erde um ihre eigene Achse verändern sich Umweltbedingungen wie die Menge an Licht, die Temperatur sowie die Verfügbarkeit von Nahrung und die Bedrohung durch Fressfeinde rhythmisch mit einer Periode von 24 Stunden. Wenn Lebewesen sich auf solche tiefgreifenden Veränderungen einstellen, haben sie einen Überlebensvorteil.[5]
Auch auf zellulärer Ebene unterliegen unzählige chemische Reaktionen einer circadianen Rhythmik. Die innere Uhr dient bei mehrzelligen Organismen dazu, die in praktisch jeder Zelle vorhandenen Uhren miteinander zu synchronisieren, um wichtigen Funktionen des Gesamtorganismus einen zeitlichen Rahmen zu geben. Man geht davon aus, dass alle Eukaryoten circadiane Rhythmen in praktisch jeder ihrer Zellen aufweisen. Insbesondere müssen unkompatible chemische Reaktionen zeitlich voneinander getrennt werden.
In einer Studie an Mäusen konnte gezeigt werden, dass 43 % aller für Proteine kodierenden Gene im Mäuseorganismus mit einem Rhythmus von 24 Stunden transkribiert werden.[6] Auch Insekten sind auf eine funktionierende circadiane Uhr angewiesen. So passt eine Biene, die ihren Artgenossinnen mittels Schwänzeltanz Informationen über Futterquellen mitteilt, den Winkel etwa alle 5 Minuten an, weil sich die Sonne, welche als Orientierungspunkt für die Ortsangabe dient, in der Zwischenzeit weiterbewegt hat.[7] Auch für die Organisation des Sozialwesens des Bienenstocks sind circadiane Rhythmen und deren interindividuelle Synchronisation von großer Bedeutung.[8]
Pflanzen passen ihre Aktivität an den Tag-Nacht-Wechsel an. Noch vor Sonnenaufgang aktivieren sie ihren Photosyntheseapparat und bereiten sich damit auf den Beginn der Photosynthese vor, die bei Tageslicht stattfindet. Viele Pflanzen öffnen und schließen ihre Blüten und Spaltöffnungen zu bestimmten Tageszeiten (siehe die Blumenuhr von Linné). Andere Pflanzen, deren Blüten mehrere Tage hintereinander geöffnet sind, produzieren Duftstoffe und Nektar nur zu bestimmten Uhrzeiten. Bestäubende Insekten wie die Bienen stellen ihre Besuche darauf ein.
Auch im Reich der Pilze haben sich circadiane Rhythmen als Anpassung als eine sich regelmäßig ändernde Umwelt herausgebildet. So unterliegt etwa die Fortpflanzung des Pilzes Neurospora crassa der Steuerung einer inneren Uhr.[9]
Der einfachste Organismus, in dem eine circadiane Uhr nachgewiesen werden konnte, ist Synechococcus elongatus aus der Gattung Synechococcus der Cyanobakterien.[10] Wie verbreitet circadiane Uhren in anderen Prokaryoten sind, ist noch weitgehend offen.
Eigenschaften der circadianen Rhythmik
Obwohl der biologische Hintergrund und die Mechanismen für circadiane Rhythmen zwischen verschiedenen Organismen unterschiedlich sind, haben die circadianen Rhythmen bestimmte Eigenschaften, die vielen Arten gemeinsam sind. Die genaue Periodenlänge kann zwischen verschiedenen Arten variieren, beträgt aber meist 22 bis 25 Stunden. Der innere Rhythmus benötigt keine Signale von der Außenwelt, um seinem Rhythmus zu folgen, der jedoch nicht immer genau 24 Stunden lang ist. Der Prozess kann sich jedoch einem genauen 24-Stunden-Zyklus anpassen, indem er sich mit Hilfe von äußeren Reizen, den sogenannten Zeitgebern, korrigiert. Diesen Prozess nennt man Synchronisation bzw. Entrainment. Die externen Reize, die als Zeitgeber dienen können, sind für verschiedene Arten unterschiedlich, aber der wichtigste ist oftmals das Licht.[11] Weitere Zeitgeber sind bei einigen Arten beispielsweise die Umgebungstemperatur[12] und soziale Reize (z. B. der Wecker).
Merkmale echter biologischer Uhren sind:[13]
- ihr endogener Charakter, das heißt, dass der Rhythmus auch unter konstanten Umweltbedingungen aufrechterhalten wird (Freilauf).
- die Tatsache, dass sie „entrainbar“ sind, was heißt, dass sie trotz ihrer eigenen Rhythmizität ihre Periode in gewissen Grenzen an die Rhythmizität der Umgebungsbedingungen anpassen können (Fähigkeit zum Entrainment).
- die relative Unempfindlichkeit gegenüber nichtrhythmischen Temperaturveränderungen (Temperaturkompensiertheit), was insofern ungewöhnlich ist, als fast alle anderen (bio)chemischen Reaktionen in ihrer Geschwindigkeit sehr stark von der Temperatur abhängen. Man geht bei gewöhnlichen chemischen Reaktionen von einer Verdopplung der Reaktionsgeschwindigkeit pro 10 °C Temperaturerhöhung aus (RGT-Regel).
Periodenlänge (τ)
Ein circadianer Rhythmus ist durch eine bestimmte Periodenlänge gekennzeichnet, das heißt, dass jede Wiederholung eine gewisse Zeit dauert. Die Periodenlänge wird oft mit dem griechischen Buchstaben Tau (τ) bezeichnet und dauert für die meisten Organismen rund 24 Stunden. Wenn ein Organismus in einer konstanten Umwelt gehalten wird, das heißt mit einer konstanten Lichtmenge und Temperatur rund um die Uhr, so wird er einem Tageszyklus folgen, dessen Länge von seiner inneren Uhr abhängt. Im Laufe der Zeit kann die innere Uhr mehr und mehr vom Verlauf der wahren Zeit abweichen.
Die Periodenlänge der inneren Uhr hängt von der genetischen Ausstattung ab, und es ist möglich, Organismen zu züchten, die eine interne Uhr mit längerer oder kürzerer Periodenlänge haben. Man kann auch das τ eines Organismus mit Drogen oder Hormonen manipulieren oder durch Manipulation der Umwelt des Organismus verändern.[14] Das Alter des Organismus beeinflusst ebenfalls die Periodenlänge der inneren Uhr. In einigen Organismen, wie dem Menschen, nimmt τ mit zunehmendem Alter ab,[15][16] während τ in anderen Organismen, z. B. Mäusen, mit dem Alter zunimmt.[17] Es ist auch möglich, τ durch artifizielles Licht zu verändern. Schaben, die in einem 22-Stunden-Zyklus exponiert werden, entwickelten eine kürzere Periodenlänge als Schaben, die in einem 26-Stunden-Zyklus exponiert wurden. Diese Effekte bestehen lange fort, auch nachdem das Experiment beendet ist.[18][19]
Phase (Φ) und Phasenwinkel (ψ)
Der Zeitpunkt gemäß der inneren Uhr, wenn der Organismus „erwartet“, dass ein bestimmtes Ereignis stattfinden wird (z. B. Sonnenaufgang oder Sonnenuntergang), wird Phase genannt. Die Phase wird mit dem griechischen Symbol Phi (Φ) bezeichnet.
Ein Beispiel dafür, dass sich die subjektive (circadiane) Zeit der inneren Uhr und die objektive Zeit unterscheiden können, ist der Jetlag. Der Unterschied zwischen circadianer und objektiver Zeit wird mit dem griechischen Buchstaben Psi (ψ) bezeichnet. Er kann entweder in Stunden oder als Phasenwinkel, das heißt als Gradmaß, ausgedrückt werden. Ein Phasenwinkel von 180° entspricht einer Differenz von 12 Stunden.
Phasenverschiebung
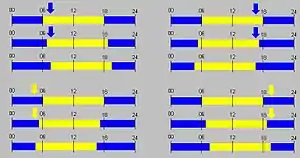
Phasen der inneren Uhr:
Blau: Die innere Uhr ist auf „Nacht“ eingestellt.
Gelb: Die innere Uhr ist auf „Tag“ eingestellt.
Einwirkung des Zeitgebers Dunkelheit/Licht:
Blauer Pfeil: Dunkelheit signalisiert „Nacht“.
Gelber Pfeil: Licht signalisiert „Tag“.
Oben links: Um 6 Uhr rechnet die innere Uhr schon mit Tag (gelbe Strecke), es ist aber um 7 Uhr noch dunkel (blauer Pfeil). Der Organismus passt sich an und erwartet dann einen späteren Tagesanbruch.
Oben rechts: Die innere Uhr erwartet erst um 18 Uhr Nacht, es ist aber schon um 17 Uhr dunkel. Der Organismus passt sich an und erwartet dann die Nacht früher.
Unten links: Um 5 Uhr ist die innere Uhr noch auf Nacht eingestellt, es ist aber schon hell.
Unten rechts: Um 19 Uhr ist die innere Uhr schon auf Nacht eingestellt, es ist aber noch hell.
Da die Periodenlänge der inneren Uhr nicht genau 24 Stunden beträgt und der Zeitpunkt für Sonnenaufgang und Sonnenuntergang im Laufe des Jahres variiert, muss die innere Uhr sich mit Hilfe externer Zeitgebersignale korrigieren können.
Bei den Phasenverschiebungen der inneren Uhr unterscheidet man zwei Typen:
- Die schwache Phasenverschiebung (Typ-1-Reaktion): Die Reaktion auf einen Zeitgeber ist relativ klein, höchstens wenige Stunden. Die Abbildung rechts veranschaulicht Typ-1-Reaktionen mit einer Phasenverschiebung um jeweils eine Stunde.
- Die starke Phasenverschiebung (Typ-0-Reaktion): Irgendwo in dem Zyklus gibt es einen bestimmten Punkt, an dem ein Zeitgeber die innere Uhr um bis zu 12 Stunden nach vorne oder zurück verschieben kann.
Ob ein Organismus eine Typ-1-Reaktion oder eine Typ-0-Reaktion zeigt, hängt von der Art des Organismus und der Intensität des Stimulus ab. Wenn der Stimulus intensiv ist, kann ein Organismus, der normalerweise eine schwache Typ-1-Reaktion zeigt, mit einer starken Typ-0-Reaktion antworten.[21] Eine Studie hat gezeigt, dass Menschen, die drei Tage hintereinander am Morgen starkem Licht ausgesetzt wurden, mit einer starken Phasenverschiebung reagieren können.[22]
Synchronisation
Licht als Zeitgeber
Da die äußere Ursache der circadianen Rhythmik die Eigenrotation unseres Planeten ist, fungiert als augenfälligster äußerer Rhythmusgeber der Wechsel der Beleuchtungsintensität der Erde. Dieser Schrittmacher wird im visuellen System erkannt, teilweise auch der sich ändernde Sonnenstand.
Licht ist vermutlich der Zeitgeber, dessen Wirkung am universellsten ist. Beim Menschen führt Licht am subjektiven Abend und in der subjektiven Nacht zu einer Verlangsamung der Periode der inneren Uhr, während Licht in den frühen Morgenstunden eine Beschleunigung derselben verursacht.[23] Licht fungiert als Zeitgeber in nahezu allen untersuchten Organismen, einschließlich solcher, die in ständiger Dunkelheit leben.[24] Der Organismus reagiert auf Licht in der Umgebung mit einem lichtempfindlichen Pigment, die es entweder in der Netzhaut (bei Wirbeltieren) oder in anderen Zellen (bei Insekten und Pflanzen) gibt.
Synchronisation bei Tieren
Das Weiterbestehen eines frei laufenden circadianen Rhythmus unter konstanten Bedingungen zeigt, dass es einen Oszillator, eine Rhythmus generierende innere Einheit geben muss. Solange nicht bekannt ist, wie dieser Oszillator arbeitet, kann man nur an dem wahrgenommenen Rhythmus Messungen ausführen, unter möglichst weitgehender Ausschaltung äußerer Rhythmusgeber. Eigenschaften des Oszillators müssen dann aus dem Verhalten abgeleitet werden: die klassische „Black Box“-Methode der Verhaltensforschung. Für etliche Tiergruppen konnten inzwischen zumindest Teile der Black Box im Zentralnervensystem (ZNS) lokalisiert werden.
Der zentrale Schrittmacher kann durch externe Effekte beeinflusst werden, insbesondere durch Licht. Bei allen untersuchten Organismen scheint Cryptochrom eine entscheidende Rolle für die Nachjustierung der inneren Uhr zu spielen:
- Insekten: im Lobus opticus
- Weichtiere: an der Basis der Retina
- Wirbeltiere: im über der Kreuzung der Sehnerven gelegenen Nucleus suprachiasmaticus (SCN) und/oder in der Zirbeldrüse (auch Epiphyse genannt). Die Epiphyse produziert das für Schlaf-Wach-Rhythmen wichtige Hormon Melatonin.
Bei Fischen, Amphibien, Reptilien und vielen Vögeln ist die Epiphyse dagegen noch lichtempfindlich. Bei einigen Amphibien wird ein sogenanntes Scheitelauge beobachtet: eine Schädelöffnung, die nur von Hirnhaut und Haut bedeckt ist und so Licht ins Hirn durchlässt („drittes Auge“). Bei Reptilien und einigen Vögeln steuert die Epiphyse außer der circadianen Melatoninproduktion auch noch andere circadiane Rhythmen, beispielsweise bei der Körpertemperatur und der Nahrungsaufnahme. Sie ist entwicklungsgeschichtlich älter als der Nucleus suprachiasmaticus (SCN).
Molekularbiologie bei Säugetieren
Bei Säugetieren findet sich der zentrale circadiane Schrittmacher im Nucleus suprachiasmaticus des Hypothalamus, der weitere periphere Schrittmacher koordiniert. Die molekulare Uhr läuft durch eine Transkriptions-Translations-Rückkopplung, indem die Proteintranslation die Transkription des Genes dieses Proteins hemmt. Beteiligt sind mehrere Proteine, von denen CLOCK, BMAL1, PER, CRY und NPAS2 als Schlüsselproteine gelten. Die circadiane molekulare Uhr (CMC = circadian molecular clock) hat dabei einen positiven Arm mit einem CLOCK-BMAL1-Heterodimer, das den negativen Arm mit einem PER-CRY-Heterodimer stimuliert, welches den positiven Arm hemmt. Eine Rückkopplungs-Sequenz dauert etwa 24 Stunden, wobei eine Oszillation der Proteinexpression besteht. Diese wird für die beiden Proteine BMAL1 und CLOCK durch zwei Zellkern-Rezeptoren (REV-ERB-α und REV-ERB-β) gesteuert und hierdurch die circadiane Rhythmik moduliert. Periphere Gewebe verfügen über einen ähnlichen Zyklus, werden aber vom zentralen Schrittmacher durch indirekte neuronale und hormonelle Signale sowie Temperaturveränderungen synchronisiert.[25]
Die synthetisch entwickelten Agonisten SR9009 und SR9011 der Zellkernrezeptoren REV-ERB-α und REV-ERB-β können durch Hemmung der BMAL1-Expression die Stärke der circadianen Oszillationen reduzieren. Bei Mäusen führte die Injektion der Agonisten zu einem erhöhten basalen Sauerstoffbedarf und einem Verlust an Fettgewebe. Weiterhin zeigte sich eine verminderte Lipogenese in der Leber, eine vermehrte Glucose- und Lipid-Oxidation in Muskelzellen und eine verminderte Triglycerid-Synthese und -Speicherung in weißen Fettzellen.[26]
Lichtempfindlichkeit bei Pflanzen
_plus_1_Jahr.jpg.webp)
Pflanzen haben neben Chlorophyll drei weitere Klassen von lichtempfindlichen Pigmenten:
- Phytochrome sind vor allem für rotes Licht empfindlich,[27] in geringerem Umfang auch für blaues Licht.[28]
- Cryptochrome sind vor allem für blaues Licht empfindlich. Sie werden außerdem als Signal-Moleküle gebraucht, wenn die Phytochrome Licht „fangen“.[29]
- Phototropine sind nicht an der Regulierung des Tagesrhythmus beteiligt. Sie steuern den Phototropismus der Pflanzen, das heißt, dass die Pflanze auf eine Lichtquelle zuwächst.
Die Pflanze regelt ihre Empfindlichkeit für Licht durch die Produktion von Phytochromen und Cryptochromen, verstärkt am Morgen. Während dieser Zeit ist die Pflanze am empfindlichsten für Licht.[30]
Circadiane Rhythmik beim Menschen
Die circadiane Rhythmik steuert oder beeinflusst bei Menschen unter anderem den Schlaf-Wach-Rhythmus, die Herzfrequenz, den Blutdruck, die Körpertemperatur, den Hormonspiegel (z. B. Cortison und Insulin), die Konzentration von Immunzellen im Blut und deren Einwanderung in andere Gewebe.[31] Die Gluconeogenese, die Fettresorption im Darm und viele weitere Stoffwechselfunktionen[32] werden von der circadianen Uhr beeinflusst, ebenso die kognitive Leistungsfähigkeit.[33]
Chronotypen
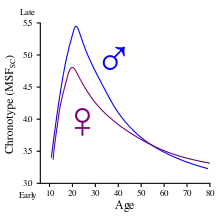
Zwischen verschiedenen Individuen gibt es gewisse Unterschiede in der Phase der inneren Uhren relativ zur Außenwelt, was sich in unterschiedlichen Chronotypen äußert. Dies wird als der Grund angesehen, wieso manche Menschen früh schlafen gehen und früh wieder aufwachen („Lerchen“), andere hingegen spät schlafen gehen und spät aufwachen („Eulen“).[34] In einem mittleren Alter (ungefähr von 15 bis 50 Jahren) zeigen sich diesbezüglich größere Unterschiede zwischen den Geschlechtern.
Die Unterschiede im Chronotyp kommen höchstwahrscheinlich durch genetische Prädisposition zustande. Als Ursache wird eine unterschiedliche Ausprägung des Gens PER2 diskutiert.[35] Durch Fragebögen wie etwa den MCTQ lässt sich der Chronotyp eines Menschen recht präzise bestimmen.[36]
Auch innerhalb eines Individuums kommt es im Laufe des Lebens zu Veränderungen, die sich anhand des durchschnittlichen Schlaf- und Aufwachzeitpunkts festmachen lassen. So sind Kinder in aller Regel recht frühe Chronotypen, werden dann im Laufe der Teenagerjahre immer später, bis sich der Trend etwa ab dem 20. Lebensjahr wieder umkehrt.[37]
Bei Untersuchungen an Jugendlichen, von denen während der Pubertät die meisten als „Eulen“ charakterisiert werden können, konnte nachgewiesen werden, dass ein um eine Stunde verzögerter Beginn der Tagesaktivitäten – besonders im Winter – zu allgemeiner Leistungsverbesserung und besserem Gesundheitszustand führte.[38] Diese und weitere wissenschaftliche Erkenntnisse haben wichtige Implikationen für die optimale Uhrzeit des Schulanfangs.
Bei Kleinkindern und alten Menschen ist der individuelle Chronotyp weniger deutlich, weil der circadiane Rhythmus noch nicht eindeutig dominiert beziehungsweise nicht mehr so stark wirkt. Bei Babys überwiegt noch das ultradiane System – kurze Aktivitätsphasen wechseln mit kurzen Schlafphasen von zum Teil nicht einmal einer halben Stunde ab. Erst die Rhythmik des Kleinkindes wird zunehmend vom circadianen System gesteuert. Im Greisenalter verliert es wieder an Einfluss.
Störungen des Schlaf-Wach-Rhythmus
Menschen leben häufig im Gegensatz zu ihrem inneren Rhythmus oder stören diesen zumindest. So nimmt der Anteil an Schichtarbeit zu. Zusätzlich wird weniger Zeit im Tageslicht verbracht, insbesondere im Winter, wo die Lichteinstrahlung in Innenräumen selten höher als 500 Lux liegt. Selbst ein bedeckter Himmel im Freien kann über 20.000 Lux Horizontalbeleuchtungsstärke erzeugen, direkte Sonneneinstrahlung sogar bis zu 100.000 Lux. Andererseits wird der Mensch auch nachts künstlichen Lichtreizen ausgesetzt. Die innere Uhr, die täglich einer neuen „Justierung“ bedarf, hat durch diese „verwaschene“ Zeitgeberstruktur mit Problemen zu kämpfen. Bei modernen Wechselschichtplänen arbeitet man mit „eingestreuten Nachtschichten“, also kurzen Nachtschichtblöcken, die idealerweise nur ein bis zwei, maximal jedoch drei Nächte umfassen.
Beim Wechsel in andere Zeitzonen passt sich der eigene Circadianrhythmus erst nach einer Umgewöhnungszeit der Zeitzone an. Diese Anpassung erfolgt deutlich langsamer als die Flugreise und kann sich durch den sogenannten Jetlag in Müdigkeit und Leistungsschwäche bemerkbar machen.
In sehr äquatorfernen Regionen (wie zum Beispiel Norwegen) kann der Schlaf-Wach-Rhythmus dadurch gestört werden, dass im Winter die Lichtausbeute pro Tag gegen null geht. Der Tageslichtmangel und der gestörte Tagesablauf können zu einer sogenannten Winterdepression führen. Inzwischen ist die Lichttherapie als wirksame Behandlung der Winterdepression anerkannt („Lichtduschen“ werden als helle Lampen vorne an speziellen Kopfbedeckungen angebracht).
Zusammenhang mit Krankheiten
Die innere Uhr beeinflusst den Verlauf von kardiovaskulären Erkrankungen wie Atherosklerose.[39] Weiter zeigt sich sowohl durch epidemiologische Untersuchungen[40] als auch durch experimentelle Arbeiten, dass circadiane Rhythmen einen Einfluss auf die Entstehung bzw. Prävention von Krebserkrankungen haben.[41][42] Schichtarbeiter leiden durch die Störung des Tagesrhythmus unter metabolischem Stress – ein Risikofaktor unter anderem für die Entstehung von Diabetes mellitus und Übergewicht.[43]
Neurodegenerative Erkrankungen wie Alzheimer, Parkinson, ALS und Chorea Huntington gehen oft schon früh im Krankheitsverlauf mit Störungen circadianer Rhythmen einher.[44] Auch bei vielen psychiatrischen Erkrankungen ist der Schlaf-Wach Rhythmus gestört, und Störungen des circadianen Systems sind ein Risikofaktor für psychiatrische Erkrankungen.[45] Ein dauerhaft gestörter Schlaf-Wach-Rhythmus, etwa bei Schichtarbeit, kann zu Schlaf- und Essstörungen, Energielosigkeit und Depressionen führen.
Aus einer Studie an Mäusen ging hervor, dass mehr als die Hälfte der 100 meistverkauften Medikamente in den USA auf Proteine wirken, die (in Mäusen) einer circadianen Steuerung unterliegen.[6]
Siehe auch
Literatur
- Verständlich einführend
- Till Roenneberg: Wie wir ticken: Die Bedeutung der Chronobiologie für unser Leben. 2. Auflage. DuMont, Köln 2010, ISBN 978-3-8321-6188-0
- Weiterführende Publikationen
- Jürgen Aschoff (Hrsg.): Circadian Clocks. North Holland Press, Amsterdam 1965.
- Joseph S. Takahashi und Martin Zatz: Regulation of circadian rhythmicity. In: Science. Bd. 217, Nr. 4565, 1982, S. 1104–1111, doi:10.1126/science.6287576
- Jürgen Zulley, Barbara Knab: Unsere Innere Uhr. Herder, Freiburg im Breisgau 2003.
- Peter Spork: Das Uhrwerk der Natur. Chronobiologie – Leben mit der Zeit. Rowohlt, Reinbek bei Hamburg 2004.
- Wolfgang Deppert, K. Köther, B. Kralemann, C. Lattmann, N. Martens, J. Schaefer (Hrsg.): Selbstorganisierte Systemzeiten. Ein interdisziplinärer Diskurs zur Modellierung lebender Systeme auf der Grundlage interner Rhythmen. Band I der Reihe: Grundlagenprobleme unserer Zeit. Leipziger Universitätsverlag, Leipzig 2002.
Weblinks
- Krank ohne Rhythmus. Zeit Online, 14. Juli 2006
- Der frühe Vogel fängt nicht immer den Wurm. Bei jungen Leuten ist früh morgens eher der Wurm drin. Telepolis, 1. Januar 2005.
- Warum Eulen zu Rauchern werden. Chronischer chronobiologischer Jetlag erhöht den Drogenkonsum. Telepolis, 30. März 2006.
- Arbeitsgruppe Chronobiologie. Deutsche Gesellschaft für Schlafforschung und Schlafmedizin
- Fressfeinde und Pflanzenabwehr schwingen im gleichen Rhythmus. Auf: pflanzenforschung.de, 17. Februar 2012.
Einzelnachweise
- The 2017 Nobel Prize in Physiology or Medicine – Press Release. Abgerufen am 1. Februar 2018.
- Vgl. Zirkadian im DocCheck Flexikon. Dieselbe Angabe zur Wortbildung findet sich beim Stichwort zirkadian im Pschyrembel.
- F. Halberg, A. N. Stephens: Susceptibility to ouabain and physiologic circadian periodicity. In: Proc. Minn. Acad. Sci. Bd. 27, 1959, S. 139–143.
- F. Halberg, G. Cornélissen, G. Katinas, E. V. Syutkina, R. B. Sothern, R. Zaslavskaya, F. Halberg, Y. Watanabe, O. Schwartzkopff, K. Otsuka, R. Tarquini, P. Frederico, J. Siggelova: Transdisciplinary unifying implications of circadian findings in the 1950s. In: Journal of circadian rhythms. Bd. 1, Nummer 1, Oktober 2003, S. 2, doi:10.1186/1740-3391-1-2, PMID 14728726, PMC 317388 (freier Volltext): Siehe Abschnitt When and why did you create the term “circadian”?
- Y. Ouyang, C. R. Andersson, T. Kondo, S. S. Golden, C. H. Johnson: Resonating circadian clocks enhance fitness in cyanobacteria. In: PNAS. Band 95, Nr. 15, 21. Juli 1998, ISSN 0027-8424, S. 8660–8664, PMID 9671734.
- Ray Zhang, Nicholas F. Lahens, Heather I. Ballance, Michael E. Hughes, John B. Hogenesch: A circadian gene expression atlas in mammals: Implications for biology and medicine. In: Proceedings of the National Academy of Sciences. Band 111, Nr. 45, 11. November 2014, S. 16219–16224, doi:10.1073/pnas.1408886111 (pnas.org [abgerufen am 30. Januar 2018]).
- Guy Bloch: The social clock of the honeybee. In: Journal of Biological Rhythms. Band 25, Nr. 5, Oktober 2010, ISSN 1552-4531, S. 307–317, doi:10.1177/0748730410380149, PMID 20876811.
- Guy Bloch: The social clock of the honeybee. In: Journal of Biological Rhythms. Band 25, Nr. 5, Oktober 2010, ISSN 1552-4531, S. 307–317, doi:10.1177/0748730410380149, PMID 20876811.
- Martha Merrow, Till Roenneberg, Giuseppe Macino, Lisa Franchi: A fungus among us: the Neurospora crassa circadian system. In: Seminars in Cell & Developmental Biology. Band 12, Nr. 4, S. 279–285, doi:10.1006/scdb.2001.0255 (elsevier.com [abgerufen am 30. Januar 2018]).
- M. Ishiura, S. Kutsuna, S. Aoki, H. Iwasaki, C. R. Andersson: Expression of a gene cluster kaiABC as a circadian feedback process in cyanobacteria. In: Science (New York, N.Y.). Band 281, Nr. 5382, 4. September 1998, ISSN 0036-8075, S. 1519–1523, PMID 9727980.
- N. Cermakian, P. Sassone-Corsi: Environmental stimulus perception and control of circadian clocks. In: Curr Opin Neurobiol. 12(4), 2002, S. 359–365.
- L. Rensing, P. Luoff: Temperature effect on entrainment, phase shifting, and amplitude of circadian clocks and its molecular bases. In: Chronobiol Int. Bd. 19, Nr. 5, 2002, S. 807–864.
- C. S. Pittendrigh: Circadian rhythms and the circadian organization of living systems. In: Cold Spring Harbor Symposia on Quantitative Biology. Band 25, 1960, ISSN 0091-7451, S. 159–184, PMID 13736116.
- R. E. Mistlberger, B. Rusak: Circadian Rhythms in Mammals: Formal Properties and Environmental Influences. In: M. H. Kryger, T. Roth, W. C. Dement (red): Principles and practice of sleep medicine. 4. Auflage. Saunders, Philadelphia 2005, ISBN 0-7216-0797-7, S. 321–334.
- J. F. Duffy, C. A. Czeisler: Age-related change in the relationship between circadian period, circadian phase, and diurnal preference in humans. In: Neurosci Lett. Bd. 318, Nr. 3, 2002, S. 117–120.
- C. Pittendrigh, S. Daan: Circadian oscillations in rodents: A systematic increase in their frequency with age. In: Science. Bd. 186, 1974, S. 548–550.
- V. S. Valentinuzzi, K. Scarbrough, J. S. Takahashi, F. W. Turek: Effects of aging on the circadian rhythm of wheel-running activity in C57BL/6 mice. In: Am J Physiol. Bd. 273, 1997, S. R1957–R1964.
- T. L. Page, C. Mans, G. Griffeth: History dependence of circadian pacemaker period in the cockroach. In: J Insect Physiol. Bd. 47, Nr. 9, 2001, S. 1085–1093.
- Effects of light on circadian pacemaker development. I. The freerunning period. In: J Comp Physiol [A]. Bd. 165, Nr. 1, 1989, S. 41–49.
- Lili Zhou, Caitlyn Miller, Loren J. Miraglia, Angelica Romero, Ludovic S. Mure, Satchidananda Panda, and Steve A. Kay: A genome-wide microRNA screen identifies the microRNA-183/96/182 cluster as a modulator of circadian rhythms. In: Proc Natl Acad Sci. 118, Nr. 1, 5. Januar 2021, S. e2020454118. doi:10.1073/pnas.2020454118. „In this phenotype-driven study, we started from a genome-wide cell-based functional screen and identified miRNAs that modulate circadian rhythms. The majority of the hits lengthened the period, but a very small number of hits were found to shorten the period.“
- C. H. Johnson: Forty years of PRCs: What have we learned? In: Chronobiology Int. 16(6), 1999, S. 711–743.
- C. A. Czeisler, R. E. Kronauer, J. S. Allan, J. F. Duffy, M. E. Jewett, E. N. Brown, J. M. Ronda: Bright light induction of strong (type 0) resetting of the human circadian pacemaker. In: Science. Bd. 244, 1989, S. 1328–1333.
- Roenneberg, Till.: Wie wir ticken: die Bedeutung der inneren Uhr für unser Leben. 1. Auflage. DuMont, Köln 2010, ISBN 3-8321-9520-3.
- A. J. Koilray, G. Marimuthu, K. Natarajan, S. Saravanan, P. Maran, M. Hsu: Fungal diversity inside caves of Southern India. In: Current Science. Bd. 77, Nr. 8, 1999, S. 1081–1084.
- Steven A. Shea: Obesity and Pharmacologic Control of the Body Clock. In: New England Journal of Medecine. Bd. 367, 2012, S. 175–178.
- L. A. Salt, Y. Wang, S. Banerjee u. a.: Regulation of circadian behaviour and metabolism by synthetic REV-ERB agonists. In: Nature. Bd. 485, 2012, S. 62–68.
- P. H. Quail: Phytochrome: a light-activated molecular switch that regulates plant gene expression. In: Ann Rev Gen. 25, 1991, S. 389–409.
- P. F. Devlin: Signs of the time: environmental input to the circadian clock. In: J Exp Bot. 53(374), 2002, S. 1535–1550.
- P. F. Devlin, S. A. Kay: Cryptochromes are required for phytochrome signaling to the circadian clock but not for rhythmicity. In: The Plant Cell. 12, 2000, S. 2499–2510.
- S. L. Harmer, J. B. Hogenesch, M. Straume, H. S. Chang, B. Han, T. Zhu, X. Wang, J. A. Kreps, S. A. Kay: Orchestrated transcription of key pathways in Arabidopsis by the circadian clock. In: Science. Bd. 290, 2000, 2000, S. 2110–2113.
- Christoph Scheiermann, Yuya Kunisaki, Paul S. Frenette: Circadian control of the immune system. In: Nature Reviews Immunology. Band 13, Nr. 3, 2013, ISSN 1474-1741, S. 190–198, doi:10.1038/nri3386 (nature.com [abgerufen am 30. Januar 2018]).
- Joseph Bass, Mitchell A. Lazar: Circadian time signatures of fitness and disease. In: Science. Band 354, Nr. 6315, 25. November 2016, ISSN 0036-8075, S. 994–999, doi:10.1126/science.aah4965, PMID 27885004 (sciencemag.org [abgerufen am 30. Januar 2018]).
- Harini C. Krishnan, Lisa C. Lyons: Synchrony and desynchrony in circadian clocks: impacts on learning and memory. In: Learning & Memory. Band 22, Nr. 9, 1. September 2015, ISSN 1072-0502, S. 426–437, doi:10.1101/lm.038877.115, PMID 26286653 (cshlp.org [abgerufen am 30. Januar 2018]).
- Rosa Levandovski, Etianne Sasso, Maria Paz Hidalgo: Chronotype: a review of the advances, limits and applicability of the main instruments used in the literature to assess human phenotype. In: Trends in Psychiatry and Psychotherapy. Band 35, Nr. 1, 2013, ISSN 2237-6089, S. 3–11, PMID 25923181.
- Swab test to tell if you’re a late sleeper or early riser. In: The Telegraph. 6. Juni 2008.
Lerchen, Eulen und Normaltyp. In: focus-online. 16. September 2010
Universal Protein Resource (UniProt): Fachwissenschaftliche Beschreibung der Eigenschaften des Gens PER2 beim Menschen: „Defects in PER2 are a cause of familial advanced sleep-phase syndrome (FASPS). FASPS is characterized by very early sleep onset and offset. Individuals are ‘morning larks’ with a 4 hours advance of the sleep, temperature and melatonin rhythms.“ - MCTQ. Abgerufen am 1. Februar 2018 (britisches Englisch).
- Giulia Zerbini, Martha Merrow: Time to learn: How chronotype impacts education. In: PsyCh Journal. Band 6, Nr. 4, Dezember 2017, ISSN 2046-0260, S. 263–276, doi:10.1002/pchj.178, PMID 28994246.
- Wer später lernt, ist besser drauf. auf: Spiegel-online. 15. Dezember 2008.
- Cameron S. McAlpine, Filip K. Swirski: Circadian Influence on Metabolism and Inflammation in Atherosclerosis. In: Circulation Research. Band 119, Nr. 1, 24. Juni 2016, ISSN 0009-7330, S. 131–141, doi:10.1161/circresaha.116.308034, PMID 27340272.
- E. S. Schernhammer, F. Laden, F. E. Speizer, W. C. Willett, D. J. Hunter: Rotating night shifts and risk of breast cancer in women participating in the nurses’ health study. In: Journal of the National Cancer Institute. Band 93, Nr. 20, 17. Oktober 2001, ISSN 0027-8874, S. 1563–1568, PMID 11604480.
- Saurabh Sahar, Paolo Sassone-Corsi: Metabolism and cancer: the circadian clock connection. In: Nature Reviews Cancer. Band 9, Nr. 12, 2009, ISSN 1474-1768, S. 886–896, doi:10.1038/nrc2747 (nature.com [abgerufen am 30. Januar 2018]).
- Selma Masri, Kenichiro Kinouchi, Paolo Sassone-Corsi: Circadian clocks, epigenetics, and cancer. In: Current Opinion in Oncology. Band 27, Nr. 1, S. 50–56, doi:10.1097/cco.0000000000000153 (wkhealth.com [abgerufen am 30. Januar 2018]).
- Christoph A. Thaiss u. a.: Transkingdom Control of Microbiota Diurnal Oscillations Promotes Metabolic Homeostasis. In: Cell. Bd. 159, Nr. 3, 2014, S. 514–529, doi:10.1016/j.cell.2014.09.048.
- Erik S. Musiek, David M. Holtzman: Mechanisms linking circadian clocks, sleep, and neurodegeneration. In: Science. Band 354, Nr. 6315, 25. November 2016, ISSN 0036-8075, S. 1004–1008, doi:10.1126/science.aah4968, PMID 27885006 (sciencemag.org [abgerufen am 30. Januar 2018]).
- Dominic Landgraf, Michael J. McCarthy, David K. Welsh: Circadian Clock and Stress Interactions in the Molecular Biology of Psychiatric Disorders. In: Current Psychiatry Reports. Band 16, Nr. 10, 1. Oktober 2014, ISSN 1523-3812, S. 483, doi:10.1007/s11920-014-0483-7.