Lithiumcarbonat
Lithiumcarbonat (fachsprachlich) oder Lithiumkarbonat (Li2CO3) ist das Lithiumsalz der Kohlensäure. Lithiumcarbonat ist die wichtigste Lithiumverbindung. Schon im Jahr 1985 betrug der Weltabsatz von Lithiumcarbonat ca. 28.000 Tonnen/Jahr.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
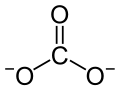 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Lithiumcarbonat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | Li2CO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05AN01 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 73,89 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,11 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
1310 °C (Zersetzung)[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−1215,9 kJ/mol[7] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
In der Natur kommt Lithiumcarbonat sehr selten in Form des Minerals Zabuyelit vor.
Gewinnung und Darstellung
Lithiumcarbonat wird aus lithiumhaltigen Erzen (Pegmatite) und Solen hergestellt. Wichtigstes Erz ist Spodumen.[8]
Im Jahr 1923 begann in der Hans-Heinrich-Hütte der Metallgesellschaft in Langelsheim (Harz) die Produktion des ersten technischen Lithiumcarbonats.
Das lithiumhaltige Erz wird zerkleinert, zur Entfernung organischer Verunreinigungen geröstet und mit Schwefelsäure aufgeschlossen. Durch Zugabe von Natriumcarbonat (Soda) werden zuerst die Verunreinigungen ausgefällt und abfiltriert. Weiteres Alkalisieren mit Natriumcarbonat führt zur Ausfällung von Lithiumcarbonat, das abfiltriert oder abzentrifugiert wird.[9] Bei stark verunreinigtem Ausgangsmaterial wird nochmals mit Schwefelsäure aufgelöst und mit Natriumcarbonat gefällt. Vor dem Verpacken wird das Lithiumcarbonat in einem Vakuumtrockner getrocknet.
Durch Reaktion mit Kohlendioxid wandelt sich das wasserunlösliche Lithiumcarbonat in das metastabile Lithiumhydrogencarbonat (Lithiumbicarbonat) um. Nach Ausfällung der Aluminium- und Eisensilikate wird das Lithiumhydrogencarbonat aufgefangen und durch Erhitzen auf 95 °C wieder in reines Lithiumcarbonat umgewandelt.[10]
Kostengünstiger ist das Verarbeiten von lithiumhaltigen Solen. Vor der Fällung mit Soda werden sie aufkonzentriert. Im Gewinnungsgebiet Salar de Atacama in Chile geschieht dies teilweise durch Verdunsten des Wassers in Solarteichen. Der anschließende Fertigungsweg geschieht so wie oben beschrieben.
Eigenschaften
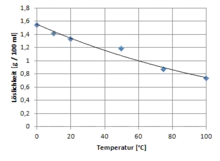
Lithiumcarbonat kristallisiert im monoklinen Kristallsystem in der Raumgruppe C2/c (Raumgruppen-Nr. 15) mit den Gitterparametern a = 835,9 pm, b = 497,67 pm, c = 619,4 pm und β = 114,72°. In der Elementarzelle befinden sich vier Formeleinheiten.[6] Bei 350 °C und 410 °C finden Phasenübergänge statt.[6] Im Gegensatz zu den Carbonaten der übrigen Alkalimetalle ist Lithiumcarbonat in Wasser weniger gut löslich. Mit zunehmender Temperatur nimmt die Löslichkeit ab. Daher bietet sich als Herstellungsmethode die Umsetzung von wässrigen Lithiumsalzlösungen mit Natriumcarbonat an:
Im Labor wird dieses Löslichkeitsverhalten ausgenutzt, um handelsübliches Lithiumcarbonat aufzureinigen. Hierzu wird eine kaltgesättigte Lösung hergestellt, diese ggf. von unlöslichen Verunreinigungen abfiltriert und dann unter starkem Rühren zum Sieden erhitzt. Auf Grund der sinkenden Löslichkeit des Lithiumcarbonat bei steigender Temperatur beginnt hierbei reines Lithiumcarbonat auszufallen, welches dann heiß abfiltriert wird.[4]
Anders als die Carbonate von Natrium und Kalium gibt trockenes Lithiumcarbonat beim Erhitzen Kohlendioxid ab[11]
Erhitzt man Lithiumcarbonat im elektrischen Ofen mit einem Überschuss von Kohlenstoff, so entsteht Lithiumcarbid. Auch hier gleicht das Lithium eher dem Calcium als den anderen Alkalimetallen, die unter diesen Umständen zum Metall reduziert werden.[11]
Die Standardbildungsenthalpie des kristallinen Lithiumcarbonats beträgt ΔfH0298 = −1215,87 kJ/mol.[12]
Verwendung
Die Hälfte des Absatzes wird für die Aluminiumherstellung (Schmelzflusselektrolyse) benötigt. Weitere Anwendungsgebiete sind die Glas-, Keramik-, Emailindustrie. Lithiumcarbonat sorgt für eine geringere Schmelztemperatur – wodurch Energiekosten gesenkt werden – und verleiht der heißen Glasmasse eine geringere Viskosität (wodurch z. B. die Herstellung von sehr dünnwandigem Glas erleichtert wird).
Lithiumcarbonat kann als Ausgangsstoff zur Herstellung weiterer Lithiumverbindungen wie beispielsweise Lithiumchlorid, Lithiumformiat, Lithiumhydroxid oder Lithiumniobat verwendet werden. Des Weiteren wird es zur Schmelzpunkterniedrigung in der schmelzflusselektrolytischen Gewinnung von Aluminium genutzt.[9] Lithiumhaltige Gläser werden auf Grund ihres geringen Ausdehnungskoeffizienten zur Herstellung feuerfester Gläser verwendet.[9] Es ist außerdem Bestandteil von Schnellzementen und Estrichen[13] und dient dort dem schnelleren Abbinden des Zements. In Schmelzkarbonatbrennstoffzellen ist es Bestandteil des Elektrolyts.[14] In der Industrie wird es auch als Flussmittel zur Herstellung von Glas, Keramik und Email eingesetzt.[9]
In der Lithiumtherapie wird Lithiumcarbonat zur Behandlung depressiver Erkrankungen, Manien oder bipolarer Störungen eingesetzt. Handelsnamen sind beispielsweise in Deutschland Hypnorex und Quilonum, in Österreich Neurolepsin und Quilonorm, in der Schweiz Quilonorm.[15] Da Lithiumcarbonat weniger wasserlöslich ist als andere Lithiumsalze, wird es durch den oberen Gastrointestinaltrakt weniger schnell absorbiert. Bis zur Spitzenplasmakonzentrationen dauert es viermal so lange wie bei anderen Lithiumsalzen. Dennoch werden häufig Retard-Tabletten verabreicht, die den Wirkstoff noch langsamer freisetzen. Die Wirkungsweise ist ansonsten wie bei allen anderen Lithiumsalzen gleich. Die niedrige therapeutische Breite führt dazu, dass Patienten regelmäßig durch Laboranalysen ihren Lithiumspiegel im Blut kontrollieren lassen müssen.[16]

Musik
2004 benannte der Produzent Venetian Snares seinen Song Li2CO3 nach der chemischen Verbindung.
Literatur
- Richard Bauer: Lithium – wie es nicht im Lehrbuch steht, Chemie in unserer Zeit, Oktober 1985, S. 167, VCH Verlagsgesellschaft mbH Weinheim
Einzelnachweise
- Eintrag zu LITHIUM CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- Eintrag zu Lithiumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Datenblatt Lithiumcarbonat (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- E. R. Caley and P. J. Elving: Purification of lithium carbonate. In: Harold Simmons Booth (Hrsg.): Inorganic Syntheses. Band 1. McGraw-Hill, Inc., 1939, S. 1–2 (englisch).
- Eintrag zu Lithiumcarbonat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Gabler Wissenschaftsverlage, 1997, ISBN 978-3-540-60035-0, S. 532 (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg et al.: Industrielle Anorganische Chemie. John Wiley & Sons, 2013, ISBN 978-3-527-64958-7 (Google Books).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1153.
- Donald E. Garrett: Handbook of Lithium and Natural Calcium Chloride. Academic Press, 2004, ISBN 978-0-08-047290-4 (Google Books).
- R. Abegg, F. Auerbach, I. Koppel: Handbuch der anorganischen Chemie. Verlag S. Hirzel, 1908, 2. Band, 1. Teil, S. 146ff. Volltext
- Oliver Herzberg: Untersuchung organischer Festkörperreaktionen am Beispiel von Substitutions- und Polykondensationsreaktionen. Hamburg 2000, DNB 960245774, urn:nbn:de:gbv:18-2380 (Dissertation, Universität Hamburg).
- (Seite nicht mehr abrufbar, Suche in Webarchiven: Tätigkeitsbericht 2005) Institut für Holztechnologie Dresden
- J. Deberitz, G. Boche: Lithium und seine Verbindungen – Industrielle, medizinische und wissenschaftliche Bedeutung, in: Chemie in unserer Zeit 2003, 37, 258–266, doi:10.1002/ciuz.200300264.
- Depression. 2. Auflage. Thieme Verlag, 2002, ISBN 978-3-13-104662-8, 4. Medikamente, Checklisten, Beurteilungsinstrumente, doi:10.1055/b-0033-858.
- DFP-Literatur: Lithiumtherapie bei bipolarer Störung. Österreichische Gesellschaft für Neuropsychopharmakologie und Biologische Psychiatrie, 3. September 2014, abgerufen am 15. August 2021.
