Birch-Reduktion
Die Birch-Reduktion [ˈbəːtʃ-] ist eine Namensreaktion in der organischen Chemie. Durch sie werden aromatische Systeme mit Hilfe von Alkalimetallen in nicht-aromatische Systeme überführt (sog. Dearomatisierung). Die Reaktion wurde 1944 von Arthur Birch entwickelt,[1] erste Überlegungen zur Reaktion machten schon 1937 Charles B. Wooster und Kenneth L. Godfrey.[2]
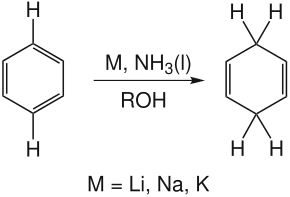
Reaktion
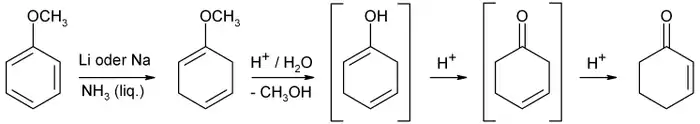
Für die Reaktion werden Alkalimetalle wie Natrium oder Lithium, selten Kalium in flüssigem Ammoniak gelöst. Dabei entstehen solvatisierte Elektronen, die als eigentliches Reduktionsmittel dienen. Dies ist durch eine tiefblaue Färbung der Lösung zu erkennen. Es wird zusätzlich ein Alkanol, z. B. Ethanol, als Protonenspender benötigt. Die Reaktion verläuft regioselektiv, in der Form, dass in 1,4-Stellung protoniert wird, also zwei gegenüberliegende Kohlenstoffatome reduziert werden und zwei getrennte Doppelbindungen entstehen.[3] Diese Regioselektivität wird mit dem Prinzip der minimalen Strukturänderung erklärt. Werden anstatt Ammoniak Amine als Lösungsmittel verwendet, entstehen keine Diene, sondern Cycloalkene (Benkeser-Reaktion).[4]
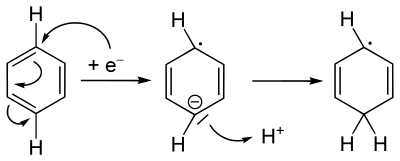
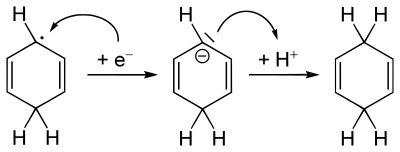
Reaktionsmechanismus
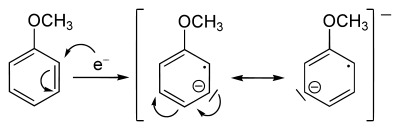
Im ersten Schritt wird ein solvatisiertes Elektron auf ein antibindendes Molekülorbital (das LUMO) des aromatischen Ringes übertragen. Dabei bildet sich an einem Kohlenstoffatom ein Carbanion, während ein anderes radikalisch wird. Das Carbanion nimmt anschließend ein Proton eines Ethanolmoleküls auf. Ethanol wird von solvatisierten Elektronen nur sehr langsam reduziert, kann also schon vor der eigentlichen Reaktion zugegeben werden.[3]
Durch weitere Aufnahme eines Elektrons aus der Lösung wird ein weiteres Carbanion gebildet. Dieses reagiert mit dem Proton eines zweiten Ethanolmoleküls und bildet das 1,4-dihydrierte Produkt.[3]
Hierbei ist zu beachten, dass die verbleibenden zwei Doppelbindungen stets genau gegenüberliegend verbleiben. Es wird also kein konjugiertes System gebildet.
Reaktion an Benzolderivaten
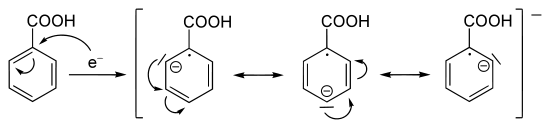
Substituenten am aromatischen Ring beeinflussen die Regioselektivität der Erstprotonierung am radikal-anionischen Ring. Sie ist abhängig davon, ob es sich um einen Elektronenakzeptorsubstituenten (Substituent mit einem negativen I-Effekt) oder einen Elektronendonorsubstituenten (Substituent mit einem positiven M-Effekt und/oder positiven I-Effekt) handelt. A. Birch selbst ging aufgrund qualitativer Überlegungen[5] bei Donorsubstituenten (wie etwa Hydroxy- oder Ethergruppen) von einer Erstprotonierung in meta-Position zum Substituenten aus. Heutzutage ist diese Auffassung jedoch sowohl durch theoretische Arbeiten auf dem Gebiet der Quantenmechanik[6][7][8] als auch durch Experimente[8] widerlegt und eine Erstprotonierung in ortho-Position erwiesen.
Ist dagegen ein Akzeptorsubstituent am Aromaten, so findet die erste Protonierung in para-Stellung oder ipso zum Substituenten statt. Verantwortlich hierfür sind jeweils größere Stabilitäten der Übergangszustände.[3]
Anisole reagieren zu 1-Methoxycyclohexa-1,4-dienen, sofern weitere Substituenten keinen Einfluss nehmen. Das aus Anisol entstehende 1-Methoxycyclohexa-1,4-dien erleidet in einem wässrig-sauren Medium eine protonenkatalysierte Etherspaltung. Das unmittelbare Produkt ist ein instabiles Enol, welches sich unter weiterer Protonenkatalyse (Keto-Enol-Tautomerie) spontan über das Cyclohex-3-enon zum stabileren (wg. Konjugation der Doppelbindungen) 2-Cyclohexen-1-on umlagert. Dieses so genannte α,β-ungesättigte Keton dient u. a. als Ausgangsstoff für Michael-Additionen.[3]
Bedeutung
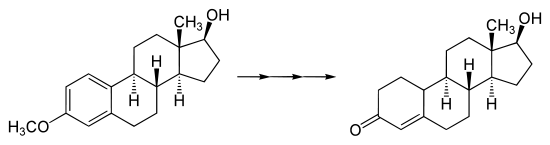
Besondere Bedeutung kommt der Birch-Reduktion bei der Synthese von Steroiden zu. Durch Birch-Reduktion von Anisolderivaten wurden C19-Steroide synthetisiert.[9] (hier am Beispiel methylierten Estradiols):
Unter anderem wurde das erste aktive, in der Antibabypille eingesetzte Östrogen Norethisteron[10] oder das erste totalsynthetisch hergestellte anabole Steroid Nandrolon[9] mit Hilfe einer Birch-Reduktion synthetisiert.
Literatur
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.
- László Kürti, Barbara Czako: Strategic Applications of Named Reactions in Organic Synthesis. Academic Press, 2004, ISBN 0-1242-9785-4.
Einzelnachweise
- Arthur J. Birch: Reduction by dissolving metals. Part I. In: Journal of the Chemical Society (Resumed). 1944, S. 430–436, doi:10.1039/JR9440000430.
- Charles Bushnell Wooster, Kenneth L. Godfrey: Mechanism of the Reduction of Unsaturated Compounds with Alkali Metals and Water. In: J. Am. Chem. Soc. 59, Nr. 3, 1937, S. 596–597, doi:10.1021/ja01282a504.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 808–809.
- Stefan Kubik: Birch-Reduktion. In: Römpp Chemie-Lexikon. Thieme, Stand August 2004.
- Birch, A. J., Nasipuri, D.: Reaction Mechanisms in Reductions by Metal-Ammonia Solutions, Tetrahedron 1959, 148–153.
- Howard E. Zimmerman: Orientation in metal ammonia reductions. In: Tetrahedron. 16, Nr. 1–4, 1961, S. 169–176, doi:10.1016/0040-4020(61)80067-7.
- H. E. Zimmerman: Base-Catalyzed Rearrangements In: Paul De Mayo (Hrsg.): Molecular rearrangements. Interscience Publishers, New York 1963, Chapter 6, S. 345–406.
- Howard E. Zimmerman, Patricia A. Wang: Regioselectivity of the Birch reduction. In: Journal of the American Chemical Society. 112, Nr. 3, 1990, S. 1280–1281, doi:10.1021/ja00159a078.
- Arthur J. Birch: The Birch reduction in organic synthesis. In: Pure and Applied Chemistry. 68, Nr. 3, 1996, S. 553–556 (Volltext, pdf).
- Carl Djerassi, L. Miramontes, G. Rosenkranz, Franz Sondheimer: Steroids. LIV. Synthesis of 19-Nov-17α-ethynyltestosterone and 19-Nor-17α-methyltestosterone2. In: Journal of the American Chemical Society. 76, Nr. 16, 1954, S. 4092–4094, doi:10.1021/ja01645a010.