Hydratation
Unter Hydratation oder Hydration versteht man die Anlagerung von Wassermolekülen
- an gelöste Ionen. Dadurch entsteht eine Hydrathülle (auch Hydrat-Sphäre).
- an polare Neutralmoleküle, insbesondere wenn Wasserstoffbrückenbindungen gebildet werden können.
- in Festkörpern (Mineralien) als Kristallwasser zur Bildung von Hydraten.
Mit „Hydratation“ bezeichnet man somit den Spezialfall der Solvatation für das Lösungsmittel Wasser.
Von technischer Bedeutung im Bauwesen ist die Hydratation von Calciumoxid (Branntkalk), Magnesiumoxid (gebrannte Magnesia) und Zement zu Calciumhydroxid (Löschkalk), Magnesiumhydroxid und Calciumsilicathydraten.[1]
Wasser an gelösten Ionen
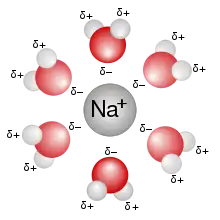
Die Hydratation erfolgt aufgrund der elektrostatischen Kräfte zwischen den geladenen Ionen und den Wasser-Dipolen (Ion-Dipol-Wechselwirkung). Unter Ausbildung von Wasserstoffbrücken zu der ersten Hydrathülle können sich weitere Wassermoleküle anlagern und so eine weitere Hydrat-Sphäre bilden.
Als Maß für die Neigung der Ionen, sich mit Wassermolekülen zu verbinden, dient die Hydrationsenergie. Dies ist die Energie, die erforderlich ist, um die Ionen aus der wässrigen Lösung in eine unpolare Umgebung zu bringen.
Die Anzahl der gebundenen Wassermoleküle und die Stärke der Bindung hängen von der Größe und der Ladung der Ionen ab. Bei gleicher Ladung bauen die kleineren Ionen eine größere Hydrathülle auf als die größeren. Durch ein aq am Ion wird ausgedrückt, dass ein Ion hydratisiert in Lösung vorliegt:
Bei kleinen und/oder mehrfach geladenen Kationen können die gebundenen Wassermoleküle Protonen abgeben, man spricht von Kationsäuren (siehe Lewis-Säuren). Aus Lösungen, die Kationsäuren enthalten, kann das Lösungsmittel Wasser unter Umständen nicht entfernt werden:
Anionen sind im Allgemeinen wesentlich größer als Kationen und damit auch schwächer hydratisiert.
In anderen polaren Lösungsmitteln, z. B. Ammoniak, treten ähnliche Effekte auf, die allgemein Solvatisierung genannt werden.
Wasser an unpolaren Teilchen (Hydrophobe Hydratation)
Wenn sich unpolare und ungeladene (also wasserfeindliche) Teilchen in wässriger Lösung befinden, kommt es zu sogenannten hydrophoben Effekten.[2] Dazu gehört auch die hydrophobe (wassermeidende) Hydratation. Das Wasser in der nächsten Umgebung des unpolaren Teilchens (z. B. eines Xenon-Atoms)[3] oder einer unpolaren Molekülgruppe (z. B. einer Alkylgruppe) besitzt dann etwas mehr Struktur, und die translatorische und rotatorische Beweglichkeit der benachbarten Wassermoleküle ist reduziert. Da der hydrophobe Effekt auch in der Nähe von großen Biomolekülen stattfindet, wo Wasser sowohl neben polaren als auch neben unpolaren Molekülgruppen angeordnet ist, spielt dieser Effekt eine außerordentlich wichtige Rolle bei vielen biochemischen Prozessen.
Siehe auch
Einzelnachweise
- Dipl.-Ing. Bonar Marbun: Kinetik der Hydratation von CaO und MgO, Dissertation, Februar 2006, Fakultät für Natur- und Materialwissenschaften, Technische Universität Clausthal
- W. Blokzijl und J. B. F. N. Engberts: Hydrophobe Effekte – Ansichten und Tatsachen In: Angew. Chemie 105, 1993, S. 1610–1648.
- R. Haselmeier, M. Holz, W. Marbach, H. Weingärtner: Water Dynamics Near a Dissolved Noble Gas. First Direct Experimental Evidence for a Retardation Effect. In: J. Phys. Chem. 99, 1995, S. 2243–2246.