Lithiumnitrid
Lithiumnitrid, Li3N, ist eine chemische Verbindung, die aus Lithium und Stickstoff aufgebaut ist. Neben Li3N sind (bei zum Teil hohen Drücken) mit LiN2, LiN und LiN5 weitere Lithiumnitride bekannt.[6]
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Li+ _ N3− | |||||||||||||||||||
| Kristallsystem |
hexagonal | ||||||||||||||||||
| Raumgruppe |
P6/mmm (Nr. 191) [1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lithiumnitrid | ||||||||||||||||||
| Verhältnisformel | Li3N | ||||||||||||||||||
| Kurzbeschreibung |
rotbrauner Feststoff mit ammoniakartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 34,83 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,294 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
reagiert heftig mit Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Synthese
Lithiumnitrid wird durch Reaktion von Lithium mit Stickstoff hergestellt. Die Reaktion läuft schon bei Raumtemperatur ab, jedoch sehr langsam, so dass zur Synthese von Lithiumnitrid meist höhere Temperaturen verwendet werden:[7]
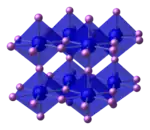
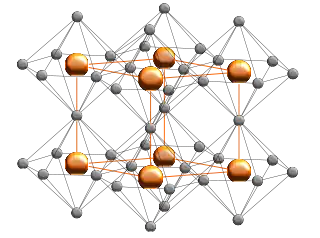
Struktur
Im Lithiumnitrid bilden die Lithiumatome graphitähnliche hexagonale Ringe, in deren Zentrum sich ein Stickstoffatom befindet. Weitere Lithiumatome befinden sich oberhalb und unterhalb des Stickstoffkerns, so dass jeder Stickstoff in einer hexagonal-bipyramidalen Geometrie von acht Lithiumkernen umgeben ist.[7][1]
Eigenschaften
Physikalische Eigenschaften
Lithiumnitrid ist ein feines, rot-braunes Pulver mit einer Dichte von 1,38 g·cm−3 bei Standardbedingungen. Es schmilzt bei 813 °C und ist unter Ausschluss von Feuchtigkeit und Luft stabil.[8][9][10] Lithiumnitrid ist ein guter Ionenleiter.[8]
Die Bildungsenthalpie von Lithiumnitrid beträgt −207 kJ/mol.[11]
Chemische Eigenschaften
Lithiumnitrid ist eine Superbase, da das N3−-Ion stark basisch reagiert. Mit Wasser hydrolysiert Lithiumnitrid zu Lithiumhydroxid und Ammoniak.[7]
Beim Erhitzen im Wasserstoffstrom bildet sich Lithiumhydrid.[12] Als Zwischenstufen entstehen Lithiumamid (LiNH2) und Lithiumimid (Li2NH).[13]
Beim Erhitzen von Lithiumnitrid mit Metallchloriden bilden sich Lithiumchlorid und das betreffende Metallnitrid.[12]
Verwendung
In der Metallurgie wird Lithiumnitrid zum Einbringen von Stickstoff in Legierungen verwendet.[14]
Lithiumnitrid wurde auch für die Wasserstoffspeicherung, zum Beispiel für Brennstoffzellen untersucht, da es durch Reaktion bis zu 9,3 Gew.-% Wasserstoff aufnehmen kann. Dabei entsteht neben Lithiumhydrid zuerst Lithiumimid, bevor sich schließlich Lithiumamid bildet. Dabei ist die Reaktion zwischen Lithiumimid Li2NH und -amid LiNH2 reversibel, was einem Massenanteil von etwa 7 % entspricht. Für eine Anwendung sind allerdings die notwendigen Temperaturen von 255 °C noch zu hoch.[15][16][17]
Einzelnachweise
- Struktur von Li3N (Memento vom 19. Juli 2012 im Internet Archive).
- Datenblatt Lithiumnitrid bei AlfaAesar, abgerufen am 15. Dezember 2010 (PDF) (JavaScript erforderlich).
- Inorganic Syntheses. John Wiley & Sons, 2009, ISBN 0-470-13288-4, S. 53 (eingeschränkte Vorschau in der Google-Buchsuche).
- R.M Yonco, E. Veleckis, V.A Maroni: Solubility of nitrogen in liquid lithium and thermal decomposition of solid Li3N. In: Journal of Nuclear Materials. 57, 1975, S. 317, doi:10.1016/0022-3115(75)90216-0.
- Datenblatt Lithium nitride bei Sigma-Aldrich, abgerufen am 7. November 2021 (PDF).
- Dominique Laniel, Gunnar Weck, Paul Loubeyre: Direct Reaction of Nitrogen and Lithium up to 75 GPa: Synthesis of the Li3N, LiN, LiN2, and LiN5 Compounds. In: Inorganic Chemistry. 57, 2018, S. 10685, doi:10.1021/acs.inorgchem.8b01325.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1153.
- Albrecht Rabenau: Lithiumnitrid und verwandte Stoffe, Ihre wissenschaftliche und praktische Bedeutung. Sila-Substitutionen. Westdeutscher Verlag GmbH, Opladen 1981, ISBN 978-3-663-01758-5, S. 12 (eingeschränkte Vorschau in der Google-Buchsuche).
- Peter Paetzold: Chemie: Eine Einführung. Walter de Gruyter, Berlin 2009, ISBN 978-3-11-021135-1, S. 636 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hermann Sicius: Wasserstoff und Alkalimetalle: Elemente der ersten Hauptgruppe. Springer Fachmedien, Wiesbaden 2016, ISBN 978-3-658-12268-3, S. 23, doi:10.1007/978-3-658-12268-3.
- M. Guntz: Sur l'azoture de lithium. In: Compt. Rend. Hebd. Band 123, 1896, S. 995–997 (Digitalisat auf Gallica).
- R. Abegg, F. Auerbach, I. Koppel: Handbuch der anorganischen Chemie. 2. Band, 1. Teil, Verlag S. Hirzel, 1908, S. 134 (Volltext).
- K. A. Hofmann: Lehrbuch der anorganischen Chemie. 2. Auflage, Verlag F. Vieweg & Sohn, 1919, S. 441 (Volltext).
- D. L. Perry, S. L. Phillips: Handbook of Inorganic Compounds: An Electronic Database. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 228.
- Jan Oliver Löfken: Neuer Wasserstoffspeicher aus Lithiumnitrid entdeckt. In: Bild der Wissenschaft. Abgerufen am 8. September 2019.
- Neues Speichermedium für Wasserstoff entwickelt. In: innovations-report.de. 25. November 2002, abgerufen am 3. September 2017.
- Ping Chen, Zhitao Xiong, Jizhong Luo, Jianyi Lin, Kuang Lee Tan: Interaction of hydrogen with metal nitrides and imides. In: Nature. Band 420, Nr. 6913, Oktober 2002, S. 302–304, doi:10.1038/nature01210.

