Lithiumbromid
Lithiumbromid LiBr, das Lithiumsalz der Bromwasserstoffsäure, bildet farblose, stark hygroskopische Kristalle mit einem Schmelzpunkt von 550 °C, einem Siedepunkt von 1265 °C und einer Dichte von 3,46 g·cm−3. Die Lösungsenthalpie in Wasser beträgt −48,83 kJ/mol.[7]
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Li+ _ Br− | |||||||||||||||||||
| Kristallsystem |
kubisch | ||||||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | ||||||||||||||||||
| Koordinationszahlen |
Li[6], Br[6] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lithiumbromid | ||||||||||||||||||
| Verhältnisformel | LiBr | ||||||||||||||||||
| Kurzbeschreibung |
bitter schmeckender, farbloser, hygroskopischer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,85 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,46 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
1265 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,783[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Neben dem wasserfreien Lithiumbromid existieren noch verschiedene Hydrate, bekannt sind LiBr · n H2O mit n= 1, 2, 3 und 5. Das Monohydrat LiBr · H2O weist eine Dichte von 2,51 g · cm−3 auf.
Herstellung
Die Herstellung von Lithiumbromid erfolgt durch Umsetzung einer wässrigen Lithiumhydroxid- oder Lithiumcarbonatlösung mit Bromwasserstoff.[8]
Das bei der Umsetzung von elementarem Brom mit Lithiumhydroxidlösung neben Lithiumbromid entstehende Lithiumhypobromit kann mit Ameisensäure oder Ammoniak zum Lithiumbromid reduziert werden.
Das wasserfreie Lithiumbromid kann auch durch Reaktion von Lithiumhydrid mit Brom hergestellt werden.
Eigenschaften
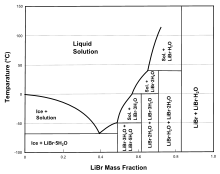
Lithiumbromid ist hygroskopisch[5], konzentrierte Lösungen mit 50 % LiBr reduzieren den Dampfdruck des Wassers um ca. 80 %. Es ist sehr gut löslich in Wasser, bei 20 °C sind 60%ige Lösungen herstellbar. Auch in Ethanol und Ethylenglycol ist es gut löslich. Die Löslichkeit ist gering vom Druck, jedoch stark von der Temperatur abhängig. Abhängig von der Temperatur existieren verschiedene Hydrate des Lithiumbromids: unter 4 °C das Trihydrat LiBr · 3 H2O, zwischen 4 und 44 °C das Dihydrat LiBr · 2 H2O und zwischen 44 und 159 °C das Monohydrat LiBr · H2O. Bei noch höheren Temperaturen ist das Anhydrat stabil.[10] Das Löslichkeitsdiagramm weist beim Übergangspunkt vom Monohydrat zum Anhydrat einen Knick auf.
Die Standardbildungsenthalpie von Lithiumbromid beträgt ΔHf0 = −351 kJ/mol.[11]
Verwendung
- Als Lösung von Lithiumbromid in Wasser für Absorptionskältemaschinen[12] (> 50 % des hergestellten Lithiumbromids).
- Wegen der stark hygroskopischen Wirkung als Trocknungsmittel, auch zur Entfeuchtung geschlossener Räume.
- Organische Synthesen. Als Katalysator und Edukt.
- Flussmittel beim Löten.
- Als Elektrolyt in einigen Lithiumbatterietypen.
- bis in die 1950er Jahre als Antikonvulsivum, Sedativum und Mittel gegen bipolare Störungen (nicht mehr gebräuchlich wegen starker Nebenwirkungen)
Einzelnachweise
- Eintrag zu Lithiumbromid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- Datenblatt Lithiumbromid bei AlfaAesar, abgerufen am 5. Februar 2010 (PDF) (JavaScript erforderlich).
- Dimethyl Sulfoxide (DMSO) Solubility Data. Gaylord Chemical Company, L.L.C.; Bulletin 102, Juni 2014, S. 15. (PDF)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Crystals, S. 10-246.
- Eintrag zu Lithiumbromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu Lithium Bromide bei chemicalland21.com.
- Erich Meister: Grundpraktikum Physikalische Chemie. 2006, ISBN 3-8252-8329-1.
- Autorenkollektiv: Organikum. 21. Auflage. Wiley-VCH, Weinheim 2001, ISBN 3-527-29985-8, S. 1151–1152.
- Herold, Keith; Radermacher, E.; Klein, Reinhard; Sanford, A.: Absorption Chillers and Heat Pumps. Boca Ration: CRC Press, 1996, ISBN 0-8493-9427-9.
- R. Abegg, F. Auerbach, I. Koppel: Handbuch der anorganischen Chemie. Verlag S. Hirzel, 1908, 2. Band, 1. Teil, S. 128–129. Volltext
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1170.
- Kälte Luft Klimatechnik: Kälteerzeugung unter 0 °C mit einer Wasser/Lithiumbromid-Resorptionskältemaschine
