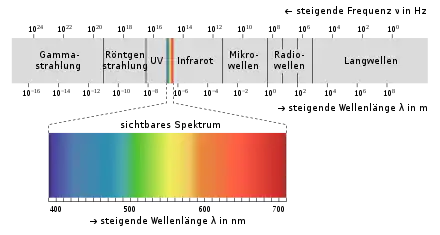
Infrarotspektroskopie
Infrarotspektroskopie, kurz IR-Spektroskopie und bis in die 1960er-Jahre Ultrarotspektroskopie genannt, ist ein physikalisches Analyseverfahren, das mit infraroter Strahlung (Wellenlänge: 800 nm bis 1 mm) arbeitet. Das Verfahren gehört zu den Methoden der Molekülspektroskopie, die auf der Anregung von Energiezuständen in Molekülen beruhen.
Die IR-Spektroskopie wird zur quantitativen Bestimmung von bekannten Substanzen, deren Identifikation anhand eines Referenzspektrums erfolgt, oder zur Strukturaufklärung unbekannter Substanzen genutzt.
Ähnliche molekülspektroskopische Methoden sind die Raman-Spektroskopie, die ebenfalls Schwingungsinformationen im Infrarotbereich liefert, und die UV/VIS-Spektroskopie im höherliegenden Frequenzbereich.
Heutzutage kommen hauptsächlich Fourier-Transform-Infrarotspektrometer (FTIR-Spektrometer) zum Einsatz. Diese bieten gegenüber den früher üblichen dispersiven Spektrometern einige entscheidende Vorteile. Beispielsweise weisen die FTIR-Spektrometer ein deutlich höheres Signal-Rausch-Verhältnis auf und benötigen wesentlich geringere Messzeiten. Ergebnisse der Infrarotspektroskopie werden in der Infrarotspektrografie dargestellt.
Varianten
Aus spektroskopischer Sicht wird zwischen dem nahen Infrarot (NIR; Wellenzahl: 12500–4000 cm−1; Wellenlänge: 0,8–2,5 µm, vgl. Nahinfrarotspektroskopie), dem mittleren oder klassischen (normalen) Infrarot (MIR; Wellenzahl: 4000–400 cm−1 Wellenlänge: 2,5–25 µm) und dem fernen Infrarot (FIR; Wellenzahl: 400–10 cm−1; Wellenlänge: 25–1000 µm) unterschieden, da durch die Absorption im jeweiligen Bereich unterschiedliche Phänomene zu beobachten sind. Eine Absorption im FIR-Bereich führt überwiegend zur Rotation ganzer Moleküle. Im MIR-Bereich und NIR-Bereich wird die Schwingung von Atomen bzw. Atomgruppen an ihren Molekülbindungen angeregt, wobei im NIR-Bereich die sogenannten Oberschwingungen des MIR-Bereich detektierbar sind (insbesondere von CH-, OH- und NH-Bindungen).[1]
Die Spektroskopie im mittleren Infrarot – häufig nur als IR-Spektroskopie bezeichnet – ist eine leistungsfähige Technik in der chemischen Analytik organischer Substanzen. Sie ermöglicht direkte Aussagen über Vorhandensein und ggf. Konzentration infrarotaktiver funktioneller Gruppen. Die Nahinfrarotspektroskopie (NIRS) wird zur schnellen Überprüfung von Stoffen und Stoffgemischen (häufig insbesondere in Anwendungen der Prozessanalytik) genutzt, ist aber auf computergestützte chemometrische Modelle mit begleitender, stichprobenhafter Referenzanalytik angewiesen.
In IR-Spektren wird, im Gegensatz zu UV-Spektren, häufig nicht die Absorption, sondern die Transmission als Maß für die Durchlässigkeit der Anregungsstrahlung verwendet. Die Transmission wird nach oben zunehmend der vertikalen Achse aufgetragen – Bereiche geringer Durchlässigkeit der IR-Strahlung ergeben einen Ausschlag nach unten. Die Darstellung als Absorptionsspektrum wird aber, vor allem bei der ATR-Technik, ebenfalls genutzt.
Messprinzip
Absorption von IR-Strahlung
Bei der Bestrahlung eines Stoffes mit elektromagnetischen Wellen werden bestimmte Frequenzbereiche absorbiert. Infrarotstrahlung liegt energetisch im Bereich der Rotationsniveaus von kleinen Molekülen und der Schwingungsniveaus von Molekülbindungen, d. h., die Absorption führt zu einer Schwingungsanregung der Bindungen. Sie sind in Form von Ausschlägen im gemessenen Spektrum (Diagramm) sichtbar. Da die dazu notwendigen Energien bzw. Frequenzen charakteristisch für die jeweiligen Bindungen sind, können so auch Materialien identifiziert werden. Die IR-Spektroskopie ist somit strukturaufklärend.
Wechselwirkung zwischen elektromagnetischer Strahlung und dem Molekül kann nur dann auftreten, wenn im Molekül bewegte elektrische Ladung zur Verfügung steht. Das ist immer dann der Fall, wenn das Molekül entweder ein veränderbares oder ein induzierbares Dipolmoment aufweist (IR-aktiv). In Molekülen mit Schwingungen symmetrisch zum Symmetriezentrum treten keine Änderungen des Dipolmoments auf (IR-inaktiv). Solche „verbotenen“ Schwingungen sind allerdings oft ramanaktiv.
Der einfachste Fall ist ein zweiatomiges Molekül. Bei mehratomigen Molekülen kommt es zur Überlagerung von Grundschwingungen. Dementsprechend sieht man eine Reihe von Absorptionsbanden, die interpretiert werden müssen.
Mechanisches Modell
 Molekül zwischen zwei ungeladenen Kondensatorplatten |
 Molekül richtet sich im elektrischen Feld aus und vergrößert seinen Bindungsabstand |
Das denkbar einfachste Modell, welches zur Erklärung von Vibrations- und Rotationsanregungen verwendet werden kann, ist das klassische Modell der Wechselwirkung eines permanenten elektrischen Dipols im elektromagnetischen Feld. Später können in besseren Modellen, wie dem quantenmechanischen Modell, auch Moleküle ohne ein permanentes Dipolmoment beschrieben werden.
Zwischen den Atomen und ihren Nachbarn bestehen anziehende und abstoßende Wechselwirkungen. Daher befindet sich der optimale Bindungsabstand im Molekül im Minimum der Potentialfunktion. Mechanisch lässt sich dies so vorstellen, als wären die Atome durch Federn miteinander verbunden. Die Kraft, die man zur Auslenkung einer Feder braucht, wird mit dem hookeschen Federgesetz beschrieben. Bringt man nun ein solches Molekül in ein elektrisches Feld, wie es beispielsweise in einem Plattenkondensator besteht, wird sich das Molekül erstens mit seinem Dipolmoment entlang des elektrischen Feldes ausrichten und zweitens seinen Bindungsabstand vergrößern. Wird jetzt Wechselspannung angelegt oder regt man das Molekül mit einer elektromagnetischen Welle an, fangen die an den Bindungen „hängenden“ funktionellen Gruppen zu schwingen und zu rotieren an. Das mechanistische Modell ist allerdings nur sehr begrenzt tauglich, da es beispielsweise nicht erklärt, warum nur diskrete Energien zur IR-Anregung zugelassen sind und warum auch Moleküle ohne permanentes Dipolmoment eine IR-Absorption zeigen.
Quantenmechanisches Modell
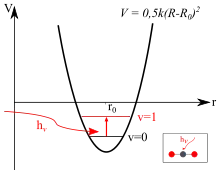
Wie auch im Modell der klassischen Mechanik ist die Grundlage des quantenmechanischen Modells der Vibrations- und Rotationsanregung die Potentialfunktion. Die Potentialfunktion lässt sich in ihrem Minimum gut durch eine Parabel annähern. Eine solche Parabel ergibt sich aus der Integration des hookeschen Federgesetzes.
Wird jetzt ein Molekül mit elektromagnetischer Strahlung angeregt, können innerhalb des Moleküls die Valenzbindungen in Schwingungen und Rotationen versetzt werden, wenn die Energie ausreicht, es aus seinem Grundzustand in den ersten angeregten Schwingungszustand zu heben. Um diese Energie zu bestimmen, muss die Schrödinger-Gleichung für dieses Potential gelöst werden. Nach Abtrennung der Relativbewegung von Atomkernen und Elektronen (Born-Oppenheimer-Näherung) ergibt sich als Lösung der Schrödinger-Gleichung ein Zusammenhang zwischen der benötigten Energie, der Bindungsstärke (k) und der reduzierten Masse (μ). Anders als beim klassischen harmonischen Oszillator ist im quantenmechanischen Fall die Schwingungsenergie durch die Schwingungsquantenzahl v gequantelt.
Schrödinger-Gleichung:
Lösung der Schrödinger-Gleichung:
Schwingungsformen
In anorganischen und organischen Substanzen treten bei Absorption von Strahlung aus dem infraroten Bereich mechanische Schwingungen auf. Gemäß R. Mecke können Molekülschwingungen in zwei Arten unterschieden werden:
- Valenzschwingungen (Streckschwingungen): Schwingungen entlang der Bindungsachse zweier Atome oder Molekülteile durch eine Dehnung oder Stauchung der Bindung
- Deformationsschwingungen: Schwingungen unter der Deformation des Bindungswinkels
- in der Ebene (Biege-/Beugeschwingungen):
- außerhalb der Ebene (Dreh-/Kippschwingungen) – meist senkrecht zur Bindungsebene
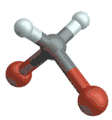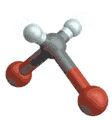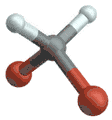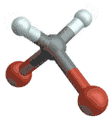 Symmetrische Streckschwingung
Symmetrische Streckschwingung
(engl. symmetrical stretching)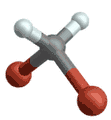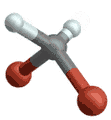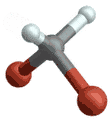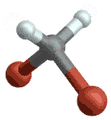 Antisymmetrische Streckschwingung
Antisymmetrische Streckschwingung
(engl. antisymmetrical stretching)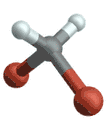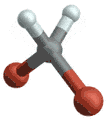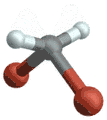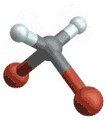 Biegeschwingung
Biegeschwingung
(engl. scissoring oder bending)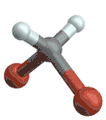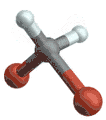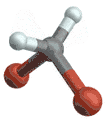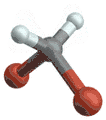 Schaukelschwingung
Schaukelschwingung
(engl. rocking) Wippschwingung
Wippschwingung
(engl. wagging)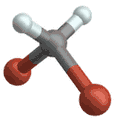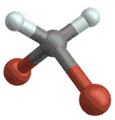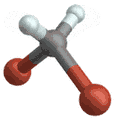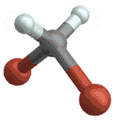 Drehschwingung
Drehschwingung
(engl. twisting oder torsing) Inversionsschwingung
Inversionsschwingung
(engl. umbrella mode)
Da Molekülschwingungen bestimmter Atomgruppen im Bereich von 4000–1500 cm−1 besonders charakteristisch sind, eignet sich die IR-Spektroskopie zur Bestimmung bestimmter Strukturelemente, insbesondere der funktionellen Gruppen des untersuchten Moleküls.
Das ideale Rotations-Schwingungs-Spektrum
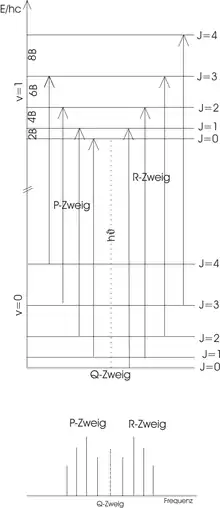
Chlorwasserstoff (HCl) ist ein zweiatomiges Molekül mit einem ausgeprägten Dipolmoment. Das HCl-Molekül kann vereinfacht als ein linearer Kreisel angesehen werden. Wie auch in der reinen Rotationsspektroskopie, kann das Modell des starren Rotators zur Beschreibung von Spektren verwendet werden. Für ein lineares Molekül ist die spezielle Auswahlregel für einen Rotationsübergang:
- ,
wobei die Rotationsquantenzahl darstellt. Wenn das Dipolmoment parallel zur Hauptrotationsachse liegt (wie z. B. beim Ammoniak), wäre auch möglich. Für einen Schwingungsübergang des harmonischen Oszillators lautet die spezielle Auswahlregel:
Die Übergänge zwischen den verschiedenen Rotationsniveaus () des Schwingungsgrundzustandes () und den Rotationsniveaus () des angeregten Schwingungszustandes () können in zwei Gruppen, den R-Zweig (rechts) für Übergänge mit und den P-Zweig (links) für Übergänge mit , unterteilt werden und sind in der Abbildung skizziert. Da für HCl nicht erlaubt ist, erscheint auch kein Q-Zweig. Im oberen Bild ist das Energieniveauschema abgebildet. Anhand der Pfeillänge ist deutlich zu erkennen, dass jeder Übergang eine Energiezufuhr von
erfordert, wobei die Rotationskonstante mit der Einheit ist. Diese beinhaltet das Trägheitsmoment des Moleküls bezüglich der Rotationsachse.
Für die Energiedifferenz zum benachbarten Übergang gilt damit
Im idealen Rotationsschwingungsspektrum (unteres Bild) haben daher die Peaks einen konstanten Abstand von 2B. Im Experiment weisen die Peaks etwas andere Abstände auf, da das Modell nicht:
- die Anharmonizität der Schwingung
- den gedehnten Atomabstand durch die Zentrifugalkräfte (Näherung: Starrer Rotator)
- und die Wechselwirkung von Schwingungs- und Rotationsbewegung beachtet.
Das reale Rotations-Schwingungs-Spektrum
Das reale Rotations-Schwingungs-Spektrum weicht aufgrund von Einschränkungen der angewendeten Modelle vom idealen ab. Die Abstände der Peaks (Amplitudenausschlag im Diagramm, auch Banden genannt) betragen nicht wie im idealen Fall genau 2B, sondern werden infolge der Wechselwirkung von Rotation und Schwingung im R-Zweig mit steigender Wellenzahl kleiner, im P-Zweig hingegen größer. Das nebenstehende Diagramm zeigt ein aufgenommenes Spektrum von Chlorwasserstoff in der Gasphase. In der Feinstruktur des Spektrums ist gut eine Verdoppelung aller Banden durch die beiden verschieden trägen Isotope des Chlors zu erkennen.
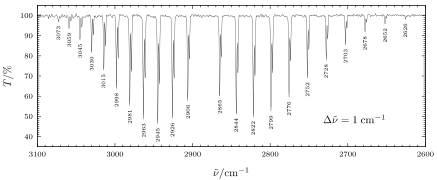 Rotations-Schwingungs-Spektrum von gasförmigem Chlorwasserstoff bei Raumtemperatur.
Rotations-Schwingungs-Spektrum von gasförmigem Chlorwasserstoff bei Raumtemperatur.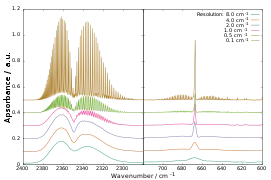 Rotations-Schwingungs-Spektrum von gasförmigem Kohlenstoffdioxid bei Raumtemperatur gemessen mit unterschiedlichen Auflösungen.
Rotations-Schwingungs-Spektrum von gasförmigem Kohlenstoffdioxid bei Raumtemperatur gemessen mit unterschiedlichen Auflösungen.
Lage und Auswertung der IR-Absorptionsbanden
Stärkere chemische Bindungen und Atome kleinerer Masse verursachen im IR-Spektrum Absorptionsmaxima bei großen Wellenzahlen (hohe Energie), große Massen hingegen verursachen IR-Absorptionsmaxima bei kleinen Wellenzahlen (niedrige Energie) (siehe Deuterierung). Die Energie ist proportional zum Quadrat des permanenten Dipolmomentes. Daher liefern polare Moleküle intensive Rotationsübergänge. Vergleicht man allerdings die Amplituden der Peaks eines einzelnen Moleküls miteinander, fällt auf, dass die Stärke der Übergänge mit wachsenden J zunächst schnell zunehmen, durch ein Maximum gehen und schließlich für große J wieder abfallen. Die Ursache dafür ist, dass die Stärke die Entartungen der verschiedenen Rotationszustände und die Besetzungszahlen der Rotationsniveaus im Ausgangszustand widerspiegelt. Der Grad der Entartung nimmt mit steigendem J zu, was zu einer höheren Energie führt. Andererseits nehmen die Besetzungszahlen mit steigender Energie ab, was schließlich zu einer Abnahme der Strahlungsstärke führt.
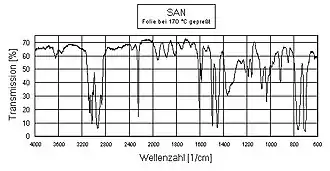
IR-Spektren werden interpretiert, um aus der Kurve des gemessenen IR-Spektrums die Molekülgestalt herleiten zu können. Dabei werden die verschiedenen Schwingungsvarianten der Moleküle gemessen und daraus auf das Vorhandensein bestimmter Strukturelemente geschlossen. Ein typisches IR-Spektrum reicht von 4000 cm−1 bis 400 cm−1 (Wellenzahl). Die Wellenzahl wird in der etwas ungewöhnlichen Einheit cm−1 angegeben. Dies besitzt jedoch den Vorteil, dass Wellenzahl und Anregungsenergie proportional sind. Die Wellenzahl multipliziert mit dem planckschen Wirkungsquantum und der Lichtgeschwindigkeit ergibt die Energie. Bei einem IR-Spektrum hinterlässt jedes Molekül ein typisches Muster aus Absorptionsbanden. Die Länge dieser Banden wird üblicherweise nicht numerisch ausgewertet, sondern lediglich mit Attributen wie "stark" oder "wenig intensiv" bewertet. Ab etwa 1500 cm−1 abwärts wird die Zuordnung einzelner Banden zu bestimmten Molekülschwingungen deutlich schwerer, da die Anzahl der möglichen Überlagerungen durch Gerüstschwingungen sehr hoch wird. Dieser sogenannte Fingerprint-Bereich sollte idealerweise für jede Molekülsorte ein charakteristisches Spektrum liefern. Tatsächlich kann aber davon ausgegangen werden, dass einige Unterschiede nicht durch die Messgenauigkeit der Spektralanalyse dargestellt werden können. In diesem Bereich liegen aber auch einige für bestimmte Strukturelemente charakteristische Banden. Enantiomerenpaare zeigen vollkommen gleiche Spektren, sofern kein linear polarisiertes IR-Licht verwendet wird. Soweit keine Reinsubstanzen, sondern Gemische vorliegen, enthält das IR-Spektrum die Informationen über Strukturelemente aller Bestandteile des Gemisches. Mit entsprechend hochauflösenden Spektren können aber trotzdem einzelne Bestandteile anhand charakteristischer Absorptionen bestimmter Stoffgruppen oder einer Kombination mehrerer Absorptionen detektiert werden. Oft erfolgt dazu ein direkter Abgleich mit einem Spektrum der Reinsubstanz.
Die individuelle Zuordnung der Banden erfolgt anhand von tabellierten empirischen Daten. Die genaue Lage einer Bande kann durch die chemische Umgebung der jeweiligen Atomgruppe zu höheren oder niedrigeren Wellenzahlen verschoben sein, wodurch weitere Rückschlüsse auf die Nachbarschaft bestimmter Strukturelemente möglich werden. Bei der Interpretation von Bandenlagen muss allerdings berücksichtigt werden, dass verschiedene optische Effekte ebenfalls zu Bandenverschiebungen führen können, wie z. B. Interferenz und Ausrichtungseffekte sowie die Polarisation von Materie durch Licht. Dies erschwert die Interpretation solcher Verschiebungen.[2]
| Bezeichnung nach Mecke/ Atomgruppe | Wellenzahlbereich in cm−1 | Bemerkung |
|---|---|---|
| ν(–C–Hx) | 2850–3200 | ν = Streckschwingung; × = 1…3, Anzahl der gebundenen Wasserstoffatome |
| δ(–C–Hx) | 1400 | δ = Deformationsschwingung; × = 1…3, Anzahl der gebundenen Wasserstoffatome |
| –C=C | 1650 | |
| –C≡C | 2200–2500 | |
| ν(–OH) | 3200–3600 | In Verbindung mit Wasserstoffbrückenbindungen häufig Banden über einen großen Spektralbereich, beispielsweise bei flüssigem Wasser |
| ν(–OH) | 2500–3000 | in Carboxygruppen |
| –C=O | 1700 | |
| ν(–C≡N) | 2200–2260 | Valenzschwingung, z. B. in ABS oder SAN (s. Bild) |
| ν(–NH) | 3100–3500 | |
| –NO2 | 1500 | |
| –C–X | < 1500 | wobei X für ein Halogen steht |
| νas(O=C=O) | 2349 | Kohlendioxid. |
IR-Spektroskopie-Techniken
Transmission
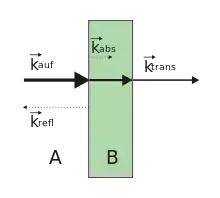
Eine der am häufigsten eingesetzten Methoden ist die Messung des Transmissionsgrades einer Probe. Dazu wird eine Probe mit Infrarot durchstrahlt und der Anteil der Messstrahlung gemessen, der die Probe durchdrungen hat. Besitzt die Probe IR-aktive Bindungen oder Molekülgruppen, sind im Transmissionsspektrum Bereiche geringerer Intensität (Absorptionsbanden) zu sehen. Die Intensität der Bande nimmt gemäß dem Lambert-Beerschen Gesetz (unter anderem) mit der Probendicke zu (dabei ist allerdings zu berücksichtigen, dass dieses Gesetz generell nur näherungsweise gilt, weil es nicht mit den Maxwellschen Gleichungen kompatibel ist. Dementsprechend ergeben sich je nach verwendeter Messtechnik mehr oder weniger große Abweichungen. Ausführliche Erklärungen sowie mögliche Lösungen finden sich in[4]). Zusätzlich wird auch noch ein Teil der Strahlung reflektiert, entsprechende Anteile wirken sich meist als über das gesamte Spektrum erhöhte verringerte Transmission aus und können mit einer Grundlinienkorrektur großteils entfernt werden.
Je nach Probenform (gasförmig, flüssig, fest) gibt es spezielle Messtechniken, die sich in der Art der Probenvorbereitung und der Messzellen (Probenhalter mit mehr oder weniger komplizierten Strahlenwegen) unterscheiden. Die einfachste Messanordnung entspricht einem simplen Probenhalter, der einen Feststoff (beispielsweise eine Folie oder Platte) im Strahlengang des Spektrometers fixiert. Bei Proben mit parallelen Grenzflächen (wie bei einer Folie) entstehen jedoch Interferenzen durch Mehrfachreflexionen in der Probe (siehe auch newtonsche Ringe) die je nach Dicke und Planparallelität das Spektrum verfälschen, die Interferenzen können aber auch für eine Schichtdickenbestimmung genutzt werden.
 Presswerkzeug zur Herstellung von KBr-Presslingen (Einzelteile) |
 Presswerkzeug im Einsatz |
 Einfache Transmissionhalterung für die Infrarotspektroskopie von 13-mm-KBr-Presslingen. Anbei zwei Presslinge aus reinem KBr (rechts) und einer stark streuenden Probe in KBr (links, weißer Pressling) |
Eine weit verbreitete Technik feste Proben zu messen, ist die Einbettung der Festkörper in ein IR-transparentes Trägermaterial (auch Matrix genannt). Man verwendet hauptsächlich anorganische Salze wie Halogenide der Alkalimetalle, eine gängige Matrix ist Kaliumbromid (KBr). Zur Messung von Feststoffen wird trockenes Kaliumbromid-Pulver (KBr ist hygroskopisch) mit etwas Probensubstanz gemischt und gemeinsam intensiv zermahlen. Anschließend wird dieses Gemisch in einem Stahlzylinder unter Vakuum und hohem mechanischem Preßdruck zu einer Tablette gepresst. Bei diesem Druck wird das Kaliumbromid plastisch und es entstehen durch kalten Fluss (meist auch optisch) transparente „Presslinge“. Diese können dann einfach im Strahlengang platziert werden.
Flüssige Proben können zwischen zwei IR-transparente Platten, hergestellt aus Einkristallen von Alkalimetallhalogeniden oder selten transparente Polymerplatten, platziert werden. Dies kann statisch oder auch dynamisch in Form einer Durchflusseinheit erfolgen. Gasförmige Proben werden in der Regel in spezielle Küvetten eingebracht.
Schichtdickenmessung
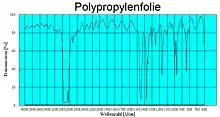 Polypropylenfolie mit Interferenzen (Dicke ca. 38 µm) |
 Polypropylenfolie ohne Interferenzen |
Da es bei planparallelen dünnen Proben zu Interferenzen kommt, wird das eigentliche Spektrum von einem sinusförmigen Wellenzug überlagert. Aus der Lage der Maxima kann man die Dicke der Folie berechnen.
mit der Brechungsindex der Probe und der Anzahl der Maxima im Spektralbereich zwischen den Wellenzahlen und .
Eliminieren kann man die Interferenzen bei Folien, indem man sie knittert oder aufraut. Dabei erhöht man aber den Anteil der diffusen Reflexion. Eine alternative Methode ist eine sogenannte Dispersionanalyse. Dabei wird das gemessene Spektrum auf Basis von Wellenoptik und Dispersionstheorie modelliert und die optischen Konstanten sowie die Schichtdicke und die Oszillatorparameter gewonnen. Auf diese Art und Weise können generell etliche der optischen Effekte absepariert werden.[5]
Christiansen-Effekt
Der Christiansen-Effekt (nach Christian Christiansen) ist ein Artefakt bei IR-Transmissionsmessungen von in Kaliumbromid oder einer anderen Matrix eingebundenen Substanzen (so genannte Presslinge). Er äußert sich vor allem durch asymmetrische Banden im Spektrum. Dabei zeigt die hochfrequente Flanke einen sehr steilen Verlauf (oft höher als die Basis des Spektrums). Die niederfrequente Flanke zeigt dementgegen eher einen flachen, langgezogenen Verlauf. Die Ursache liegt in der anomalen Dispersion in der Nähe starker Absorptionsbanden. Beobachtet wird der Effekt jedoch nur bei Presslingen, bei denen die zu untersuchende Substanz zu grobkörnig ist, oder bei Proben mit größerem Unterschied im Brechungsindex zwischen der zu untersuchenden Substanz und dem Matrixmaterial. Das heißt, der Effekt kann minimiert bzw. verhindert werden, wenn die Substanz durch Zermahlen stärker verkleinert wird.[6][7][8]
Reflexion und Absorption

 Messeinrichtung für Reflexionsmessungen |
 Im Strahlengang eingebaute Messeinrichtung für Reflexionsmessungen, an der durch das rote "X" gekennzeichneten Stelle wird die Probe aufgebracht |
Eine andere Methode ist die (externe) Reflexion der IR-Strahlung an einer glatten Oberfläche. Die Methode nutzt den Umstand, dass der Reflexionsgrad einer Probe abhängig vom komplexen Brechungsindex der Proben ist (vgl. fresnelsche Formeln). Im Bereich der Schwingungszentren steigt die Absorption, was im komplexen Brechungsindex durch einen Anstieg des Extinktionskoeffizienten (der Imaginärteil des Brechungsindexes) dargestellt wird. Dieser Anstieg ist begleitet von einer Änderung des Brechungsindex um die Absorptionsbande herum, welcher in erster Näherung proportional zu diesem Anstieg ist. Sowohl der Anstieg des Brechungsindex, als auch der des Absorptionsindex führt zu einer erhöhten Reflexion der Probe für diesen Frequenzbereich und einer Bande im Reflexionsspektrum.[9] Für schwache Oszillatoren, wie sie hauptsächlich in organischen Materialien vorkommen, überwiegt der Einfluss der Brechungsindexänderung, weshalb die Spektren derivationsähnliche Bandenformen zeigen, wohingegen mit steigender Oszillatorstärke der Einfluss des Absorptionsindex immer mehr zunimmt und die Bandenform bestimmt. Die Ursache der derivationsähnlichen Bandenformen liegt in der anomalen Dispersion in der Nähe von Absorptionszentren eines Materials, das heißt der Brechungsindex steigt hier mit der Wellenlänge an, anstatt wie sonst zu fallen. Dies führt zu einer geänderten Reflektivität und somit zu den beobachteten verzerrten Banden. Ein steigender Einfluss des Absorptionsindex führt hingegen zu Bandenformen die übergangsweise Absorptionsbanden ähneln, bevor sie zu sehr breiten Banden mit Plateaus in der Nähe von 100 % Reflexion werden deren Senken dann auf Gegenwart von schwächeren Oszillatoren hindeuten.[9]
Die Technik eignet sich unter anderem für die Messung stark absorbierender Proben. Hauptnachteil der Methode ist, dass sich die Reflexionsspektren stark von Transmissionsspektren unterscheiden. Für die Reflexionsspektren von organischen Materialien wurde unlängst eine neue quantitative Auswertemethode vorgeschlagen, die eine ähnlich einfache Auswertung wie die von Absorbanzspektren auf Basis des Lambert-Beerschen Gesetz ist. Die Methode wird dementsprechend Infrarot-Refraktionsspektroskopie genannt.[10] Für die Reflexionsspektren anorganischer Materialien mit starken Oszillatoren wird entweder die Dispersionsanalyse oder die Kramers-Kronig-Transformation (KKT) genutzt um das Absorptionsspektrum der Probe zu berechnen.[9]
Neben dem oben beschriebenen Verfahren existiert noch eine weitere Reflexionsmethode, die vor allem für dünne Schichten und Adsorbaten geeignet ist, die sogenannte Technik der „Infrarot-Reflexions-Absorptions-Spektroskopie“ (engl.: infrared reflection absorption spectroscopy, IRRAS, auch IRAS). Hierbei wird Infrarotstrahlung an einer Metalloberfläche (extern) reflektiert auf der sich die zu untersuchende Schicht befindet. Durch die sehr hohe Reflektivität der Metallschicht (> 90 %) wird die Infrarotstrahlung quasi zweimal durch die Probe geführt. Zudem kommt es ähnlich wie bei der Oberflächenplasmonenresonanzspektroskopie zu einer Feldverstärkung an der Metalloberfläche, dies macht die Methode selbst für Monolagen sensitiv, also dünne Schichten mit einer Schichtdicke von einigen Ångström; die Detektion von Monolagen ist auch mit anderen Messtechniken der Infrarotspektroskopie möglich. Die Messung erfolgt in der Regel in quasistreifenden Einfall, das heißt mit einem Einfallswinkel von rund 80° vom Lot. Des Weiteren kann durch den Einsatz von p-polarisierter Strahlung die Sensitivität der Methode gesteigert werden. Auch in diesem Fall können die Spektren mit der Methode der Dispersionsanalyse quantitativ ausgewertet werden.[9]
Diffuse Reflexion
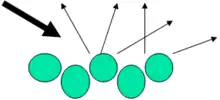
Mit der diffusen Reflexionsspektroskopie (DRIFTS) können raue Festkörper und Pulver untersucht werden, ohne letztere in eine Matrix zu pressen (vgl. Transmissionmessungen). Der Infrarotstrahl wird auf die Probe geführt und dort aufgrund der rauen Oberfläche nicht mehr gerichtet (wie bei einem Spiegel), sondern diffus reflektiert. Die reflektierte Strahlung wird von einer speziellen Spiegelanordnung, halbkugelförmig über der Probe (vgl. Hohlspiegel), wieder gebündelt und zum Detektor geführt.
Durch die diffuse Reflexion sind die Strahlenanteile ungleich verteilt und das entstehende Spektrum weist Besonderheiten auf, die einen direkten Vergleich mit Spektren anderer IR-Techniken nur sehr eingeschränkt zulassen. Für eine Auswertung (qualitativ und quantitativ) kann das Spektrum mithilfe der Kubelka-Munk-Funktion in ein Absorptionsspektrum umgewandelt werden.
Abgeschwächte Totalreflexion (ATR)

Bei der ATR-Infrarotspektroskopie wird die Strahlung in einem Reflexionselement (quasi ein Lichtwellenleiter) in Totalreflexion geführt. Dabei bildet sich an der Grenzfläche des Elements ein evaneszentes Feld aus, dessen Amplitude senkrecht zur Grenzfläche exponentiell abklingt (evaneszente Welle). Befindet sich hinter der Grenzfläche eine Probe, wechselwirkt das evaneszente Feld mit der Probe, das heißt, bestimmte Frequenzbereiche können durch die Probe absorbiert werden. Die absorbierten Bereiche fehlen nun im Spektrum des reflektierten Strahls, der zum Detektor geführt wird. Da das Feld recht schnell abklingt, müssen Proben für die Messung sehr nah an die Oberfläche gebracht werden, um noch auswertbare Bandenintensitäten zu erreichen. Der gemessene Bereich umfasst meist nur die ersten Mikrometer der Probe. Es ergeben sich ähnliche Spektren wie bei der Transmissionsspektroskopie, die jedoch im Vergleich dazu wellenlängenabhängige Intensitätsunterschiede aufweisen. Diese Methode eignet sich für feste und flüssige Proben mit vergleichsweise schwachen Absorptionen, die nur von geringen Brechungsindexänderungen begleitet sind, andernfalls ist das elektrische Feld nicht mehr evaneszent in der Probe.[11]
Emission

Bei der Infrarotemissionsspektroskopie (engl. infrared emission spectroscopy, IRES) wird die von einer Probe emittierte Infrarotstrahlung untersucht. Das heißt, anders als bei den zuvor beschriebenen Methoden der Absorptionsspektroskopie wird die Probe nicht von einer Lichtquelle hoher Temperatur durchstrahlt und mit einem Referenzspektrum ohne Probe verglichen, sondern es dient die Probe selbst als Strahlungsquelle. Die erhaltenen Emissionsspektren zeigen deutlich weniger Details bezüglich der Rotationsspektren und die Bandenintensität und -form ist stärker von der Temperatur abhängig.[2]
Die Messung von Proben ohne Referenzspektrum ist möglich, da ein Molekül, das sich in einem angeregten Schwingungszustand befindet, mit einer gewissen Wahrscheinlichkeit Infrarotstrahlung emittieren kann. Die gemessenen Emissionsbanden entsprechen in der Regel dem Übergang von einem angeregten in den Grundzustand. Die Emission kann sowohl durch Anwesenheit (durch induzierte Emission) als auch in Abwesenheit (durch spontane Emission) einer einfallenden elektromagnetischen Strahlung erfolgen. Allerdings ist bei Raumtemperatur die Anzahl an Molekülen, die sich in einem angeregten Zustand befinden, verhältnismäßig gering (kleiner 1 % der Anzahl im Grundzustand, ausgehend von einem Grenzwert bei 1000 cm−1)[12] und daher deutlich geringer als bei der Absorption. Um ein stärkeres Signal zu bekommen, wird daher eine Probe in der Regel erhitzt (meist über 100 °C) und die emittierte Strahlung gemessen (vgl. Schwarzer Körper).[13][12] Darüber hinaus sind ausgehend vom Produkt aus Boltzmann-Faktor und der Übergangswahrscheinlichkeit nur sehr geringe Strahlungsenergien zu erwarten,[14] so dass die IRE-Spektroskopie lange Zeit sehr aufwendig war und nur eine geringe Empfindlichkeit zeigte. Durch verbesserte Interferometer und neue empfindliche Detektoren können Emissionsspektren heutzutage routinemäßig aufgenommen werden.
Eingesetzt wird die IRE-Spektroskopie unter anderem bei der Untersuchung von Lacken, Salzschmelzen und Silikate sowie katalytischen Reaktionen an dünnen Schichten und adsorbierten Spezies auf Festkörpern. Vorteile bietet diese Methode vor allem bei In-situ-Messungen bei hohen Temperaturen, da hier, anders als beispielsweise bei Reflexionstechniken, die Überlagerungen der Absorptionsbanden mit den Emissionsbanden vernachlässigbar sind. Des Weiteren kann die IRE-Spektroskopie auch bei der Messung von großen Gasvolumen eingesetzt werden, beispielsweise in der Prozessanalytik.
Problematisch können Messungen von Mehrfachschichten oder generell größeren Volumen sein, da hier Absorptions- sowie Emissions-Reabsorptions-Prozesse stattfinden und die gemessenen Spektren beeinflussen. Weitere Einflussparameter auf das Spektrum sind unter anderem die Geometrie der Probe, die Wahl des Strahlungshintergrunds, Streustrahlung und, wie bereits erwähnt, die Temperatur der Probe selbst. Aus diesen Gründen sind selbst IR-Emissionsspektren mit einem hohen Signal-Rausch-Verhältnis sehr komplex und schwer auszuwerten. In der Literatur wurden daher diverse Methoden vorgestellt, um die Störeinflüsse zu kompensieren.[15]
Siehe auch
Literatur
- Helmut Günzler, Hans-Ulrich Gremlich: IR-Spektroskopie: Eine Einführung. 4. Auflage. Wiley-VCH, Weinheim 2003, ISBN 978-3-527-30801-9.
- M. Hesse, H. Meier, B. Zeeh: Spektroskopische Methoden in der organischen Chemie. 6. Auflage. Thieme, Stuttgart 2002, ISBN 3-13-576107-X.
- Bernhard Schrader: Infrared And Raman Spectroscopy. VCH, 1995, ISBN 3-527-26446-9.
Weblinks
- Grundlagen und Technik der Infrarot-Spektroskopie
- Spectral Database for Organic Compounds, SDBS (englisch)
- Sammlung verschiedener IR-Spektren
- IR-Spektroskopie & Organische Chemie (englisch)
- Rotationsschwingungsspektren bei Chemgapedia
- Verzeichnis der ETH Zürich von Datenbanken und Nachschlagewerken mit IR-Spektren
- Verzeichnis der ETH Zürich von Datenbanken und Nachschlagewerken mit Fern-IR-Spektren
- Verzeichnis der ETH Zürich von Datenbanken und Nachschlagewerken mit Nah-IR-Spektren
Einzelnachweise
- BGR Infrarot-Spektroskopie. Abgerufen am 17. Juli 2008.
- Alexander Erlich: Fourier-Transform-Infrarot-Spektroskopie. (Memento vom 11. Dezember 2014 im Internet Archive) (Beispiele für IRES-Spektren; PDF; 2,6 MB), 8. Juli 2010.
- Helmut Günzler, Hans-Ulrich Gremlich: IR-Spektroskopie: Eine Einführung. 4. Auflage. Wiley-VCH, Weinheim 2003, ISBN 978-3-527-30801-9, S. 165–240.
- Thomas Günter Mayerhöfer, Susanne Pahlow, Jürgen Popp: The Bouguer-Beer-Lambert law: Shining light on the obscure. In: ChemPhysChem. n/a, n/a, 14. Juli 2020, ISSN 1439-4235, doi:10.1002/cphc.202000464.
- Thomas G. Mayerhöfer, Susanne Pahlow, Uwe Hübner, Jürgen Popp: Removing interference-based effects from infrared spectra – interference fringes re-revisited. In: Analyst. Band 145, Nr. 9, 4. Mai 2020, ISSN 1364-5528, S. 3385–3394, doi:10.1039/D0AN00062K (rsc.org [abgerufen am 10. Januar 2021]).
- C. Christiansen: Untersuchungen über die optischen Eigenschaften von fein verteilten Körpern – Erste Mittheilung. In: Annalen der Physik und Chemie. 23, 1884, S. 298–306.
- C. Christiansen: Untersuchungen über die optischen Eigenschaften von fein verteilten Körpern – Zweite Mittheilung. In: Annalen der Physik und Chemie. 24, 1885, S. 439–446.
- C. V. Raman: The theory of the Christiansen experiment. In: Proc. Ind. Acad. Sci. 29, 1949, S. 381–390.
- (PDF) Wave optics in Infrared Spectroscopy. Abgerufen am 21. August 2021 (englisch).
- Thomas G. Mayerhöfer, Vladimir Ivanovski, Jürgen Popp: Infrared Refraction Spectroscopy. In: Applied Spectroscopy. 18. August 2021, ISSN 0003-7028, S. 000370282110367, doi:10.1177/00037028211036761 (sagepub.com [abgerufen am 21. August 2021]).
- Thomas Mayerhöfer: Wave optics in Infrared Spectroscopy. 2021, doi:10.13140/RG.2.2.14293.55520 (rgdoi.net [abgerufen am 26. April 2021]).
- W. Suëtaka: Surface Infrared and Raman Spectroscopy: Methods and Applications. Springer, New York 1995, ISBN 0-306-44963-3, S. 163 ff.
- S. Zhang, F. S. Franke, T. M. Niemczyk: Emission Spectroscopy. In: Francis Mirabella, Mirabella (Hrsg.): Modern Techniques in Applied Molecular Spectroscopy. Wiley & Sons, 1998, ISBN 0-471-12359-5, S. 323–376 (Einführung mit Beschreibungen zu verschiedenen Techniken).
- K. Molt: Aufnahme von Infrarot-Emissionsspektren dünner Schichten auf Metalloberflächen mit Hilfe eines rechnergekoppelten Gitterspektrometers. In: Fresenius’ Zeitschrift für Analytische Chemie. Band 308, Nr. 4, 1981, S. 321–326, doi:10.1007/BF00516246 (mit Bezug auf G. Herzberg: Spectra of diatomic molecules. Van Nostrand, Princeton 1950.).
- Francis M. Mirabella: Modern techniques in applied molecular spectroscopy. Wiley-IEEE, 1998, ISBN 978-0-471-12359-0, 9. Emission Spectroscopy, S. 323–377.